
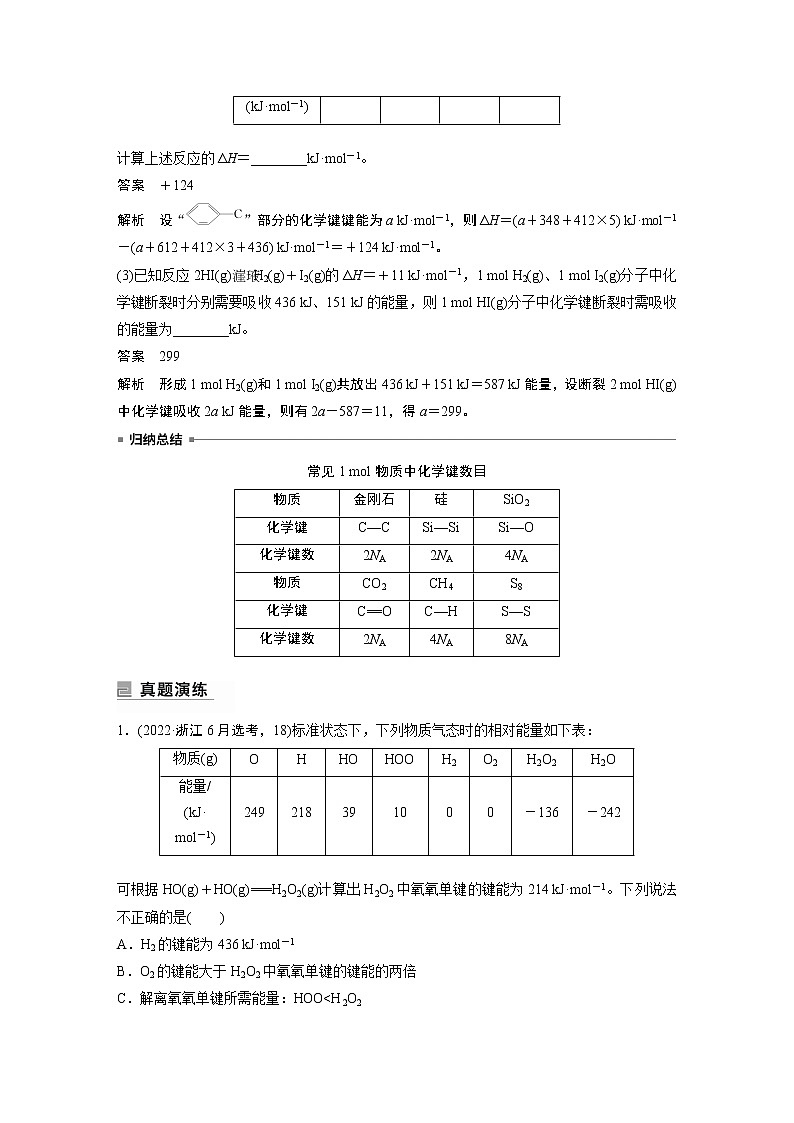

2023版高考化学步步高大二轮复习讲义第一部分 专题11 热化学方程式的书写与盖斯定律【解析版】
展开考点一 焓变(ΔH)的计算
1.根据(相对)能量计算ΔH
ΔH=H(生成物)-H(反应物)
2.根据键能计算ΔH
ΔH=∑E(反应物键能)-∑E(生成物键能)
按要求回答下列问题:
(1)航天员呼吸产生的CO2利用Bsch反应:CO2(g)+2H2(g)C(s)+2H2O(g) ΔH,再电解水可实现O2的循环利用。热力学中规定由最稳定单质生成1 ml某物质的焓变称为该物质的标准生成焓(符号:ΔfHeq \\al(θ,m)),最稳定单质的标准生成焓规定为0。已知上述反应中:ΔfHeq \\al(θ,m)(CO2)=-394 kJ·ml-1;
ΔfHeq \\al(θ,m)(H2)=0 kJ·ml-1;ΔfHeq \\al(θ,m)(C)=0 kJ·ml-1;ΔfHeq \\al(θ,m)(H2O)=-242 kJ·ml-1,则ΔH=________ kJ·ml-1。
答案 -90
解析 ΔH=生成物的总焓-反应物的总焓,若规定最稳定单质的标准生成焓为0,则各物质的标准生成焓可看作该物质的总焓,可得ΔH=2ΔfHeq \\al(θ,m)(H2O)-ΔfHeq \\al(θ,m)(CO2)=2×(-242 kJ·ml-1)-(-394 kJ·ml-1)=-90 kJ·ml-1。
(2)乙苯催化脱氢制苯乙烯反应:
eq \(,\s\up7(催化剂))
+H2(g)
已知:
计算上述反应的ΔH=________kJ·ml-1。
答案 +124
解析 设“”部分的化学键键能为a kJ·ml-1,则ΔH=(a+348+412×5) kJ·ml-1-(a+612+412×3+436) kJ·ml-1=+124 kJ·ml-1。
(3)已知反应2HI(g)H2(g)+I2(g)的ΔH=+11 kJ·ml-1,1 ml H2(g)、1 ml I2(g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 ml HI(g)分子中化学键断裂时需吸收的能量为________kJ。
答案 299
解析 形成1 ml H2(g)和1 ml I2(g)共放出436 kJ+151 kJ=587 kJ能量,设断裂2 ml HI(g)中化学键吸收2a kJ能量,则有2a-587=11,得a=299。
常见1 ml物质中化学键数目
1.(2022·浙江6月选考,18)标准状态下,下列物质气态时的相对能量如下表:
可根据HO(g)+HO(g)===H2O2(g)计算出H2O2中氧氧单键的键能为214 kJ·ml-1。下列说法不正确的是( )
A.H2的键能为436 kJ·ml-1
B.O2的键能大于H2O2中氧氧单键的键能的两倍
C.解离氧氧单键所需能量:HOO
答案 C
解析 根据表格中的数据可知,H2的键能为218 kJ·ml-1×2=436 kJ·ml-1,A正确;由表格中的数据可知O2的键能为249 kJ·ml-1×2=498 kJ·ml-1,由题中信息可知H2O2中氧氧单键的键能为214 kJ·ml-1,则O2的键能大于H2O2中氧氧单键的键能的两倍,B正确;由表格中的数据可知HOO===HO+O,解离其中氧氧单键需要的能量为249 kJ·ml-1+39 kJ·ml-1-10 kJ·ml-1=278 kJ·ml-1,H2O2中氧氧单键的键能为214 kJ·ml-1,C错误;由表中的数据可知H2O(g)+O(g)===H2O2(g)的ΔH=-136 kJ·ml-1-(-242 kJ·ml-1)-249 kJ·ml-1=-143 kJ·ml-1,D正确。
2.[2021·湖南,16(1)]氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。
方法Ⅰ.氨热分解法制氢气
相关化学键的键能数据
在一定温度下,利用催化剂将NH3分解为N2和H2。回答下列问题:
反应2NH3(g)N2(g)+3H2(g)
ΔH=______ kJ·ml-1。
答案 +90.8
解析 根据反应热=反应物的总键能-生成物的总键能,2NH3(g)N2(g)+3H2(g),ΔH=390.8 kJ·ml-1×3×2-(946 kJ·ml-1+436.0 kJ·ml-1×3)=+90.8 kJ·ml-1。
1.目前Haber-Bsch法是工业合成氨的主要方式,其生产条件需要高温高压。为了有效降低能耗,过渡金属催化还原氮气合成氨被认为是具有巨大前景的替代方法。催化过程一般有吸附—解离—反应—脱附等过程,图示为N2和H2在固体催化剂表面合成氨反应路径的势能面图(部分数据略),其中“*”表示被催化剂吸附。
氨气的脱附是________(填“吸热”或“放热”)过程,合成氨的热化学方程式为________________________________________________________________________。
答案 吸热 N2(g)+3H2(g)2NH3(g) ΔH=-92 kJ·ml-1
解析 由势能面图可知,氨气从催化剂上脱离时势能面在升高,为吸热过程,由图可知,eq \f(1,2) ml氮气和eq \f(3,2) ml氢气生成1 ml氨气的反应热为21 kJ·ml-1-17 kJ·ml-1-50 kJ·ml-1=-46 kJ·
ml-1,则合成氨的热化学方程式为N2(g)+3H2(g)2NH3(g) ΔH=-92 kJ·ml-1。
2.CO2经过催化氢化合成低碳烯烃。其合成乙烯的反应为2CO2(g)+6H2(g)CH2==CH2(g)+4H2O(g) ΔH。几种物质的能量(在标准状况下规定单质的能量为0,测得其他物质在生成时所放出或吸收的热量)如下表所示:
则ΔH=______________。
答案 -128 kJ·ml-1
解析 反应焓变=生成物总能量-反应物总能量,则该反应的焓变为52 kJ·ml-1+(-242 kJ·
ml-1)×4-(-394 kJ·ml-1)×2-0=-128 kJ·ml-1。
3.已知NO2和N2O4的结构式分别是和。实验测得N—N的键能为167 kJ·
ml-1,NO2中氮氧双键的平均键能为466 kJ·ml-1,N2O4中氮氧双键的平均键能为438.5 kJ·
ml-1。写出NO2转化为N2O4的热化学方程式:______________________________________。
答案 2NO2(g)N2O4(g) ΔH=-57 kJ·ml-1
解析 反应热=反应物的总键能-生成物的总键能,则反应热为2×2×466 kJ·ml-1-(167 kJ·ml-1+4×438.5 kJ·ml-1)=-57 kJ·ml-1,反应的热化学方程式为2NO2(g)N2O4(g) ΔH=-57 kJ·ml-1。
4.以下是部分共价键键能数据:
则2H2S(g)+SO2(g)===3S(g)+2H2O(g) ΔH=____________。
答案 -154 kJ·ml-1
解析 根据题图8个S原子有8个S—S共价键,则1个S原子平均有1个S—S共价键,ΔH=∑E(反应物键能)-∑E(生成物键能)=4×364 kJ·ml-1+2×522 kJ·ml-1-3×266 kJ·ml-1-4×464 kJ·ml-1=-154 kJ·ml-1。
考点二 热化学方程式的书写、盖斯定律
1.正误判断,正确的打“√”,错误的打“×”
(1)甲烷的燃烧热为890.3 kJ·ml-1,则甲烷燃烧的化学方程式可表示为CH4(g)+eq \f(3,2)O2(g)===
CO(g)+2H2O(l) ΔH=-890.3 kJ·ml-1( )
(2)已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·ml-1,则H2SO4和Ba(OH)2反应的ΔH=2×(-57.3) kJ·ml-1( )
(3)肼(N2H4)是一种高效清洁的火箭燃料。25 ℃、101 kPa时,0.25 ml N2H4(g)完全燃烧生成氮气和气态水,放出133.5 kJ热量。则该反应的热化学方程式为N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·ml-1( )
答案 (1)× (2)× (3)√
2.已知2 000 ℃时,有下列热化学反应:
①CaO(s)+C(s)Ca(g)+CO(g)
ΔH1=a kJ·ml-1
②Ca(g)+2C(s)===CaC2(s)
ΔH2=b kJ·ml-1
③CaCO3(s)===CaO(s)+CO2(g)
ΔH3=c kJ·ml-1
④2CaO(s)+CaC2(s)3Ca(g)+2CO(g) ΔH4
则ΔH4=________kJ·ml-1(用含a、b、c的代数式表示)。
答案 2a-b
1.热化学方程式书写易出现的错误
(1)未标明反应物或生成物的状态而造成错误。
(2)反应热的符号使用不正确,即吸热反应未标出“+”号,放热反应未标出“-”号,从而导致错误。
(3)漏写ΔH的单位,或者将ΔH的单位写为kJ,从而造成错误。
(4)反应热的数值与方程式的计量数不对应而造成错误。
(5)对燃烧热的概念理解不到位,忽略其标准是1 ml 可燃物而造成错误。
提醒 对于具有同素异形体的物质,除了要注明聚集状态之外,还要注明物质的名称。
如:①S(单斜,s)+O2(g)===SO2(g)
ΔH1=-297.16 kJ·ml-1
②S(正交,s)+O2(g)===SO2(g)
ΔH2=-296.83 kJ·ml-1
③S(单斜,s)===S(正交,s)
ΔH3=-0.33 kJ·ml-1
2.盖斯定律的答题模板——叠加法
步骤1 “倒”
为了将方程式相加得到目标方程式,可将方程式颠倒过来,反应热的数值不变,但符号相反。这样就不用再做减法运算了,实践证明,方程式相减时往往容易出错。
步骤2 “乘”
为了将方程式相加得到目标方程式,可将方程式乘以某个倍数,反应热也要乘以某个倍数。
步骤3 “加”
上面的两个步骤做好了,只要将方程式相加即可得目标方程式,反应热也要相加。
1.[2022·广东,19(1)②]铬及其化合物在催化、金属防腐等方面具有重要应用。
Cr2O3催化丙烷脱氢过程中,部分反应历程如图,X(g)→Y(g)过程的焓变为____________(列式表示)。
答案 E1-E2+ΔH+E3-E4
解析 设反应过程中第一步的产物为M,第二步的产物为N,则X→M的ΔH1=E1-E2,M→N的ΔH2=ΔH,N→Y的ΔH3=E3-E4,根据盖斯定律可知,X(g)→Y(g)的焓变为ΔH1+ΔH2+ΔH3=E1-E2+ΔH+E3-E4。
2.[2022·全国乙卷,28(1)]油气开采、石油化工、煤化工等行业废气普遍含有硫化氢,需要回收处理并加以利用。回答下列问题:
已知下列反应的热化学方程式:
①2H2S(g)+3O2(g)===2SO2(g)+2H2O(g)
ΔH1=-1 036 kJ·ml-1
②4H2S(g)+2SO2(g)===3S2(g)+4H2O(g)
ΔH2=+94 kJ·ml-1
③2H2(g)+O2(g)===2H2O(g)
ΔH3=-484 kJ·ml-1
计算H2S热分解反应④2H2S(g)===S2(g)+2H2(g)的ΔH4=________kJ·ml-1。
答案 +170
解析 根据盖斯定律(①+②)×eq \f(1,3)-③即得到④2H2S(g)===S2(g)+2H2(g)的ΔH4=(-1 036+94) kJ·ml-1×eq \f(1,3)+484 kJ·ml-1=+170 kJ·ml-1。
3.[2022·河北,16(1)]298 K时,1 g H2燃烧生成H2O(g)放热121 kJ,1 ml H2O(l)蒸发吸热44 kJ,表示H2燃烧热的热化学方程式为_____________________________________________
________________________________________________________________________。
答案 H2(g)+eq \f(1,2)O2(g)===H2O(l)
ΔH=-286 kJ·ml-1
解析 298 K时,1 g H2燃烧生成H2O(g)放热121 kJ,1 ml H2O(l)蒸发吸热44 kJ,则1 ml H2燃烧生成1 ml H2O(l)放热286 kJ,表示H2燃烧热的热化学方程式为H2(g)+eq \f(1,2)O2(g)===H2O(l) ΔH=-286 kJ·ml-1。
4.[2021·全国甲卷,28(1)]二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
二氧化碳加氢制甲醇的总反应可表示为:
CO2(g)+3H2(g)===CH3OH(g)+H2O(g)
该反应一般认为通过如下步骤来实现:
①CO2(g)+H2(g)===CO(g)+H2O(g)
ΔH1=+41 kJ·ml-1
②CO(g)+2H2(g)===CH3OH(g)
ΔH2=-90 kJ·ml-1
总反应的ΔH=________kJ·ml-1;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是__________(填标号),判断的理由是_____________________________________
________________________________________________________________________。
答案 -49 A ΔH1为正值,ΔH2和ΔH为负值,反应①的活化能大于反应②的活化能
解析 根据盖斯定律可知,①+②可得二氧化碳加氢制甲醇的总反应为CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH=(+41 kJ·ml-1)+(-90 kJ·ml-1)=-49 kJ·ml-1;总反应为放热反应,因此生成物总能量低于反应物总能量,反应①为慢反应,因此反应①的活化能高于反应②,同时反应①的反应物总能量低于生成物总能量,反应②的反应物总能量高于生成物总能量,因此示意图中能体现反应能量变化的是A项。
5.[2021·河北,16(1)]当今,世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。
大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25 ℃时,相关物质的燃烧热数据如表:
则25 ℃时H2(g)和C(石墨,s)生成C6H6(l)的热化学方程式为_________________________。
答案 6C(石墨,s)+3H2(g)===C6H6(l) ΔH=+49.1 kJ·ml-1
解析 根据表格中燃烧热数据可知,存在反应①C(石墨,s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·
ml-1,②H2(g)+eq \f(1,2)O2(g)===H2O(l)
ΔH2=-285.8 kJ·ml-1,③C6H6(l)+eq \f(15,2)O2(g)===6CO2(g)+3H2O(l) ΔH3=-3 267.5 kJ·ml-1,根据盖斯定律,①×6+②×3-③得反应:6C(石墨,s)+3H2(g)===C6H6(l) ΔH=(-393.5 kJ·
ml-1)×6+(-285.8 kJ·ml-1)×3-(-3 267.5 kJ·ml-1)=+49.1 kJ·ml-1。
考向一 热化学方程式的书写
1.用H2还原SiCl4蒸气可制取纯度很高的硅,当反应中有1 ml电子转移时吸收59 kJ热量,则该反应的热化学方程式为__________________________________________________
________________________________________________________________________。
答案 SiCl4(g)+2H2(g)===Si(s)+4HCl(g)
ΔH=+236 kJ·ml-1
解析 在反应中硅元素的化合价从+4价降低到0价,得到4个电子。当反应中有1 ml电子转移时吸收59 kJ热量,则消耗1 ml氯化硅时吸收的热量是59 kJ×4=236 kJ,因此该反应的热化学方程式为SiCl4(g)+2H2(g)===Si(s)+4HCl(g) ΔH=+236 kJ·ml-1。
2.CH3OH(l)汽化时吸收的热量为27 kJ·ml-1,CH3OH(g)的燃烧热为677 kJ·ml-1,请写出CH3OH(l)燃烧热的热化学方程式:____________________________________________
________________________________________________________________________。
答案 CH3OH(l)+eq \f(3,2)O2(g)===CO2(g)+2H2O(l) ΔH=-650 kJ·ml-1
解析 燃烧热是1 ml纯物质完全燃烧生成指定产物时所放出的热量。则CH3OH(l)燃烧热的热化学方程式为CH3OH(l)+eq \f(3,2)O2(g)===CO2(g)+2H2O(l) ΔH=-650 kJ·ml-1。
3.钌及其化合物在合成工业上有广泛用途,下图是用钌(Ru)基催化剂催化合成甲酸的过程。每生成92 g液态HCOOH放出62.4 kJ的热量。
根据图示写出该反应的热化学方程式:_________________________________________
________________________________________________________________________。
答案 H2(g)+CO2(g)===HCOOH(l) ΔH=-31.2 kJ·ml-1
解析 根据整个流程图可知,CO2(g)和H2(g)为反应物,生成物为HCOOH(l),92 g HCOOH的物质的量为eq \f(92 g,46 g·ml-1)=2 ml,所以生成1 ml HCOOH(l)放出31.2 kJ热量,热化学方程式为H2(g)+CO2(g)===HCOOH(l) ΔH=-31.2 kJ·ml-1。
4.在1 L密闭容器中,4 ml氨气在一定条件下分解生成氮气和氢气。2 min时反应吸收的热量为46.1 kJ,此时氨气的转化率为25%。该反应的热化学方程式:________________
________________________________________________________________________。
答案 2NH3(g)N2(g)+3H2(g) ΔH=+92.2 kJ·ml-1
解析 热化学方程式2NH3(g)N2(g)+3H2(g) ΔH=+Q kJ·ml-1表示2 ml NH3完全分解需要吸收Q kJ的热量,反应的氨气的物质的量为Δn(NH3)=4 ml×25%=1 ml,则2 ml NH3完全分解需要吸收的热量Q=2×46.1 kJ=92.2 kJ,即ΔH=+92.2 kJ·ml-1。
考向二 盖斯定律的应用
5.硫碘循环分解水是一种高效、环保的制氢方法,其流程图如图。
已知:
反应 Ⅰ:2H2O(l)===2H2(g)+O2(g)
ΔH1=+572 kJ·ml-1
反应 Ⅱ:H2SO4(aq)===SO2(g)+H2O(l)+eq \f(1,2)O2(g) ΔH2=+327 kJ·ml-1
反应 Ⅲ:2HI(aq)===H2(g)+I2(g)
ΔH3=+172 kJ·ml-1
则反应SO2(g)+I2(g)+2H2O(l)===2HI(aq)+H2SO4(aq) ΔH=________。
答案 -213 kJ·ml-1
解析 根据盖斯定律,将Ⅰ×eq \f(1,2)-Ⅱ-Ⅲ得反应SO2(g)+I2(g)+2H2O(l)===2HI(aq)+H2SO4(aq) ΔH=-213 kJ·ml-1。
6.含碳化合物在生产生活中广泛存在,AndrenDasic等提出在M+的作用下以N2O为氧化剂可以氧化乙烯生成乙醛,催化体系氧化还原循环如图所示。
已知:
N2O(g)+M+(s)===N2(g)+MO+(s)
ΔH1=+678 kJ·ml-1
MO+(s)+C2H4(g)===C2H4O(g)+M+(s)
ΔH2=-283 kJ·ml-1
请写出在M+的作用下以N2O为氧化剂氧化乙烯生成乙醛的热化学方程式:________________________________________________________________________
________________________________________________________________________。
答案 N2O(g)+C2H4(g)===N2(g)+C2H4O(g) ΔH=+395 kJ·ml-1
解析 已知:①N2O(g)+M+(s)===N2(g)+MO+(s) ΔH1=+678 kJ·ml-1,②MO+(s)+C2H4(g)===
C2H4O(g)+M+(s) ΔH2=-283 kJ·ml-1,根据盖斯定律①+②可得N2O(g)+C2H4(g)===N2(g)+C2H4O(g) ΔH=ΔH1+ΔH2=+678 kJ·ml-1+(-283 kJ·ml-1)=+395 kJ·ml-1。
7.1 ml CH4(g)完全燃烧生成气态水的能量变化和1 ml S(g)燃烧的能量变化如图所示。在催化剂作用下,CH4(g)可以还原SO2(g)生成单质S(g)、H2O(g)和CO2(g),写出该反应的热化学方程式:________________________________________________________________________
________________________________________________________________________。
答案 CH4(g)+2SO2(g)===2S(g)+CO2(g)+2H2O(g) ΔH=+352 kJ·ml-1
解析 根据图像可知:①CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=126 kJ·ml-1-928 kJ·ml-1=-802 kJ·ml-1;②S(g)+O2(g)===SO2(g) ΔH=-577 kJ·ml-1;根据盖斯定律可知①-②×2可得CH4(g)+2SO2(g)===2S(g)+CO2(g)+2H2O(g) ΔH=+352 kJ·ml-1。
专题强化练
1.已知:Rln Kp=-eq \f(ΔH,T)+C(C为常数),根据下图,则该反应的反应热ΔH=______ kJ·ml-1。
答案 +144.2
解析 将图像上的点代入Rln Kp=-eq \f(ΔH,T)+C得:69.50 J·ml-1·K-1=-ΔH×3.19×10-3 K-1+C和53.64 J·ml-1·K-1=-ΔH×3.30×10-3 K-1+C,联立求解得ΔH≈+1.442×105 J·ml-1=+144.2 kJ·ml-1。
2.CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)eq \(,\s\up7(催化剂))2CO(g)+2H2(g)。已知上述反应中相关的化学键键能数据如下:
则该反应的ΔH=____________。
答案 +120 kJ·ml-1
解析 反应CH4(g)+CO2(g)eq \(,\s\up7(催化剂))2CO(g)+2H2(g)的ΔH=[(413×4+745×2)-(2×1 075+2×436)] kJ·ml-1=+120 kJ·ml-1。
3.近几年,大气污染越来越严重,雾霾天气对人们的生活、出行、身体健康产生了许多不利的影响。汽车尾气是主要的大气污染源。降低汽车尾气危害的方法之一是在排气管上安装催化转化器,发生的反应为2CO(g)+2NO(g)2CO2(g)+N2(g)。已知:
则2CO(g)+2NO(g)2CO2(g)+N2(g) ΔH=________(用含a、b、c、d的式子表示)。
答案 (2a+2b-2c-d) kJ·ml-1
解析 2CO(g)+2NO(g)2CO2(g)+N2(g)的反应热等于反应物的键能之和减去生成物的键能之和,故ΔH=(2a+2b-2c-d) kJ·ml-1。
4.工业上利用甲酸的能量关系转换图如图所示:
反应CO2(g)+H2(g)HCOOH(g)的ΔH=________ kJ·ml-1。
答案 -31.4
解析 根据图示可得如下热化学方程式:①HCOOH(g)CO(g)+H2O(g) ΔH1=+72.6 kJ·
ml-1;②CO(g)+eq \f(1,2)O2(g)CO2(g)
ΔH2=-283.0 kJ·ml-1;③H2(g)+eq \f(1,2)O2(g)H2O(g) ΔH3=-241.8 kJ·ml-1。由盖斯定律可得,将③-①-②得到反应CO2(g)+H2(g)HCOOH(g)的ΔH=ΔH3-ΔH1-ΔH2=-241.8 kJ·
ml-1-(+72.6 kJ·ml-1)-(-283.0 kJ·ml-1)=-31.4 kJ·ml-1。
5.CO和H2是工业上最常用的合成气,制备该合成气的一种方法是以CH4和H2O为原料,有关反应的能量变化如图所示。
CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为_______________________
________________________________________________________________________。
答案 CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=(-p+3n+m) kJ·ml-1
解析 依据三个能量关系图像写出对应的热化学方程式:CO(g)+eq \f(1,2)O2(g)===CO2(g) ΔH1=
-m kJ·ml-1;H2(g)+eq \f(1,2)O2(g)===H2O(g) ΔH2=-n kJ·ml-1;CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH3=-p kJ·ml-1;由盖斯定律:CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=ΔH3-3ΔH2-ΔH1=(-p+3n+m) kJ·ml-1。
6.如图表示在CuO存在下HCl催化氧化的反应过程,则总反应的热化学方程式为________________________________________________________________________
________________________________________________________________________。
答案 2HCl(g)+eq \f(1,2)O2(g)===H2O(g)+Cl2(g) ΔH=ΔH1+ΔH2+ΔH3
解析 根据盖斯定律,化学反应不管是一步完成还是分几步完成,其反应热都是相同的,由题图可知热化学方程式为2HCl(g)+eq \f(1,2)O2(g)===H2O(g)+Cl2(g) ΔH=ΔH1+ΔH2+ΔH3。
7.用NaAlO2制备α-Al(OH)3的能量转化关系如图:
反应②的热化学方程式为_____________________________________________________。
答案 NaAlO2(aq)+2H2O(l)===NaOH(aq)+α-Al(OH)3(s) ΔH=-50 kJ·ml-1
解析 首先写出反应②的化学方程式并注明状态NaAlO2(aq)+2H2O(l)===NaOH(aq)+α-Al(OH)3(s),根据盖斯定律求出该反应的焓变ΔH=eq \f(1,2)(ΔH3-ΔH1)=eq \f(1,2)×[(-620 kJ·ml-1)-(-520 kJ·ml-1)]=-50 kJ·ml-1。
8.NH4VO3在高温下分解产生的V2O5可作为硫酸工业中2SO2(g)+O2(g)2SO3(g) ΔH=p kJ·
ml-1的催化剂,其催化原理如图所示。
过程a和过程b的热化学方程式分别为V2O5(s)+SO2(g)V2O4(s)+SO3(g) ΔH=q kJ·ml-1、V2O4(s)+O2(g)+2SO2(g)2VOSO4(s) ΔH=r kJ·ml-1。请写出过程c的热化学方程式:__________________________________________________________________________
________________________________________________________________________。
答案 2VOSO4(s)V2O5(s)+SO3(g)+SO2(g)
ΔH=(p-q-r) kJ·ml-1
解析 根据盖斯定律,由总的热化学方程式2SO2(g)+O22SO3(g) ΔH=p kJ·ml-1减去过程a、过程b的热化学方程式,可得过程c的热化学方程式为2VOSO4(s)V2O5(s)+SO3(s)+SO2(g) ΔH=(p-q-r) kJ·ml-1。
9.在α-Fe(Ⅲ)铁原子簇表面,以N2和H2为原料合成氨的反应机理如下:
①H2(g)===2H(g) ΔH1
②N2(g)+2H(g)2(NH)(g) ΔH2
③(NH)(g)+H(g)(NH2)(g) ΔH3
④(NH2)(g)+H(g)NH3(g) ΔH4
总反应:N2(g)+3H2(g)2NH3(g) ΔH。则ΔH4=__________________________________(用含ΔH1、ΔH2、ΔH3、ΔH的式子表示)。
答案 eq \f(1,2)(ΔH-3ΔH1-ΔH2-2ΔH3)
10.氨基甲酸铵(H2NCOONH4)为尿素生产过程的中间产物,易分解,某小组对氨基甲酸铵的分解实验进行探究。已知:
Ⅰ.N2(g)+3H2(g)2NH3(g)
ΔH1=-92.4 kJ·ml-1
Ⅱ.C(s)+O2(g)CO2(g)
ΔH2=-393.8 kJ·ml-1
Ⅲ.N2(g)+3H2(g)+C(s)+O2(g)H2NCOONH4(s) ΔH3=-645.7 kJ·ml-1
写出H2NCOONH4分解生成NH3与CO2气体的热化学方程式:________________________________________________________________________
________________________________________________________________________。
答案 H2NCOONH4(s)2NH3(g)+CO2(g) ΔH=+159.5 kJ·ml-1
解析 由盖斯定律将Ⅰ+Ⅱ-Ⅲ得:H2NCOONH4(s)2NH3(g)+CO2(g) ΔH=+159.5 kJ·ml-1。
11.甲醇(CH3OH)可替代汽油作为公交车的燃料,写出由CO和H2生产甲醇的化学方程式:________________________________________________________________________
________________________________________________________________________。
用该反应合成1 ml液态甲醇放出热量128.1 kJ。
又知2H2(g)+CO(g)+eq \f(3,2)O2(g)===CO2(g)+2H2O(g) ΔH=-766.6 kJ·ml-1,H2O(g)===H2O(l) ΔH=-44 kJ·ml-1。
请写出表示甲醇燃烧热的热化学方程式:______________________________________
________________________________________________________________________。
答案 CO+2H2eq \(=======,\s\up7(一定条件))CH3OH CH3OH(l)+eq \f(3,2)O2(g)===CO2(g)+2H2O(l) ΔH=-726.5 kJ·ml-1
解析 由CO和H2生产甲醇的化学方程式为CO+2H2eq \(=======,\s\up7(一定条件))CH3OH;用该反应合成1 ml液态甲醇放出热量128.1 kJ,热化学方程式为①CO(g)+2H2(g)===CH3OH(l) ΔH=
-128.1 kJ·ml-1;②2H2(g)+CO(g)+eq \f(3,2)O2(g)===CO2(g)+2H2O(g) ΔH=-766.6 kJ·ml-1;③H2O(g)===H2O(l) ΔH=-44 kJ·ml-1;利用盖斯定律,将②-①+③×2可得甲醇燃烧热的热化学方程式为CH3OH(l)+eq \f(3,2)O2(g)===CO2(g)+2H2O(l) ΔH=-726.5 kJ·ml-1。
12.科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。已知:反应Ⅰ:2NO(g)+O2(g)===2NO2(g) ΔH1=-113.0 kJ·ml-1
反应Ⅱ:2SO2(g)+O2(g)===2SO3(l) ΔH2=-288.4 kJ·ml-1
反应Ⅲ:3NO2(g)+H2O(l)===2HNO3(l)+NO(g) ΔH3=-138.0 kJ·ml-1
则反应NO2(g)+SO2(g)===NO(g)+SO3(l) ΔH4=__________________。
答案 -87.7 kJ·ml-1
解析 根据盖斯定律将(Ⅱ-Ⅰ)×eq \f(1,2)得反应NO2(g)+SO2(g)===NO(g)+SO3(l),则ΔH4=[(-288.4 kJ·ml-1)-(-113.0 kJ·ml-1)]×eq \f(1,2)=-87.7 kJ·ml-1。
13.实验室可用KClO3分解制取O2,KClO3受热分解的反应分两步进行:
①4KClO3(s)===3KClO4(s)+KCl(s)
②KClO4(s)===KCl(s)+2O2(g)
已知:
K(s)+eq \f(1,2)Cl2(g)===KCl(s)
ΔH=-437 kJ·ml-1
K(s)+eq \f(1,2)Cl2(g)+eq \f(3,2)O2(g)===KClO3(s)
ΔH=-398 kJ·ml-1
K(s)+eq \f(1,2)Cl2(g)+2O2(g)===KClO4(s)
ΔH=-433 kJ·ml-1
则反应4KClO3(s)===3KClO4(s)+KCl(s)的ΔH=__________ kJ·ml-1。
答案 -144
解析 ①K(s)+eq \f(1,2)Cl2(g)===KCl(s) ΔH=-437 kJ·ml-1;②K(s)+eq \f(1,2)Cl2(g)+eq \f(3,2)O2(g)===KClO3(s) ΔH=-398 kJ·ml-1;③K(s)+eq \f(1,2)Cl2(g)+2O2(g)===KClO4(s) ΔH=-433 kJ·ml-1,依据盖斯定律将①+③×3-②×4得到4KClO3(s)===3KClO4(s)+KCl(s)的ΔH=-144 kJ·ml-1。
14.下图是2LiBH4/MgH2体系放氢焓变示意图,则:Mg(s)+2B(s)===MgB2(s) ΔH=________________________________________________________________________。
答案 -93 kJ·ml-1
解析 由图可知:2LiBH4(s)+MgH2(s)===2LiH(s)+2B(s)+MgH2(s)+3H2(g) ΔH=+200 kJ·
ml-1 ①,2LiBH4(s)+MgH2(s)===2LiBH4(s)+Mg(s)+H2(g) ΔH=+76 kJ·ml-1 ②,2LiBH4(s)+MgH2(s)===2LiH(s)+MgB2(s)+4H2(g) ΔH=+183 kJ·ml-1 ③,2LiH(s)+MgB2(s)+4H2(g)===2LiH(s)+2B(s)+MgH2(s)+3H2(g) ΔH=+(200-183) kJ·ml-1,即MgB2(s)+H2(g)===2B(s)+MgH2(s) ΔH=+17 kJ·ml-1 ④,所以-④-②得:Mg(s)+2B(s)===MgB2(s) ΔH=-(17+76) kJ·ml-1=-93 kJ·ml-1。
15.如图是发射卫星时用肼(N2H4)作燃料,用NO2作氧化剂(反应生成N2、水蒸气)和用F2作氧化剂(反应生成N2、HF)的反应原理。
通过计算,可知原理 Ⅰ 和原理 Ⅱ 氧化气态肼生成氮气的热化学方程式分别为____________________、____________________,消耗等量的N2H4(g)时释放能量较多的是原理________(填“Ⅰ”或“Ⅱ”)。
答案 N2H4(g)+NO2(g)===eq \f(3,2)N2(g)+2H2O(g)
ΔH=-567.85 kJ·ml-1 N2H4(g)+2F2(g)===N2(g)+4HF(g) ΔH=-1 126 kJ·ml-1 Ⅱ
解析 根据题给信息可知N2H4(g)+NO2(g)===eq \f(3,2)N2(g)+2H2O(g) ΔH,结合盖斯定律,此反应可由②-eq \f(1,2)×①得出,所以ΔH=ΔH2-eq \f(1,2)ΔH1=-534 kJ·ml-1-eq \f(1,2)×67.7 kJ·ml-1=-567.85 kJ·
ml-1。同理可得N2H4(g)+2F2(g)===N2(g)+4HF(g) ΔH,此反应可由反应②+2×③-④得出,所以ΔH=ΔH2+2ΔH3-ΔH4=-534 kJ·ml-1+2×(-538 kJ·ml-1)-(-484 kJ·ml-1)=-1 126 kJ·ml-1。由所得两个热化学方程式可知,消耗等量N2H4(g)释放能量较多的是原理Ⅱ。化学键
C—H
C—C
C==C
H—H
键能/
(kJ·ml-1)
412
348
612
436
物质
金刚石
硅
SiO2
化学键
C—C
Si—Si
Si—O
化学键数
2NA
2NA
4NA
物质
CO2
CH4
S8
化学键
C==O
C—H
S—S
化学键数
2NA
4NA
8NA
物质(g)
O
H
HO
HOO
H2
O2
H2O2
H2O
能量/
(kJ·
ml-1)
249
218
39
10
0
0
-136
-242
化学键
N≡N
H—H
N—H
键能E/(kJ·ml-1)
946
436.0
390.8
物质
H2(g)
CO2(g)
CH2==CH2(g)
H2O(g)
能量/
(kJ·ml-1)
0
-394
52
-242
共价键
H—S
S—S
S==O
H—O
键能/
(kJ·ml-1)
364
266
522
464
物质
H2(g)
C(石墨,s)
C6H6(l)
燃烧热ΔH/
(kJ·ml-1)
-285.8
-393.5
-3 267.5
化学键
C—H
C==O
H—H
C≡O(CO)
键能/(kJ·ml-1)
413
745
436
1 075
新高考化学二轮复习学案第1部分 专题突破 专题11 热化学方程式的书写与盖斯定律(含解析): 这是一份新高考化学二轮复习学案第1部分 专题突破 专题11 热化学方程式的书写与盖斯定律(含解析),共17页。
2023版高考化学步步高大二轮复习讲义第一部分 专题22 限制条件同分异构体的书写【解析版】: 这是一份2023版高考化学步步高大二轮复习讲义第一部分 专题22 限制条件同分异构体的书写【解析版】,共11页。
2023版高考化学步步高大二轮复习讲义第一部分 专题5 题型专攻1 “陌生情景下”方程式的书写【解析版】: 这是一份2023版高考化学步步高大二轮复习讲义第一部分 专题5 题型专攻1 “陌生情景下”方程式的书写【解析版】,共6页。













