



化学-2022-2023学年高三下学期开学摸底考试卷A(江苏专用)
展开绝密★考试结束前
2022-2023学年高三下学期开学摸底考试卷A(江苏专用)
化学
(时间:75分钟 满分:100分)
注意事项:
1.答卷前,考生务必将自己的姓名、考生号等填写在答题卡和试卷指定位置上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cr 52 Fe 56 Cu 64 Zn 65 Pb 207
第Ⅰ卷
一、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1. 2021年9月,中国科学家在实验室中首次实现从二氧化碳经11步非自然反应实现淀粉分子的全合成。核磁共振等检测发现,人工合成淀粉分子与天然淀粉分子的结构组成一致。下列有关说法不正确的是
A. 该研究对我国粮食安全有重要意义 B. 11步反应中一定存在氧化还原反应
C. 人工合成的淀粉属于高分子化合物 D. 淀粉分子中含有C、H、O、N四种元素
2. “侯氏制碱法”曾为全球制碱工业做出了巨大贡献。该工艺反应之一如下:,下列说法正确的是
A. 仅含离子键 B. 电负性:
C. 与晶体类型相同 D. 氨气的电子式为:
3. 铁钾矾是一种重要的化工原料。下列说法正确的是
A. 是非极性分子 B. 硫离子的结构示意图:
C. 离子半径大小: D. 碱性强弱:
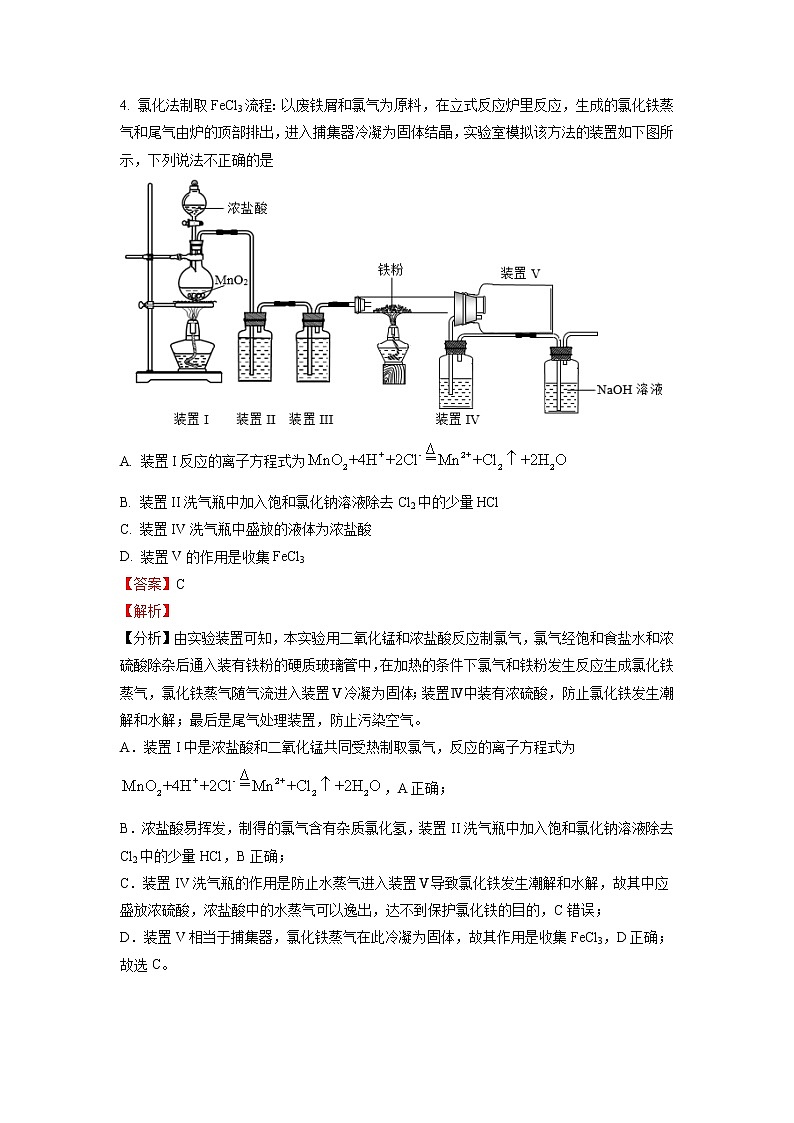
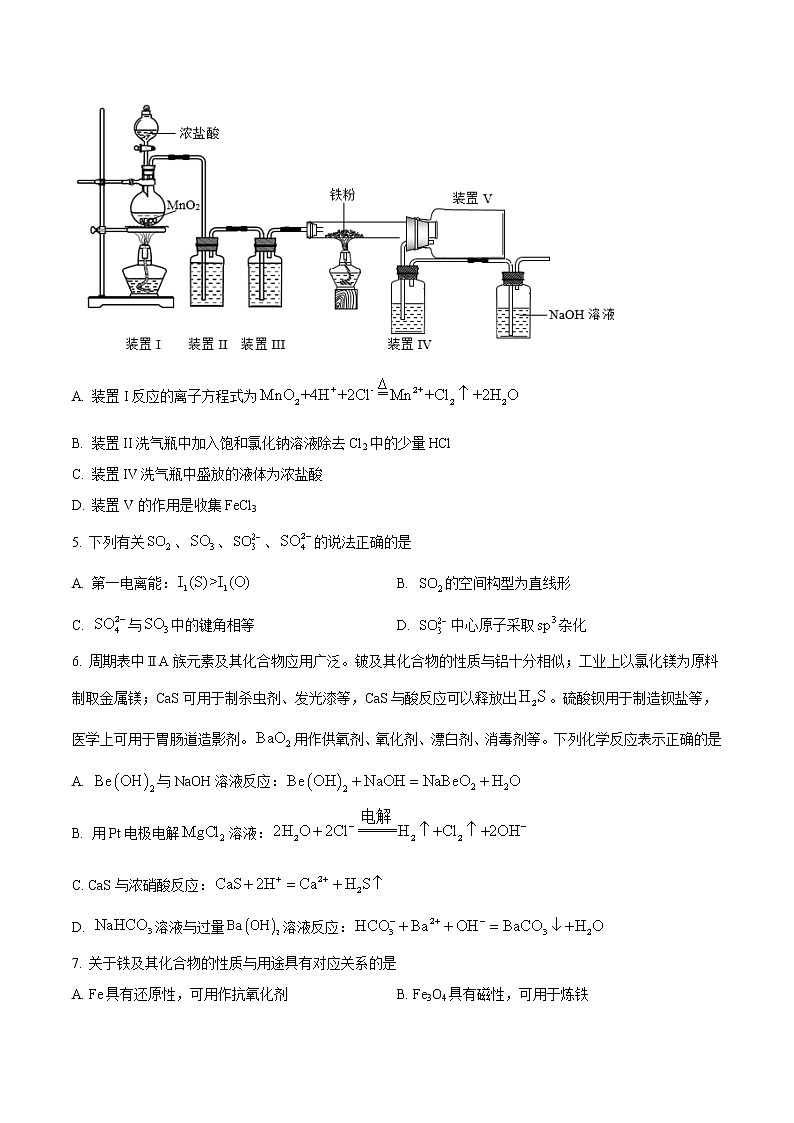
4.氯化法制取FeCl3流程:以废铁屑和氯气为原料,在立式反应炉里反应,生成的氯化铁蒸气和尾气由炉的顶部排出,进入捕集器冷凝为固体结晶,实验室模拟该方法的装置如下图所示,下列说法不正确的是
A. 装置I反应的离子方程式为
B. 装置II洗气瓶中加入饱和氯化钠溶液除去Cl2中的少量HCl
C. 装置IV洗气瓶中盛放的液体为浓盐酸
D. 装置V的作用是收集FeCl3
5. 下列有关、、、的说法正确的是
A. 第一电离能: B. 的空间构型为直线形
C. 与中的键角相等 D. 中心原子采取杂化
6. 周期表中ⅡA族元素及其化合物应用广泛。铍及其化合物的性质与铝十分相似;工业上以氯化镁为原料制取金属镁;CaS可用于制杀虫剂、发光漆等,CaS与酸反应可以释放出。硫酸钡用于制造钡盐等,医学上可用于胃肠道造影剂。用作供氧剂、氧化剂、漂白剂、消毒剂等。下列化学反应表示正确的是
A. 与NaOH溶液反应:
B. 用Pt电极电解溶液:
C. CaS与浓硝酸反应:
D. 溶液与过量溶液反应:
7. 关于铁及其化合物的性质与用途具有对应关系的是
A. Fe具有还原性,可用作抗氧化剂 B. Fe3O4具有磁性,可用于炼铁
C. Fe(OH)3胶体呈红褐色,可用于净水 D. FeCl3溶液呈酸性,可用于刻蚀铜板
发生氧化还原反应产生FeCl2、CuCl2,与其水溶液是否显酸性无关,D不符合题意;
故合理选项是A。
8. 下列有关Cu及其化合物的叙述正确的是
A. 1mol中含有σ键的数目为16mol
B. 如图所示的晶胞中Cu原子的配位数为4
C. 刻蚀Cu制印刷电路板,说明还原性Cu大于Fe
D. 除去Cu粉中混有CuO的方法是加入稀硝酸溶解,过滤、洗涤、干燥
9. 五倍子是一种常见的中草药,其有效成分为X。在一定条件下X可分别转化为Y、Z。
下列说法正确的是
A. Y分子中所有原子可能共平面
B. 不能用溶液检验Y中是否含有X
C. 1mol Z最多能与7mol NaOH发生反应
D X与足量氢气发生加成反应,所得产物中有2个手性碳原子
10. 对于反应4NH3(g)+5O2(g)4NO(g)+6H2O(g),下列有关说法不正确的是
A. 上述反应的平衡常数表达式K=
B. 适当提高NH3的浓度,可以加快反应速率,提高NH3的转化率
C. 1molN—H断裂同时有1molO—H断裂,说明达该条件下的平衡状态
D. 其它条件不变,加入高效的催化剂能提高单位体积内的活化分子百分数
11. 室温下,下列实验探究方案不能达到探究目的的是
选项 | 探究方案 | 探究目的 |
A | 向5 mL0.1 mol/LKI溶液中加入1 mL0.1 mol/LFeCl3溶液,充分反应后用苯萃取2~3次,取水层滴加KSCN溶液观察溶液颜色变化 | 反应:2Fe3++2I-=2Fe2++I2有一定限度 |
B | 将NaAlO2溶液与NaHCO3溶液混合,观察现象 | 验证结合质子能力:> |
C | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,观察溶液颜色变化 | 验证氧化性:H2O2>Fe3+ |
D | 用pH计测量等温等浓度的CH3COONa和HCOONa溶液的pH,前者大于后者 | Kh(CH3COO-)>Kh(HCOO-) |
A. A B. B C. C D. D
数:Kh(CH3COO-)>Kh(HCOO-),D正确;
故合理选项是C。
12. 利用烟道气中的生产晶体的工艺流程如下所示。下列说法正确的是
A. 步骤Ⅰ可得溶液中有
B. 步骤Ⅱ中发生的反应为,则的大于的
C 步骤Ⅲ所得溶液中有
D. 向饱和溶液中通入的过程,水的电离程度先增大后减小
程度受到抑制,即水的电离程度逐渐减小,D错误;
答案选B。
13. 工业上用与为原料制备,涉及的反应如下:
反应Ⅰ:
反应Ⅱ:
一定条件下,分解产生的体积分数[]、的平衡转化率随温度的变化如图所示。
下列说法正确的是
A. 相同时间内,反应温度越低,的转化率越大
B. 反应Ⅱ使用高效催化剂能提高平衡时的产率
C. 工业上一般控制反应温度高于600℃,其原因是低于600℃时,浓度较小,速率较慢
D. 某温度下若完全分解为,在密闭容器中投入和反应,当的体积分数为10%时,的转化率为70%
第Ⅱ卷
二、非选择题:共4题,共61分。
14. (16分)磷的化合物应用广泛。
(1)磷酸铁用于生产新型动力锂电池的电极材料。生产原理:向硫酸铁溶液中先加入磷酸调节铁磷比,再加氨水调节溶液pH,析出磷酸铁沉淀。一定条件下,探究pH对磷酸铁沉淀的影响,结果如图所示。
①在pH为1~2.5时,加入氨水生成沉淀的主要成分为磷酸铁,生成磷酸铁的化学方程式为_______。
②在pH为2.5~3.0时,随pH增大,磷的沉淀率开始下降,其可能原因是_______。
(2)磷化硼(BP)是一种超硬耐磨涂层材料,它可用作金属的表面保护层。磷化硼晶胞结构如图甲所示(白球代表磷原子,黑球代表硼原子)。
①磷化硼(BP)晶体属于_______晶体。
②磷化硼晶胞沿着体对角线方向的投影如图乙所示(图乙中表示原子的投影),图乙中B原子的投影位置为_______(用序号表示)。
(3)磷化氢是一种熏蒸剂,在贮粮中用于防治害虫,一种制备的流程如下:
①白磷与过量浓NaOH溶液反应的离子方程式:_______。
②计算理论上共生产气体在标准状况下的体积_______。
15.(15分)化合物G属于黄酮醋酸类化合物,具有保肝的作用。一种合成化合物G的路线如下:
已知:烯烃与HBr发生加成时,不同的条件下有不同的反应方式:
(1)1 mol B分子中含有的σ键数目为_______。
(2)E→F分两步进行,反应类型依次为_______、_______。
(3)D的分子是C10H11O2Cl,D的结构简式为_______。
(4)E的一种同分异构体X同时符合下列条件。写出X的结构简式:_______。
Ⅰ.能使溴的CCl4溶液褪色,且消耗2 mol Br2
Ⅱ.分子中含3种化学环境不同的氢
(5)设计由为原料,制备的合成路线(无机试剂和有机溶剂任选) _______。
16. (15分)铁黄(FeOOH)可用作颜料。一种由钛铁矿浸出后的废液[主要含FeSO4、Fe2(SO4)3和TiO(SO4)2]制取铁黄的过程如下:
已知:① “除钛”时TiO2+发生水解反应TiO2++H2O⇌TiO2↓+2H+;
② 实验中Fe2+开始生成Fe(OH)2沉淀时pH=6.3,Fe3+开始生成FeOOH时pH=1.5,完全沉淀时pH=2.8。
(1)检验废液中存在Fe2+的方法是_______。
(2)“除钛”时需进行加热,目的是_______。
(3)“氧化”时的离子方程式为_______。
(4)为测定铁黄产品纯度,现进行如下实验:准确称取2.000g铁黄样品,向其中加入50mL1.000 mol·L-1 H2SO4,待固体完全溶解后,向其中加入Na2C2O4溶液[发生反应:Fe3++3C2O=Fe(C2O4),Fe(C2O4) 不与稀碱液反应],反应后将溶液稀释至100 mL,量取25.00mL于锥形瓶中,滴入2滴指示剂,用0.400 0 mol·L-1 NaOH溶液滴定剩余的酸,恰好完全反应时,消耗NaOH溶液体积为25.00mL。
① 实验过程中Na2C2O4应过量,过量Na2C2O4会与H2SO4反应生成H2C2O4,为不影响测定结果,指示剂可使用_______(填“甲基橙”“石蕊”或“酚酞”)。(已知NaHC2O4溶液呈酸性)
②计算该产品的纯度_____ (写出计算过程)。
(5)控制pH= 4~4.5,温度80~85 ℃,硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O,摩尔质量为392 g·mol-1]与KClO3可发生反应:6Fe2++ClO+9H2O=6FeOOH↓+12H++Cl-。反应过程中沉淀的颜色变化为灰绿→墨绿→红棕→淡黄。请补充完整由硫酸亚铁铵制取铁黄的反应:称取2.352 0 g (NH4)2Fe(SO4)2·6H2O,放在烧杯中,加水充分溶解后,_______,过滤、洗涤、干燥后得到铁黄产品。(可选用的仪器和试剂:恒温水浴槽、2 mol·L-1 NaOH溶液、KClO3固体)
17.(15分) 过度排放会导致全球变暖,将捕集并转化为高附加值能源产品,可有效缓解环境问题。
Ⅰ.膜法分离烟气中的原理如图所示。
(1)吸收烟气中的过程中,A电极上发生的电极反应为_______。
Ⅱ.甲烷催化二氧化碳重整制合成气过程中主要发生反应的热化学方程式为:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
(2)常压下,将等物质的量和以一定流速通入装有催化剂的反应管,实验测得原料气的转化率和水蒸汽的流量随温度变化如图所示。
①反应Ⅱ在一定温度下能够发生的原因可能是_______。
②温度低于873K时,水蒸汽流出量随温度升高而增大的原因是_______。
③在873~1200K间,反应Ⅱ和反应Ⅲ的反应速率随温度升高上升幅度较大的是_______。(填“反应Ⅱ”或“反应Ⅲ”)
Ⅲ.利用可见光催化还原,可将转化为化学原料(、等)。
(3)蛋黄型空心球催化剂技术极大地增强了对可见光的吸收,其原理如图所示,该过程可描述为_______。
【开学摸底考】高三化学02(江苏专用)-2023-2024学年高中下学期开学摸底考试卷.zip: 这是一份【开学摸底考】高三化学02(江苏专用)-2023-2024学年高中下学期开学摸底考试卷.zip,文件包含高三化学开学摸底考02江苏专用原卷版docx、高三化学开学摸底考02江苏专用解析版docx、高三化学开学摸底考02江苏专用答案及评分标准docx、高三化学开学摸底考02江苏专用答题卡docx、高三化学开学摸底考02江苏专用答题卡pdf等5份试卷配套教学资源,其中试卷共26页, 欢迎下载使用。
【开学摸底考】高三化学01(江苏专用)-2023-2024学年高中下学期开学摸底考试卷.zip: 这是一份【开学摸底考】高三化学01(江苏专用)-2023-2024学年高中下学期开学摸底考试卷.zip,文件包含高三化学开学摸底考01解析版docx、高三化学开学摸底考01考试版docx、高三化学开学摸底考01答案及评分标准docx、高三化学开学摸底考01答题卡docx等4份试卷配套教学资源,其中试卷共26页, 欢迎下载使用。
【新高三摸底】2024届新高三-化学开学摸底考试卷(江苏专用): 这是一份【新高三摸底】2024届新高三-化学开学摸底考试卷(江苏专用),文件包含新高三摸底2024届新高三-化学开学摸底考试卷江苏专用解析版docx、新高三摸底2024届新高三-化学开学摸底考试卷江苏专用考试版docx、新高三摸底2024届新高三-化学开学摸底考试卷江苏专用答案及评分标准docx、新高三摸底2024届新高三-化学开学摸底考试卷江苏专用答题卡docx等4份试卷配套教学资源,其中试卷共30页, 欢迎下载使用。












