

高考化学二轮复习突破题专题07水溶液中的离子平衡(强化训练)(2份打包,解析版+原卷版,可预览)
展开专题07 水溶液中的离子平衡(强化训练)
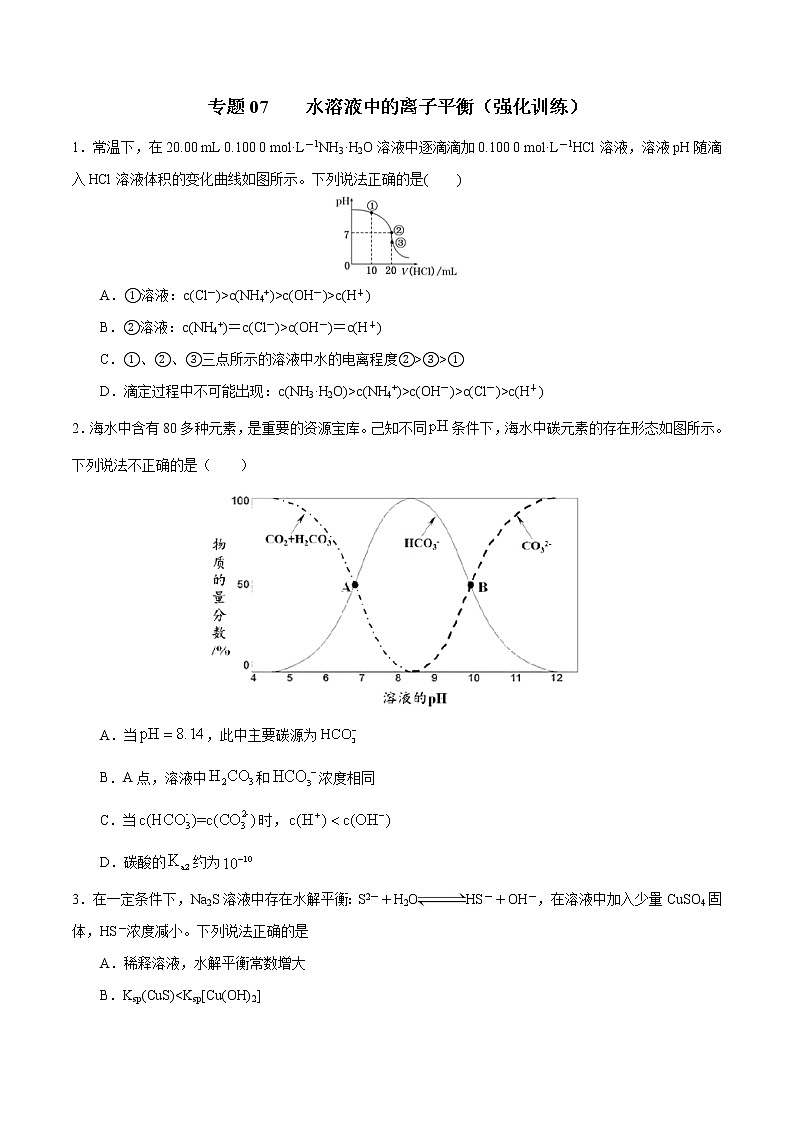
1.常温下,在20.00 mL 0.100 0 mol·L-1NH3·H2O溶液中逐滴滴加0.100 0 mol·L-1HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如图所示。下列说法正确的是( )
A.①溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.②溶液:c(NH4+)=c(Cl-)>c(OH-)=c(H+)
C.①、②、③三点所示的溶液中水的电离程度②>③>①
D.滴定过程中不可能出现:c(NH3·H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)
2.海水中含有80多种元素,是重要的资源宝库。己知不同条件下,海水中碳元素的存在形态如图所示。下列说法不正确的是( )
A.当,此中主要碳源为
B.A点,溶液中和浓度相同
C.当时,
D.碳酸的约为
3.在一定条件下,Na2S溶液中存在水解平衡:S2-+H2OHS-+OH-,在溶液中加入少量CuSO4固体,HS-浓度减小。下列说法正确的是
A.稀释溶液,水解平衡常数增大
B.Ksp(CuS)<Ksp[Cu(OH)2]
C.升高温度增大
D.加入MgCl2固体,HS-浓度减小
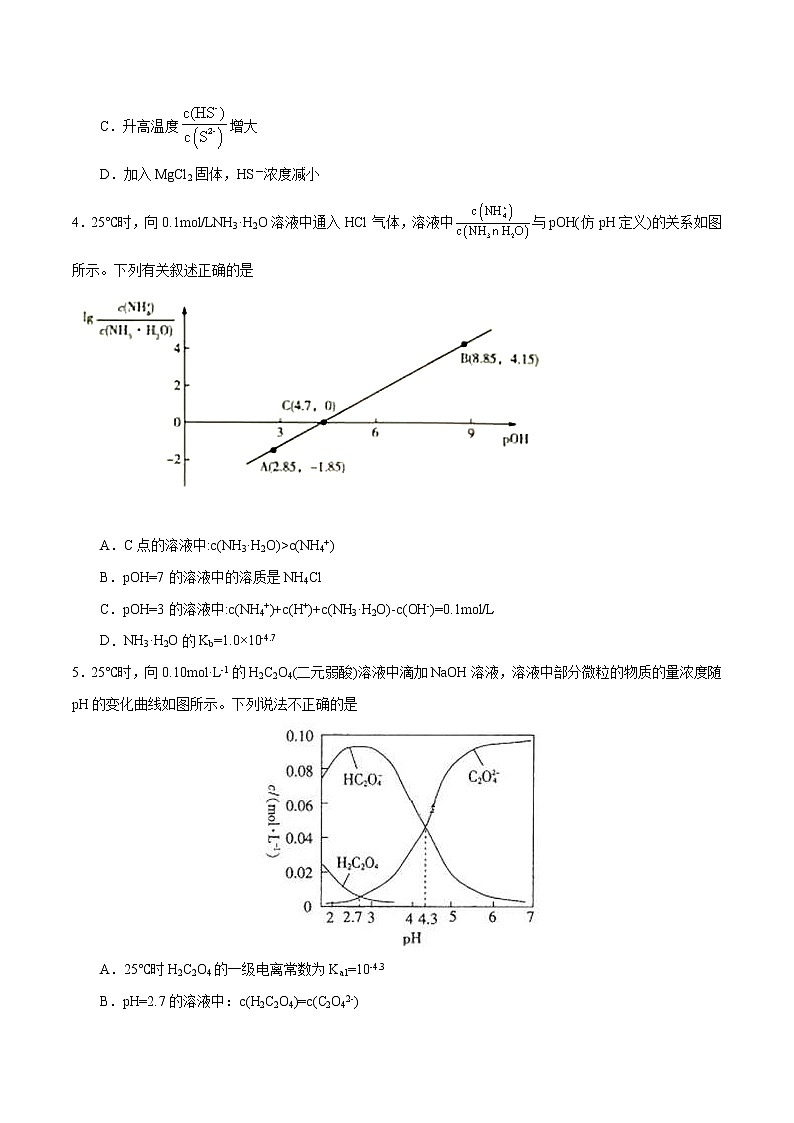
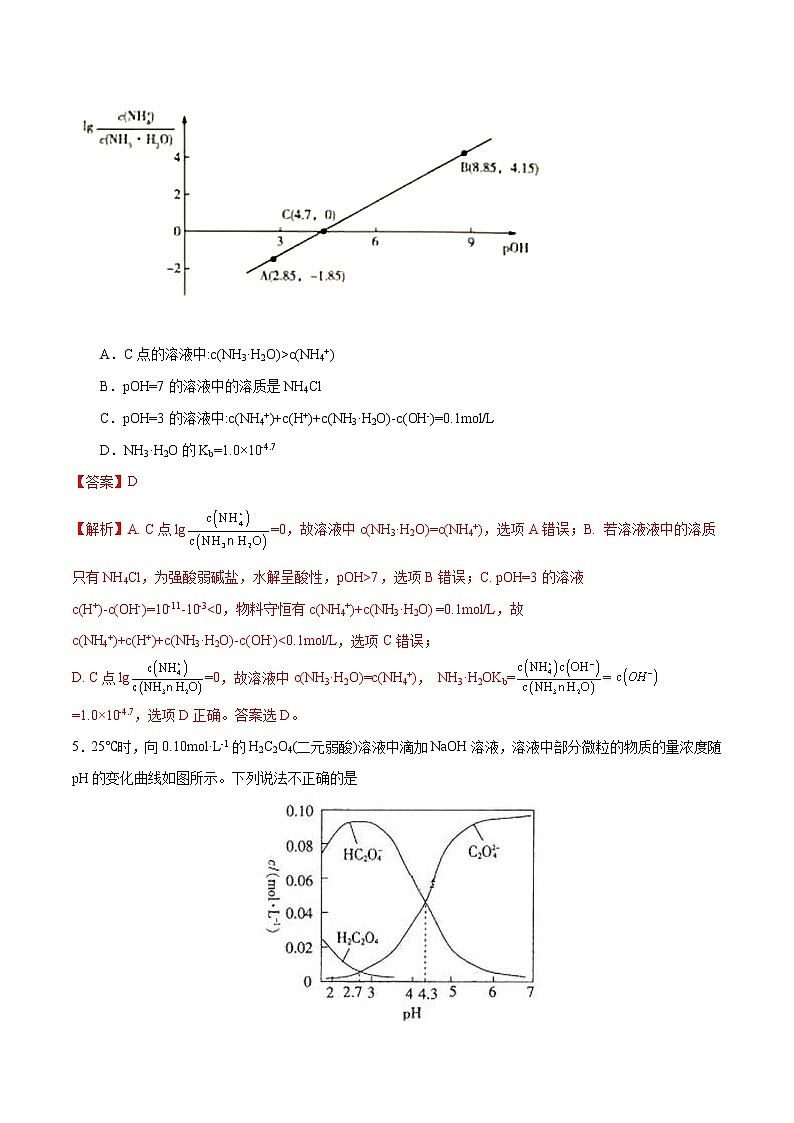
4.25℃时,向0.1mol/LNH3·H2O溶液中通入HCl气体,溶液中与pOH(仿pH定义)的关系如图所示。下列有关叙述正确的是
A.C点的溶液中:c(NH3·H2O)>c(NH4+)
B.pOH=7的溶液中的溶质是NH4Cl
C.pOH=3的溶液中:c(NH4+)+c(H+)+c(NH3·H2O)-c(OH-)=0.1mol/L
D.NH3·H2O的Kb=1.0×10-4.7
5.25℃时,向0.10mol·L-1的H2C2O4(二元弱酸)溶液中滴加NaOH溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法不正确的是
A.25℃时H2C2O4的一级电离常数为Ka1=10‑4.3
B.pH=2.7的溶液中:c(H2C2O4)=c(C2O42-)
C.pH=7的溶液中:c(Na+)>2c(C2O42-)
D.滴加NaOH溶液的过程中始终存在:c(OH-)+2c(C2O42-)+c(HC2O4-)=c(Na+)+c(H+)
6.已知:Ki1(H2SO3) > Ki2(H2SO3) > Ki(C6H5OH),下列反应不能发生的是
A.H2SO3+SO32- → 2HSO3-
B.+H2SO3→+HSO3-
C.+HSO3--→+SO32-
D.+SO32-→+HSO3-
7.将0.1mol/L氢氧化钠滴入等体积、浓度均为0.1mol/L的盐酸和醋酸中,能正确反映溶液pH变化曲线的是(实线表示盐酸,虚线表示醋酸))
A B C D
8.一定温度下,将Cl2缓慢通入水中。当通入的Cl2体积为V1时达到饱和,溶液中c(H+)变化如下图中曲线a。已知Cl2的溶解度随温度升高而迅速降低,下列叙述中正确的是
A.将饱和氯水升温,继续通入Cl2时,溶液中c(H+)变化如曲线b
B.在饱和氯水中通入SO2气体,溶液中c(H+)变化如曲线c
C.降温,继续通入Cl2时,溶液中c(H+)增大
D.在饱和氯水中加入NaOH使pH=7,所得溶液中存在下列关系c(Na+)>c(ClO-)>c(Cl-)>c(HClO)
9.25 ℃时有关物质的颜色和溶度积(Ksp)如下表:
物质 | AgCl | AgBr | AgI | Ag2S |
颜色 | 白 | 淡黄 | 黄 | 黑 |
Ksp | 1.8×10-10 | 7.7×10-13 | 1.5×10-16 | 1.8×10-50 |
下列叙述中不正确的是( )
A.向AgCl的白色悬浊液中加入0.1 mol/L KI溶液,有黄色沉淀产生
B.25 ℃时,利用表中的溶度积(Ksp),可以计算AgCl、AgBr、AgI、Ag2S饱和水溶液中Ag+的浓度
C.25 ℃,AgCl固体分别在等物质的量浓度NaCl、CaCl2溶液中溶解达到平衡,两溶液中,c(Ag+)和溶度积均相同
D.在5 mL 1.8×10-6 mol/L NaCl溶液中,加入1滴(20滴约为1 mL)1×10-3 mol/L AgNO3溶液,不能产生白色沉淀
10.25℃时,向浓度均为0.1mol·L-1、体积均为100mL的两种一元酸HX、HY溶液中分别加入NaOH固体,溶液中随n(NaOH)的变化如图所示。下列说法正确的是
A.HX为弱酸,HY为强酸
B.水的电离程度:b>c>d
C.C点对应的溶液中:c(HY)>c(Y-)
D.若将c点与d点的溶液全部混合,溶液中离子浓度大小:c(Na+)>c(X-)>c(Y-)>c(H+)>c(OH-)
11.已知25℃时有关弱电解质的电离平衡常数:
弱电解质化学式 | CH3COOH | NH3·H2O | H2CO3 |
电离平衡常数(25℃) | 1.8×10-5 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 |
在25℃时,下列有关电解质溶液的说法不正确的是
A.pH相等的四种溶液a. CH3COONa b.Na2CO3 c. NaHCO3 d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d<b<c<a
B.0.1mol·L-1NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
C.1L 0.50mol·L-1NH4Cl溶液与2L0.25mo·L-1NH4Cl溶液,前者含NH4+物质的量多
D.浓度均为0.1mol·L-1的CH3COOH、CH3 COONa混合溶液中: c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)
12.25°C 时,向 10 mL 0.10 mol·L-1 的 HA (Ka =1.0×10-4)中逐滴加入 0.10 mol·L-1NaOH 溶液,溶液 pH 随滴入的 V[(NaOH)aq]变化如下图所示。下列说法正确的是
A.x 点,c(HA)> c(A-)
B.y 点,c(HA)+c(A-)=c(Na+) =0.10 mol·L-1
C.z 点,c(Na+) = c(A-) + c(OH-)
D.水的电离程度,x 点小于 y 点
13.电解质溶液的电导率越大,导电能力越强。用0. 100mol·L-1的NaOH溶液分别滴定10.00mL浓度均为0.100mol·L-1的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是
A.曲线②代表滴定CH3COOH溶液的曲线
B.在相同温度下,C、D两点溶液中水的电离程度: C>D
C.取A点溶液1mL加水稀释,溶液中的所有离子浓度都减小
D.B点溶液中: c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
14.常温下,向10 mL0.1 mol/L的HR溶液中逐滴加入0.1 mol/L的氨水,所得溶液pH及导电能力变化如图。下列分析正确的是( )
A.各点溶液中的离子浓度总和大小关系:d>c > b > a B.常温下,R-的水解平衡常数数量级为10 -9
C.a点和b点溶液中,水的电离程度相等 D.d点的溶液中,微粒浓度关系:c(R-)+2c(HR)=c(NH3∙H2O)
15.25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lg c(M2+)]与溶液pH的变化关系如图所示,已知该温度下Ksp[Cu(OH)2]<Ksp[Fe(OH)2]。下列说法不正确的是( )
A.Ksp[Cu(OH)2]的数量级为10-20
B.当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+)∶c(Cu2+)=104.6∶1
C.除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO
D.向Z点对应的饱和溶液中加入少量NaOH固体,可转化为Y点对应的溶液
16.25 ℃时,NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如下图甲所示。
向10 mL 0.01 mol·L-1 NaCN溶液中逐滴加入0.01 mol·L-1的盐酸,其pH变化曲线如下图乙所示[其中a点的坐标为(9.5,0.5)]。
甲 乙
下列溶液中的关系中一定正确的是
A.图甲中pH=7的溶液:c(Cl-)=c(HCN)
B.常温下,NaCN的水解平衡常数:Kh(NaCN)=10-4.5mol/L
C.图乙中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D.图乙中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+c(CN-)
17.常温下,将NaOH溶液滴入某一元酸(HA)溶液中,测得混合溶液的pH与离子浓度变化关系如图所示[已知:]。下列叙述不正确的是
A.Ka(HA)的数量级为10-5 B.滴加NaOH溶液的过程中,保持不变
C.m点所示溶液中:c(H+)+c(Na+)=c(HA)+c(OH-) D.n点所示溶液中:c(Na+)=c(A-)+c(HA)
18.已知:四甲基氢氧化铵[(CH3)4NOH ]是强碱,甲胺 (CH3NH2・H2O)为弱碱。常温下,在体积均为20 mL、浓度均为0.1 mol/L的四甲基氢氧化铵溶液和甲胺溶液中,分别滴加浓度为0.1 mol/L的盐酸,溶液的导电率与盐酸体积的关系如图所示。下列说法正确的是
A.pH的相对大小: c>d B.在b、c、e三点中,水的电离程度最大的点是e
C.b 点溶液:c(H+)+c(CH3NH3+) = c(OH-) D.c 点溶液:c(Cl-)>c(CH3NH3+) >c(H+) >c(OH-)
19.H2R是一种二元弱酸。25℃时,向H2R溶液中逐滴加入NaOH溶液,混合溶液中lgX[X为或]与pH的变化关系如图所示。下列说法一定正确的是
A.Ⅱ表示lg与pH的变化关系 B.pH=1.22的溶液中:2c(R2-)+c(HR-)<c(Na+)
C.NaHR溶液中c(H+)>c(OH-) D.当溶液呈中性时:c(Na+)>c(HR-)>c(R2-)>c(H+)=c(OH-)
20.已知:pOH=-lgc(OH-)。室温下,将稀盐酸滴加到某一元碱(BOH)溶液中,测得混合溶液的pOH与离子浓度的变化关系如图所示。下列叙述错误的是
A.BOH属于弱碱 B.BOH的电离常数K=1×10-4.8
C.P点所示的溶液中:c(Cl-)>c(B+) D.N点所示的溶液中:c(H+)=c(Cl-)+c(OH-)-c(BOH)
21.298K时,向20mL 0.01mol·L-1 HF溶液中逐滴加入0.01mol·L-1 KOH溶液,其pH变化曲线如图所示。下列叙述正确的是( )
A.水电离出的H+浓度:a<b<c<d B.氢氟酸的电离平衡常数:Ka=
C.V=20 D.b点溶液中:c(F-)>c(HF)
22.人体血液存在H2CO3 /HCO3— 、HPO42-/H2PO4-等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值lg x[x表示H2CO3 /HCO3— 或HPO42-/H2PO4-]与pH的关系如图所示。已知碳酸pKal=6.4、磷酸pKa2=72(pKa= -lgKa)。则下列说法正确的是
A.曲线I表示lg[c(HPO42-)/c(H2PO4-)]与pH的变化关系
B.a→b的过程中,水的电离程度逐渐减小
C.当c(H2CO3) =c(HCO3— )时c(HPO42-)=c(H2PO4-)
D.当pH增大时,c(HCO3— ).c(H2PO4-)/c(HPO42-)逐渐减小
23.已知NaCN溶液中CN-水解常数是NaCN溶液的起始浓度]。25℃时,向c0的NaCN溶液中不断加水稀释,NaCN溶液浓度的对数值lgc0与2pOH[pOH-=-lg c(OH-)]的关系如图。
下列说法不正确的是
A.其它条件不变,降低温度,可使b点变到a点
B.相同温度时,c点对应溶液中的pH大于a点
C.由图可知,25 ℃时,Kh(CN-)≈10-4.7
D.向1 L lgc0=0的NaCN溶液中通入0.5 mol HCl气体,所得溶液中c(CN-)<c(HCN)
24.甲胺(CH3NH2)是一种应用广泛的一元弱碱,其电离方程式为:CH3NH2+H2OCH3NH3++OH-常温下,向20.0mL0.10mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是( )
A.b点对应加入盐酸的体积V<20.00mL B.常温下,甲胺的电离常数为Kb,则Kb=10-3.4
C.b点可能存在关系:c(Cl-)>c(CH3NH3+)>c(H+)>cOH-) D.V=20.00mL时,溶液中水电离的c(H+)>10-7mol/L
25.室温下,关于pH=11的NH3·H2O溶液,下列分析正确的是
A.c(NH3·H2O)=10-3mol/L
B.由水电离出的c(H+)=10-11 mol/L
C.加入少量 NH4Cl固体,NH3·H2O的电离平衡逆向移动,KW值减小
D.加入等体积 pH=3的盐酸,所得溶液:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
26.常温下,向1L0.1mol·L-1NH4Cl溶液中不断加入固体NaOH后,NH4+与NH3·H2O的变化趋势如右图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
A.M点溶液中水的电离程度比原溶液小
B.在M点时,n(OH-)-n(H+)=(a-0.05)mol
C.随着NaOH的加入,不断增大
D.当n(NaOH)=0.05mo1时,溶液中有:c(Cl-)> c(NH4+)>c(Na+)>c(OH-)>c(H+)
17.25℃时,在20 mL 0.1 mol·L-1一元弱酸HA溶液中滴加0. 1 mol· L-1 NaOH溶液,溶液中1g[c(A-)/c(HA)]与pH关系如图所示。下列说法正确的是
A.A点对应溶液中:c(Na+)>c(A-)>c(H+)>c(OH-)
B.25℃时,HA酸的电离常数为1. 0× 10-5.3
C.B点对应的NaOH溶液体积为10 mL
D.对C点溶液加热(不考虑挥发),则c(A-)/[c(HA)c(OH-)]一定增大
28.298K时,将0.1mol·L-1的两种钠盐NaX、NaY溶液加水稀释,溶液的pH 与稀释倍数的对数的关系如图所示.下列说法不正确的是
A.酸性:HY>HX B.298K时,K(HX)/ K(HY)= 1/100
C.=2时,c(HX)+c(X- )=c(HY)+c(Y- ) D.相同浓度时,NaX和NaY两溶液中离子总浓度相等
29.t℃时,将0.200mol·L-1的某一元酸HA与0.200mol·L-1的NaOH溶液等体积混合,充分反应后所得溶液中部分离子浓度如下表。下列说法中正确的是
A.所得溶液中:c(Na+)>c(A-)>c(HA)>c(OH-) B.t℃时,水的离子积Kw=1.0×10-13
C.t℃时,一元酸HA的电离常数K=3.10×10-7 D.t℃时,0.100mol·L-1NaA溶液中A-的水解率为0.80%
30.常温下,用0.10 mol·L-1的氨水滴定20.00 mL a mol·L-1的盐酸,混合溶液的pH与氨水的体积(V)的关系如图所示。下列说法不正确的是
A.图上四点对应溶液中离子种类相同
B.若N点溶液中存在c(H+)=c(OH-)+c(NH3·H2O) ,则N点为滴定反应的恰好反应点
C.图上四点对应的溶液中水的电离程度由大到小排列为N>P>M>Q
D.若N点为恰好反应点,则M点溶液中存在c(Cl-)=2c(NH3·H2O)+2c(NH4+)
31.已知298K时,Ksp(NiS)=1.0×10-21,Ksp(NiCO3)=1.0×10-7 ;p(Ni)=-lg c(Ni2+),p(B)=-lg c(S2-)或-lg c(CO32-)。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。下列说法错误的是( )
A.对于曲线I,在b点加热,b点向c点移动
B.常温下NiCO3的溶解度大于NiS的溶解度
C.向d点对应的溶液中加入对应阴离子的钠盐,d点向b点移动
D.P为3.5且对应的阴离子是CO32-
32.向体积均为100mL浓度均为1molL的 NaClO、NaOH、CH3COONa的三种溶液中通入CO2,测得各溶液中n(HCO3-)的变化如下:
下列分析正确的是
A.CO2通入 NaClO溶液的反应:2ClO-+CO2+H2O=CO32-+2HClO
B.CO2通入 CH3COONa溶液的反应:CO2+H2O+ CH3COO-=HCO3-+ CH3COOH
C.通入n(CO2)=0.06mol,NaOH溶液的反应:2OH-+CO2=CO32-+H2O
D.通入n(CO2)=0.06mol,三种溶液中:n(HCO3-)+n(CO32-)+n(H2CO3)=0.06mol
33.在某温度时,将n mol·L-1氨水滴入10 mL 1.0 mol·L-1 盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是
A.a点KW=1.0×10-14 B.b点:c(NH)>c(Cl-)>c(H+)>c(OH-)
C.25 ℃时,NH4Cl水解常数为(n-1)×10-7(用n表示) D.d点水的电离程度最大
高考化学二轮复习突破题专题11物质结构与性质(强化训练)(2份打包,解析版+原卷版,可预览): 这是一份高考化学二轮复习突破题专题11物质结构与性质(强化训练)(2份打包,解析版+原卷版,可预览),文件包含高考化学二轮复习突破题专题11物质结构与性质强化训练解析版doc、高考化学二轮复习突破题专题11物质结构与性质强化训练原卷版doc等2份试卷配套教学资源,其中试卷共39页, 欢迎下载使用。
高考化学二轮复习突破题专题07水溶液中的离子平衡(知识过关)(2份打包,解析版+原卷版,可预览): 这是一份高考化学二轮复习突破题专题07水溶液中的离子平衡(知识过关)(2份打包,解析版+原卷版,可预览),文件包含高考化学二轮复习突破题专题07水溶液中的离子平衡知识过关解析版doc、高考化学二轮复习突破题专题07水溶液中的离子平衡知识过关原卷版doc等2份试卷配套教学资源,其中试卷共35页, 欢迎下载使用。
高考化学二轮复习突破题专题08实验大综合(强化训练)(2份打包,解析版+原卷版,可预览): 这是一份高考化学二轮复习突破题专题08实验大综合(强化训练)(2份打包,解析版+原卷版,可预览),文件包含高考化学二轮复习突破题专题08实验大综合强化训练解析版doc、高考化学二轮复习突破题专题08实验大综合强化训练原卷版doc等2份试卷配套教学资源,其中试卷共44页, 欢迎下载使用。












