
所属成套资源:高考化学三轮复习题型精准练题型+规范练(含解析)
高考化学三轮复习题型精准练题型十一图像的组合判断(含解析)
展开
这是一份高考化学三轮复习题型精准练题型十一图像的组合判断(含解析),共8页。试卷主要包含了单项选择题,不定项选择题等内容,欢迎下载使用。
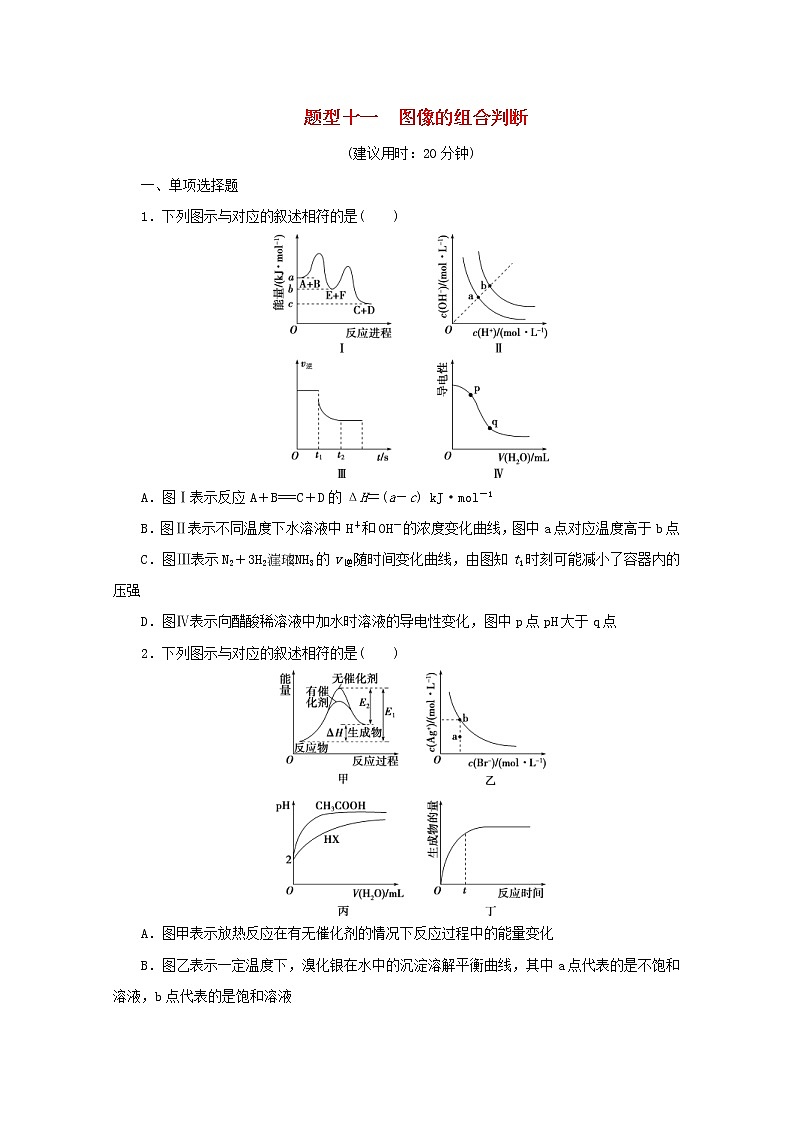
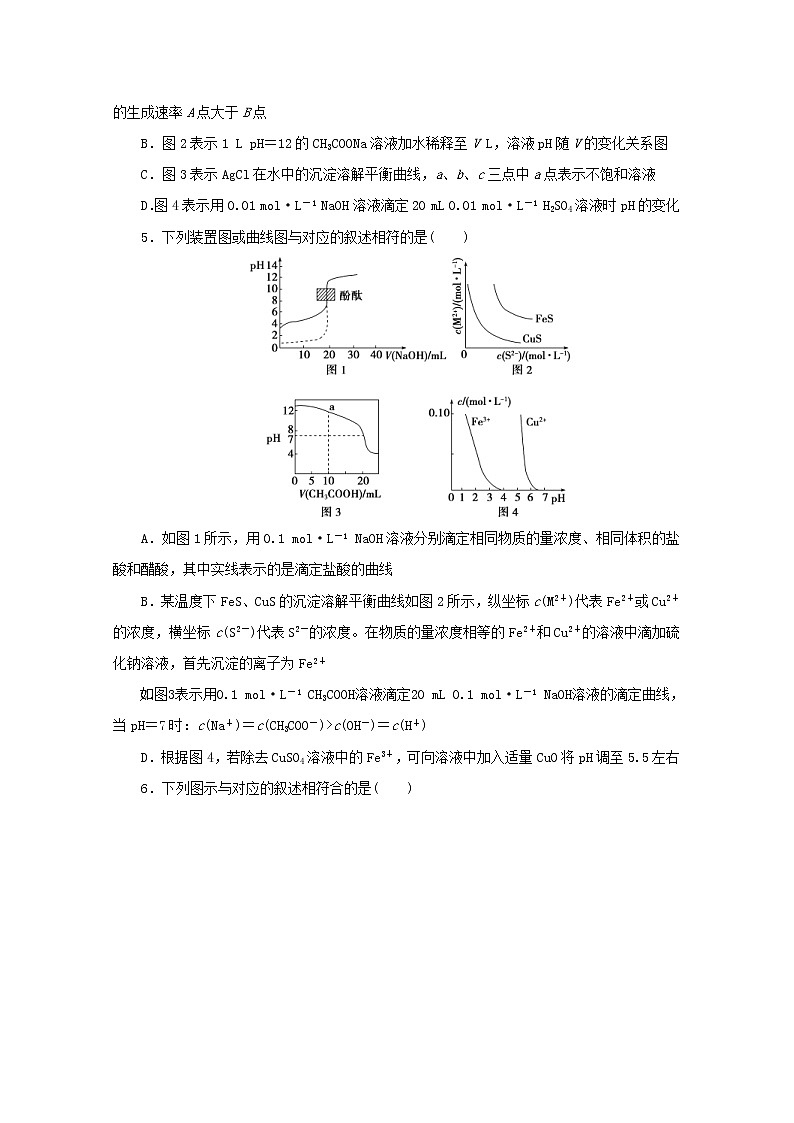
题型十一 图像的组合判断(建议用时:20分钟)一、单项选择题1.下列图示与对应的叙述相符的是( )A.图Ⅰ表示反应A+B===C+D的ΔH=(a-c) kJ·mol-1B.图Ⅱ表示不同温度下水溶液中H+和OH-的浓度变化曲线,图中a点对应温度高于b点C.图Ⅲ表示N2+3H22NH3的v逆随时间变化曲线,由图知t1时刻可能减小了容器内的压强D.图Ⅳ表示向醋酸稀溶液中加水时溶液的导电性变化,图中p点pH大于q点2.下列图示与对应的叙述相符的是( )A.图甲表示放热反应在有无催化剂的情况下反应过程中的能量变化B.图乙表示一定温度下,溴化银在水中的沉淀溶解平衡曲线,其中a点代表的是不饱和溶液,b点代表的是饱和溶液C.图丙表示25 ℃时,分别加水稀释体积均为100 mL、pH=2的一元酸CH3COOH溶液和HX溶液,则25 ℃时HX的电离平衡常数大于CH3COOHD.图丁表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大3.下列图示与对应的叙述相符的是( )A.图甲实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化B.图乙表示反应2SO2(g)+O2(g)2SO3(g) ΔH<0的平衡常数K与温度和压强的关系C.图丙表示向0.1 mol·L-1的NH4Cl溶液中滴加0.1 mol·L-1的HCl溶液时,溶液中随HCl溶液体积的变化关系D.图丁表示常温下向20.00 mL pH=3的醋酸中滴加pH=11的NaOH溶液,溶液的pH随NaOH溶液体积的变化关系4.(2019·宿迁高三期末测试)下列图示与对应的叙述相符的是( )A.图1表示恒温恒容条件下,反应N2+3H22NH3中c(NH3)与反应时间关系,NH3的生成速率A点大于B点B.图2表示1 L pH=12的CH3COONa溶液加水稀释至V L,溶液pH随V的变化关系图C.图3表示AgCl在水中的沉淀溶解平衡曲线,a、b、c三点中a点表示不饱和溶液D.图4表示用0.01 mol·L-1 NaOH溶液滴定20 mL 0.01 mol·L-1 H2SO4溶液时pH的变化5.下列装置图或曲线图与对应的叙述相符的是( )A.如图1所示,用0.1 mol·L-1 NaOH溶液分别滴定相同物质的量浓度、相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线B.某温度下FeS、CuS的沉淀溶解平衡曲线如图2所示,纵坐标c(M2+)代表Fe2+或Cu2+的浓度,横坐标c(S2-)代表S2-的浓度。在物质的量浓度相等的Fe2+和Cu2+的溶液中滴加硫化钠溶液,首先沉淀的离子为Fe2+C.如图3表示用0.1 mol·L-1 CH3COOH溶液滴定20 mL 0.1 mol·L-1 NaOH溶液的滴定曲线,当pH=7时:c(Na+)=c(CH3COO-)>c(OH-)=c(H+)D.根据图4,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量CuO将pH调至5.5左右6.下列图示与对应的叙述相符合的是( )A.图甲表示t1时刻增加反应物浓度后v正和v逆随时间的变化B.图乙表示反应2SO2(g)+O2(g)2SO3(g) ΔH<0 在两种条件下物质能量随反应过程的变化C.图丙表示25 ℃时用0.01 mol·L-1 NaOH溶液滴定20.00 mL 0.01 mol·L-1 HCl溶液时pH随NaOH 溶液体积的变化D.图丁表示电解精炼铜时纯铜和粗铜的质量随时间的变化二、不定项选择题7.下图所示与对应叙述相符的是( )A.图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS)>Ksp(CuS)B.图乙表示pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸C.图丙表示用0.100 0 mol·L-1 NaOH溶液滴定25.00 mL 盐酸的滴定曲线,则c(HCl)=0.080 0 mol·L-1D.图丁表示反应N2(g)+3H2(g)2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)8.(2019·南京高三学情调研)下列图示与对应的叙述相符合的是( )A.图甲表示某吸热反应在有催化剂和无催化剂的情况下反应过程中的能量变化B.图乙表示加水稀释pH均为2的HCl溶液和CH3COOH溶液的pH变化C.图丙表示KNO3的溶解度曲线,a点所示的溶液是80 ℃时KNO3的不饱和溶液D.图丁表示用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 CH3COOH溶液的滴定曲线9.(2019·常州高三学业水平监测)根据下列图示所得出的结论正确的是( )A.图甲是在不同温度下三个恒容容器中反应2H2(g)+CO(g)CH3OH(g) ΔH<0的平衡曲线,曲线X对应的温度相对较高B.图乙是一定温度下三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线,a点可表示MgCO3的不饱和溶液,且c(Mg2+)<c(CO)C.图丙为MOH和ROH两种一元碱溶液在常温下分别加水稀释时pH的变化曲线,可知ROH是强碱D.图丁为两个1 L容器中各投入1 mol CH4和1 mol CO2发生反应CH4(g)+CO2(g)2CO(g)+2H2(g)的平衡曲线,N点化学平衡常数K=1参考答案与解析1.解析:选C。A项,根据图Ⅰ,反应A+B===C+D属于放热反应,ΔH=(c-a) kJ·mol-1,错误;B项,根据图Ⅱ,温度越高,水的离子积常数越大,图中a点对应温度低于b点,错误;C项,根据图Ⅲ,t1时刻,逆反应速率减小,平衡逆向移动,可能减小了容器内的压强,正确;D项,根据图Ⅳ,向醋酸稀溶液中加水时,溶液中离子的浓度逐渐减小,溶液的导电性逐渐减弱,p点酸性比q点强,pH小于q点,错误。2.解析:选B。图甲中反应物的能量比生成物的能量低,所以反应为吸热反应,选项A错误;溴化银在水中存在沉淀溶解平衡,c(Ag+)·c(Br-)=Ksp(AgBr),则图乙中曲线上的点都代表饱和溶液,曲线下方的点都是不饱和溶液,选项B正确;酸越强加水稀释相同倍数时的pH变化越大,所以由图丙可知,醋酸的酸性强于HX,所以HX的电离平衡常数一定小于醋酸的电离平衡常数,选项C错误;对于可逆反应,反应达平衡后,反应物的转化率最高,图丁中t时不是平衡状态,所以t时反应物的转化率不是最大,选项D错误。3.解析:选C。A项,催化剂能同时加快正、逆反应速率,错误;B项,平衡常数K只与温度有关,与压强无关,错误;C项,向0.1 mol·L-1的NH4Cl溶液中滴加0.1 mol·L-1的HCl溶液时,H+浓度增大,NH水解程度变小,但其浓度随溶液体积增大而减小,故增大,正确;D项,pH=3的CH3COOH溶液和pH=11的NaOH溶液等体积混合,溶液显酸性,即a<7,且弱酸发生中和反应时,突变范围变小,错误。4.解析:选C。A项,A点为平衡点,所以NH3的生成速率变慢,错误;B项,如果稀释的是强碱,每稀释10倍,pH减小1,但CH3COONa溶液水解显碱性,加水稀释时,pH变化与所加水的体积不是直线关系,且pH不会降到7以下,错误;C项,a点在曲线的下方,当c(Cl-)相同时,沉淀溶解平衡时的c(Ag+)比a点处c(Ag+)大,则说明a点处没有生成AgCl沉淀,即为不饱和溶液,正确;D项,起始时c(H2SO4)=0.01 mol·L-1,对应的c(H+)=0.02 mol·L-1,pH<2,与图像起始点不吻合,且滴定终点时消耗NaOH溶液为40 mL,错误。5.解析:选C。A项,用0.1 mol·L-1 NaOH溶液滴定醋酸时,随着加入氢氧化钠的量的增加,醋酸会电离出一部分氢离子,所以出现的pH突跃要缓慢,且等浓度的HCl和CH3COOH溶液pH小的是盐酸,错误;B项,依据图像分析可知,硫化铜溶度积小于硫化亚铁,向同浓度Fe2+和Cu2+的溶液中滴加硫化钠溶液,先析出的沉淀是硫化铜,错误;C项,反应后溶液pH=7,依据溶液中电荷守恒,c(H+)+c(Na+)=c(OH-)+c(CH3COO-),c(H+)=c(OH-),则c(CH3COO-)=c(Na+),即c(Na+)=c(CH3COO-)>c(OH-)=c(H+),正确;D项,分析图像可知铁离子完全沉淀的pH约为3.7,加入氧化铜调节溶液pH≥5时铜离子会沉淀,应调节溶液pH范围为3.7<pH<5,错误。6.解析:选A。A项,增加反应物浓度后,正反应速率瞬间增大,逆反应速率瞬间不变,然后逐渐反应达到平衡,正确;B项,2SO2(g)+O2(g)2SO3(g) ΔH<0,反应为放热反应,与图像不符,图中反应为吸热反应,错误;C项,25 ℃时用0.01 mol·L-1 NaOH溶液滴定20.00 mL 0.01 mol·L-1 HCl溶液时,在氢氧化钠溶液体积为20 mL时会发生pH的突变,图像未体现,错误;D项,电解精炼铜时,阳极溶解的金属除了铜,还有铁、锌等,阴极只析出铜,粗铜溶解的质量与纯铜增大的质量不等,因此纯铜和粗铜的质量变化与图像不符,错误。7.解析:选AC。A项,依据图甲分析可知,硫化铜溶度积小于硫化亚铁,正确;B项,稀释相同倍数,甲酸的pH变化大,说明酸性:甲酸>乙酸,错误;C项,图丙表示用0.100 0 mol·L-1 NaOH溶液滴定25.00 mL盐酸的滴定曲线,滴定终点时,n(HCl)=n(NaOH),则 c(HCl)==0.080 0 mol·L-1,正确;D项,根据图丁可知,随着的增大,相当于增大氮气的物质的量,平衡正向移动,氢气的转化率增大,因此αA(H2)<αB(H2),错误。8.解析:选AC。A项,吸热反应中生成物的总能量比反应物的大,有催化剂可以降低反应的活化能,正确;B项,强酸加水稀释时,c(H+)迅速减小,而弱酸加水稀释时,由于弱酸存在电离平衡,c(H+)在减小的同时,还要电离补充出少量的c(H+),所以相同pH的强酸和弱酸在稀释相同倍数时,弱酸的pH变化小,错误;C项,a点时,溶质KNO3的量没有达到饱和状态下的量,所以a点所示的溶液是80 ℃时KNO3的不饱和溶液,正确;D项,图中起点处pH=1,而0.100 0 mol·L-1CH3COOH的pH大于1,且pH的突跃较缓慢,错误。9.解析:选BC。A项,正反应放热,则相同时,温度越高,CO平衡转化率越小,所以曲线Z对应的温度相对较高,A错误;B项,a点c(Mg2+)·c(CO)<Ksp(MgCO3),则a点可表示MgCO3的不饱和溶液,a点-lg c(Mg2+)>-lg c(CO),则c(Mg2+)<c(CO),B正确;C项,MOH溶液稀释100倍,pH减小1,说明MOH是弱碱,ROH溶液稀释100倍,pH减小2,说明ROH是强碱,C正确;D项,M点平衡时CH4、CO2、CO、H2的浓度分别为0.5 mol/L、0.5 mol/L、1 mol/L、1 mol/L,则该温度下的平衡常数K==4,N点和M点温度相同,K相同,所以N点化学平衡常数K=4,D错误。
相关试卷
这是一份高考化学三轮复习题型精准练题型一化学与STSE传统文化(含解析),共7页。试卷主要包含了单项选择题,不定项选择题等内容,欢迎下载使用。
这是一份高考化学三轮复习题型精准练题型四离子反应的应用(含解析),共7页。试卷主要包含了单项选择题,不定项选择题等内容,欢迎下载使用。
这是一份高考化学三轮复习题型精准练题型十三化学平衡的移动(含解析),共10页。试卷主要包含了单项选择题,不定项选择题等内容,欢迎下载使用。








