




- 2022年高考化学一轮复习高频考点集训专题15 化学反应速率和化学平衡(2份打包,解析版+原卷版,可预览) 试卷 0 次下载
- 2022年高考化学一轮复习高频考点集训专题17 电化学基础(2份打包,解析版+原卷版,可预览) 试卷 0 次下载
- 2022年高考化学一轮复习高频考点集训专题18 认识有机化合物、生命中的基础有机化学物质、进入合成高分子化合物的时代(2份打包,解析版+原卷版,可预览) 试卷 0 次下载
- 2022年高考化学一轮复习高频考点集训专题20 烃的含氧衍生物(2份打包,解析版+原卷版,可预览) 试卷 0 次下载
- 2022年高考化学一轮复习高频考点集训专题19 烃和卤代烃(2份打包,解析版+原卷版,可预览) 试卷 0 次下载
2022年高考化学一轮复习高频考点集训专题16 水溶液中的离子平衡(2份打包,解析版+原卷版,可预览)
展开专题16 水溶液中的离子平衡
一、单选题
1.在25 ℃时,某稀溶液中由水电离产生的H+浓度为1.0×10-13 mol/L,下列有关该溶液的叙述,正确的是( )
A.该溶液可能呈酸性 B.该溶液一定呈碱性
C.该溶液的pH一定是1 D.该溶液的pH不可能为13
2.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.遇苯酚显紫色的溶液:、、、
B.的溶液:、、、
C.水电离的的溶液中:、、、
D.的溶液:、、、
3.某溶液仅有中的几种.为确定其成分,做如下实验:①取部分溶液.加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的 NaOH 溶液后白色沉淀全部溶解;②另取部分溶液,加入HNO3酸化的溶液,无沉淀产生.下列推断正确的是( )
A.肯定有,一定没有 和
B.肯定有,可能有
C.肯定有,肯定没有
D.该溶液可能显弱酸性,也可能显中性
4.已知室温时,0.1某一元酸HA在水中有0.1%发生电离,下列叙述正确的是( )
A.该溶液的pH=3
B.升高温度,溶液的 pH 增大
C.此酸的电离平衡常数约为1×10-7
D.由 HA 电离出的约为水电离出的 的105倍
5.室温时,向20 mL 0.1 mol/L的一元弱酸HA溶液中滴加同浓度的NaOH溶液,溶液中与pH的关系如图所示。下列说法正确的是( )
A.室温时,电离常数Ka(HA)=1.0×10-5.3
B.B点对应NaOH溶液的体积是10 mL
C.A点溶液中:c(Na+)>c(A-)>c(H+)>c(OH-)
D.从A点到B点的过程中,水的电离程度先增大后减小
6.下列方法不能证明CH3COOH的酸性比H2S强的是( )
A.向Na2S溶液中滴加醋酸溶液
B.测定0.1 mol/L CH3COOH溶液和0.l mol/L H2S溶液的pH
C.测定物质的量浓度相同的CH3COONa溶液和Na2S溶液的pH
D.常温下,pH=4的醋酸溶液和氢硫酸分别稀释100倍,测定稀释后溶液的pH
7.常温下,H2SeO4 第一步完全电离,第二步电离常数Ka2=1.2×10-2。现有浓度都为0.1 mol/L的三种溶液:①NaHSeO4 溶液②H2SeO4溶液③Na2SeO4溶液。下列说法正确的是( )
A.c(SeO):③>②>①
B.pH:③>①>②
C.①中:c(Na+)= c(HSeO)+c(H2SeO4)+c(SeO)
D.①和③组成的中性溶液中: c(Na+)<c(HSeO)+ c(SeO)
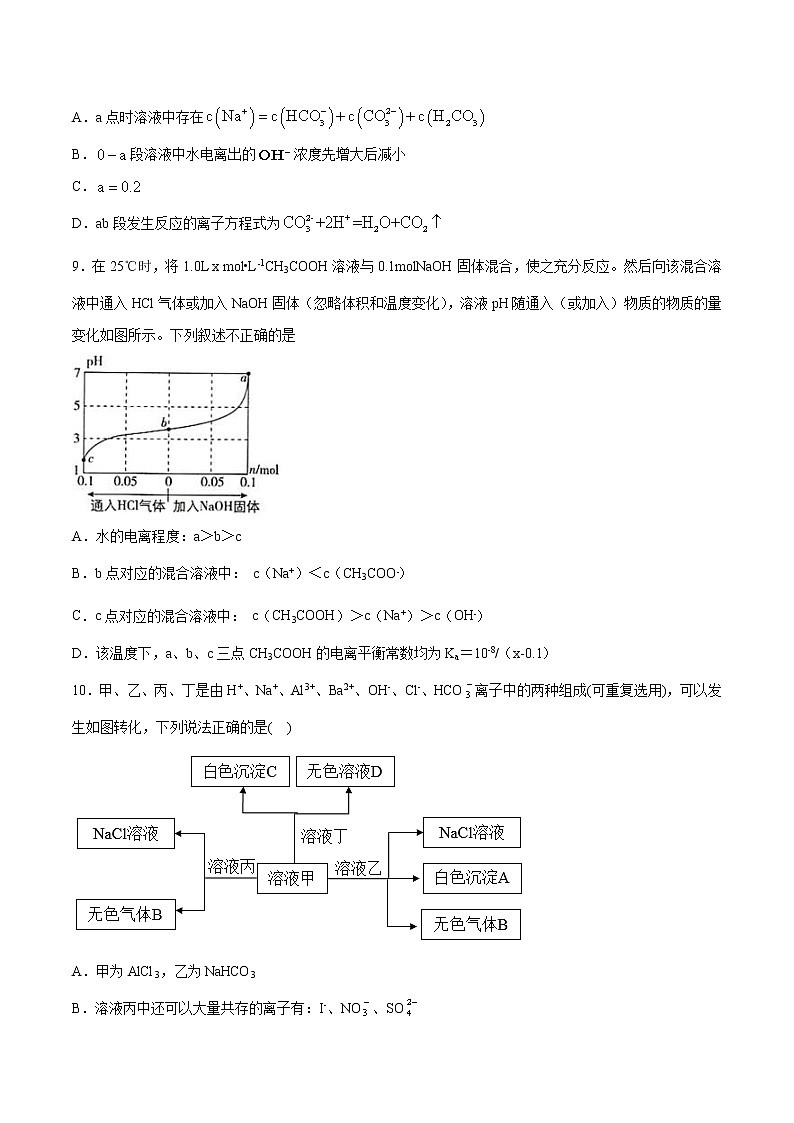
8.向NaOH和混合溶液中滴加盐酸,的生成量与加入盐酸的体积的关系如图所示,下列判断正确的是
A.a点时溶液中存在
B.段溶液中水电离出的浓度先增大后减小
C.
D.ab段发生反应的离子方程式为
9.在25℃时,将1.0L x mol•L﹣1CH3COOH溶液与0.1molNaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量变化如图所示。下列叙述不正确的是
A.水的电离程度:a>b>c
B.b点对应的混合溶液中: c(Na+)<c(CH3COO﹣)
C.c点对应的混合溶液中: c(CH3COOH)>c(Na+)>c(OH﹣)
D.该温度下,a、b、c三点CH3COOH的电离平衡常数均为Ka=10-8/(x-0.1)
10.甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH-、Cl-、HCO离子中的两种组成(可重复选用),可以发生如图转化,下列说法正确的是( )
A.甲为AlCl3,乙为NaHCO3
B.溶液丙中还可以大量共存的离子有:I-、NO、SO
C.在甲中滴加丁开始反应的离子方程式:HCO+Ba2++OH-=BaCO3↓+H2O
D.白色沉淀A可能溶解在溶液D中
11.25℃时,将c1、V1的稀HCl和c2、V2的NH3·H2O溶液充分混合,下列叙述错误的是( )
A.若pH<7,则一定是c1V1≤c2V2
B.混合过程中c()+c(H+ )=c(Cl-)+c(OH-)一定成立
C.当pH=7时,若V1=V2,则c2必须大于c1
D.若c()+c(NH3·H2O)=c(Cl-),则一定有c1V1=c2V2
12.常温下,浓度均为0.1 mol/L的下列6种溶液的pH如表所示:
溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
下列说法正确的是( )
A.NaClO溶液中水的电离程度大于C6H5ONa溶液中水的电离程度
B.NaHCO3溶液中有c(Na+ )>c()>c()>c(H2CO3)>c(OH-)>c(H+)
C.向NaCN溶液中通入少量CO2,反应为NaCN+H2O+CO2=NaHCO3+ HCN
D.电离常数的大小顺序为Ka(CH3COOH)>Ka(C6H5OH)>Ka(H2CO3)
13.亚氯酸钠(NaClO2)在溶液中会生成ClO2、HClO2、ClO、Cl-等,其中HClO2和ClO2都具有漂白作用。已知pOH=-lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析正确的是( )
A.HClO2的电离平衡常数的数值Ka=10-8
B.pOH=11时,ClO部分转化成ClO2和Cl-离子的方程式为:5ClO+2H2O=4ClO2+Cl-+4OH-
C.pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO)>c(Cl-)
D.同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有:c(Na+)+c(OH-)=c(H+)+c(HClO2)
14.室温下,用滴定管量取一定体积的浓氯水置于锥形瓶中,用溶液以恒定速度来滴定,根据测定结果绘制出、等离子的物质的量浓度c与时间t的关系曲线如下。下列说法正确的是( )
A.溶液和浓氯水可以使用同种滴定管盛装
B.a点溶液中存在如下关系:
C.b点溶液中各离子浓度:
D.,生成速率越来越快
二、综合题
15.氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格CuCl产品的主要质量指标为CuCl的质量分数大于96.50%。工业上常通过下列反应制备CuCl:2CuSO4+Na2SO3+2NaCl+Na2CO32CuCl↓+3Na2SO4+CO2↑
(1)CuCl制备过程中需要质量分数为20.0%的CuSO4溶液,试计算配制该溶液所需的CuSO4·5H2O与H2O的质量之比___________。
(2)准确称取所制备的0.250 0 g CuCl样品置于一定量的0.5 mol·L-1FeCl3溶液中,待样品完全溶解后,加水20 mL,用0.100 0 mol·L-1的Ce(SO4)2溶液滴定到终点,消耗24.60 mL Ce(SO4)2溶液。有关化学反应为Fe3++CuClFe2++Cu2++Cl-
Ce4++Fe2+Fe3++Ce3+
通过计算说明上述样品中CuCl的质量分数是否符合标准_______。
16.完成下列与溶液pH有关的计算,并提炼解题规律。
(1)室温下pH=4的NH4Cl溶液和HCl溶液中由水电离出的c(H+)之比为_______。
(2)在25℃时,pH等于9和pH等于11的两种氢氧化钠溶液等体积混合后,溶液中的氢离子浓度为_____。
(3)某温度时,水的KW=10-13,将此温度下pH=12的NaOH溶液aL与pH=2的H2SO4溶液bL混合,
①若所得混合溶液为中性,则a:b= ____。
②若所得混合溶液pH=3,则a:b=_____。
(4)已知某温度时0.1 mol•L-1NaOH pH等于11,在此温度下,若将100体积pH1=a的H2SO4溶液与1体积pH2=b的NaOH溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是________________(用含a、b的表达式表示)。
(5)(学法题)总结归纳求混合溶液pH时,应注意的问题:__________________。
17.请按要求回答下列问题:
(1)已知25 ℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。在25 ℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为_____________。
(2)25 ℃时,向0.01 mol·L-1的MgCl2溶液中,逐滴加入浓NaOH溶液,刚好出现沉淀时,溶液的pH为________;当Mg2+完全沉淀时,溶液的pH为________(忽略溶液体积变化,已知lg 2.4=0.4,lg 7.7=0.9)。
(3)已知25 ℃时,Ksp(AgCl)=1.8×10-10,则将AgCl放在蒸馏水中形成饱和溶液,溶液中的c(Ag+)约为______ mol·L-1。
(4)已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+Fe3++3H2O的平衡常数K=________。
18.研究碳、氮、硫等元素化合物的性质或转化对建设生态文明、美丽中国具有重要意义。
(1)海水中无机碳的存在形式及分布如图所示,用离子方程式表示海水呈弱碱性的主要原因______________________。已知春季海水pH=8.1,预测冬季海水碱性将会_______(填“增强”或“减弱”),理由是_________________。
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)===CH3OH(g) ΔH<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是________(填字母)。
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.c点状态下再通入1molCO和4molH2,新平衡中H2的体积分数增大
D.a点状态下再通入0.5molCO和0.5molCH3OH,平衡不移动
(3)NO加速臭氧层被破坏,其反应过程如下图所示:
①NO的作用是_________________。
②已知:O3(g)+O(g)===2O2(g) ΔH=-143kJ·mol-1
反应1:O3(g)+NO(g)===NO2(g)+O2(g) ΔH1=-200.2kJ·mol-1 。
反应2:热化学方程式为____________________________。
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-759.8kJ·mol -1,反应达到平衡时,N的体积分数随n(CO)n(NO)的变化曲线如下图。
①b点时,平衡体系中C、N原子个数之比接近________。
②a、b、c三点CO的转化率从小到大的顺序为________;b、c、d三点的平衡常数从大到小的顺序为__________。
③若n(CO)n(NO)=0.8,反应达平衡时,N的体积分数为20%,则NO的转化率为_____。
19.氯化亚铜是一种重要的化工原料,一种利用低品位铜矿主要含有Cu2S、CuS、FeO、Fe2O3、SiO2等为原料制取CuCl的工艺流程如下:
(1)反应Ⅰ“浸取”前需将铜矿粉碎的目的是___________________________;
(2)滤渣Ⅰ的成分除S和外还含有___________,反应 Ⅰ中的作用为_______________
(3)已知生成氢氧化物的pH如下表,则反应Ⅱ“中和”时,用氨水调pH的范围是______________。
物质 | |||
开始沉淀pH | |||
完全沉淀pH |
(4)检验滤液Ⅱ中是否含有所需要的试剂是:______________
(5)①反应Ⅲ中生成难溶的离子方程式:______________
②反应Ⅳ所对应的化学方程式:______________________________
(6) CuCl的定量分析
步骤1.取样品0.7500g和30.0mL 1.0mol·L-1过量的FeCl3溶液置于250mL的锥形瓶中,不断摇动。
步骤2.待样品溶解后,平均分为3份,用0.1000mol·L-1 Ce(SO4)2标准溶液进行滴定。
三次实验测得数据如下表
序号 | 1 | 2 | 3 |
起始读数 | |||
终点读数 |
已知:;。
①数据处理:计算得CuCl的纯度为_________
②误差分析:下列操作会使测定结果偏高的是______________
A.锥形瓶中有少量蒸馏水
B.滴定终点读数时仰视滴定管刻度线
C.0.1000mol·L-1硫酸铈溶液久置后浓度变小
D.滴定前滴定管尖嘴无气泡,滴定后产生气泡
E.用量筒取10.0mL 1.0mol·L-1的溶液时仰视刻度线
2022年高考化学一轮复习高频考点集训专题19 烃和卤代烃(2份打包,解析版+原卷版,可预览): 这是一份2022年高考化学一轮复习高频考点集训专题19 烃和卤代烃(2份打包,解析版+原卷版,可预览),文件包含2022年高考化学一轮复习高频考点集训专题19烃和卤代烃解析版doc、2022年高考化学一轮复习高频考点集训专题19烃和卤代烃原卷版doc等2份试卷配套教学资源,其中试卷共23页, 欢迎下载使用。
2022年高考化学一轮复习高频考点集训专题17 电化学基础(2份打包,解析版+原卷版,可预览): 这是一份2022年高考化学一轮复习高频考点集训专题17 电化学基础(2份打包,解析版+原卷版,可预览),文件包含2022年高考化学一轮复习高频考点集训专题17电化学基础解析版doc、2022年高考化学一轮复习高频考点集训专题17电化学基础原卷版doc等2份试卷配套教学资源,其中试卷共26页, 欢迎下载使用。
2022年高考化学一轮复习高频考点集训专题11 原子结构与性质(2份打包,解析版+原卷版,可预览): 这是一份2022年高考化学一轮复习高频考点集训专题11 原子结构与性质(2份打包,解析版+原卷版,可预览),文件包含2022年高考化学一轮复习高频考点集训专题11原子结构与性质解析版doc、2022年高考化学一轮复习高频考点集训专题11原子结构与性质原卷版doc等2份试卷配套教学资源,其中试卷共21页, 欢迎下载使用。












