


2022版《导与练》高考化学二轮复习 板块三 化学反应原理综合课件PPT
展开NO.1 “品”高考考情——考什么?怎么考?精准备考!
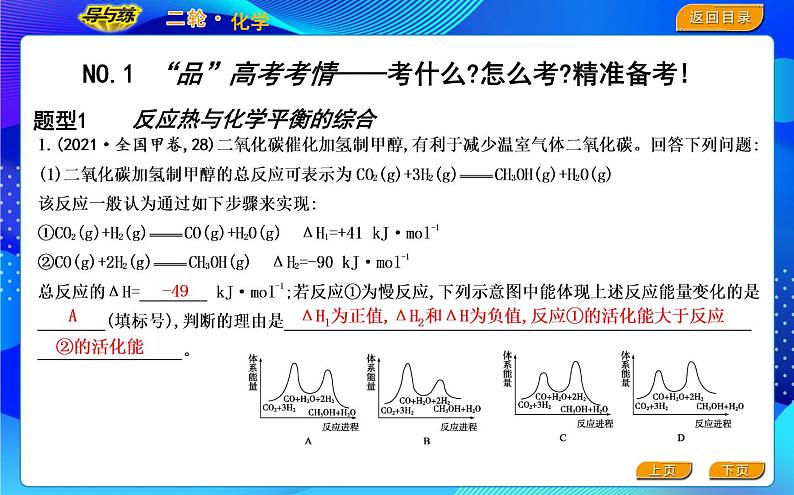
反应热与化学平衡的综合
ΔH1为正值,ΔH2和ΔH为负值,反应①的活化能大于反应
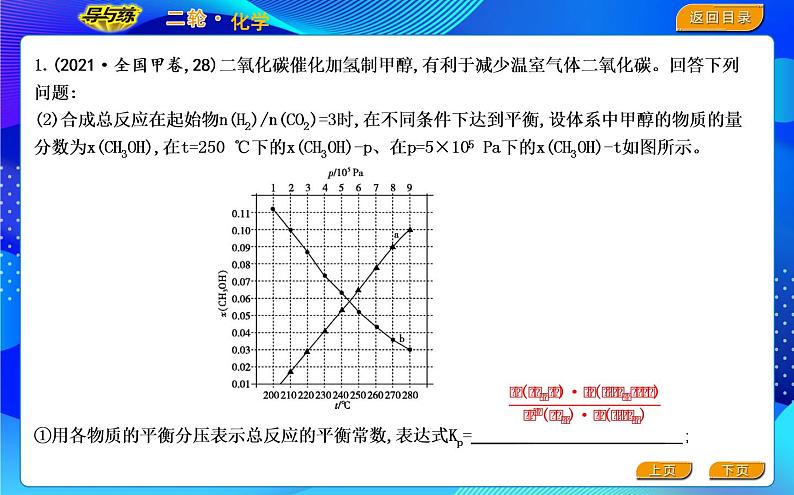
1.(2021·全国甲卷,28)二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:(2)合成总反应在起始物n(H2)/n(CO2)=3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250 ℃下的x(CH3OH)-p、在p=5×105 Pa下的x(CH3OH)-t如图所示。
①用各物质的平衡分压表示总反应的平衡常数,表达式Kp= ;
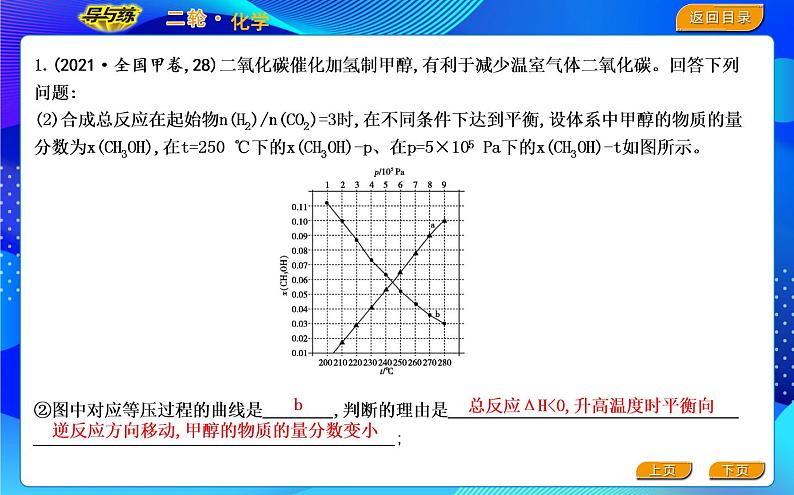
②图中对应等压过程的曲线是 ,判断的理由是 . ;
总反应ΔH<0,升高温度时平衡向
逆反应方向移动,甲醇的物质的量分数变小
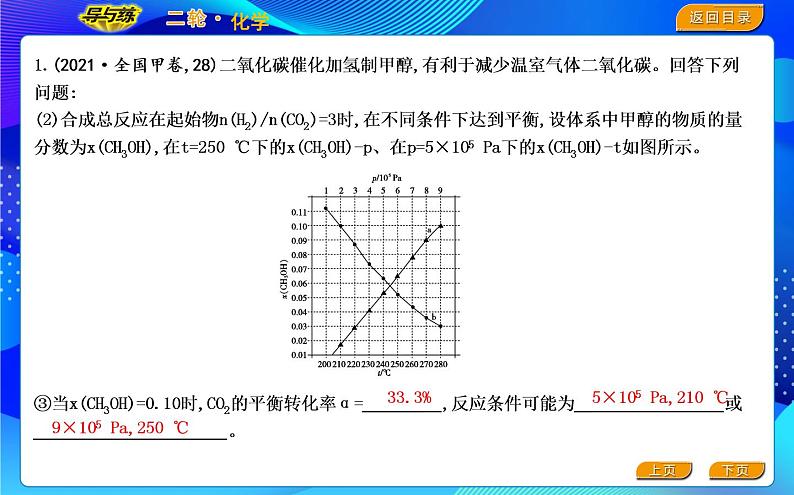
③当x(CH3OH)=0.10时,CO2的平衡转化率α= ,反应条件可能为 或 。
5×105 Pa,210 ℃
9×105 Pa,250 ℃
2.(2020·全国Ⅲ卷,28)二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。回答下列问题:(1)CO2催化加氢生成乙烯和水的反应中,产物的物质的量之比n(C2H4)∶ n(H2O)= 。当反应达到平衡时,若增大压强,则n(C2H4) (填“变大”“变小”或“不变”)。
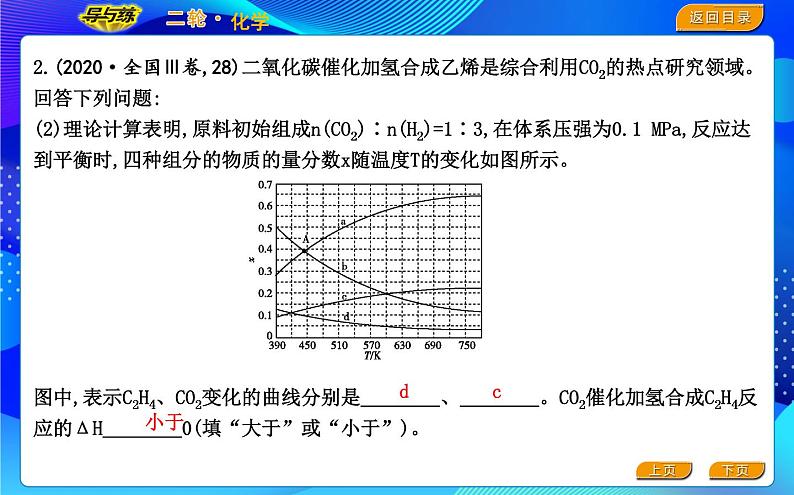
2.(2020·全国Ⅲ卷,28)二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。回答下列问题:(2)理论计算表明,原料初始组成n(CO2)∶n(H2)=1∶3,在体系压强为0.1 MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。
图中,表示C2H4、CO2变化的曲线分别是 、 。CO2催化加氢合成C2H4反应的ΔH 0(填“大于”或“小于”)。
2.(2020·全国Ⅲ卷,28)二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。回答下列问题:(3)根据图中点A(440 K,0.39),计算该温度时反应的平衡常数Kp= (MPa)-3(列出计算式。以分压表示,分压=总压×物质的量分数)。
(4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成C3H6、C3H8、C4H8等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当 。
(1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CO(s),氧化钴部分被还原为金属钴C(s),平衡后气体中H2的物质的量分数为 0.025 0。②在同一温度下用CO还原CO(s),平衡后气体中CO的物质的量分数为0.019 2。根据上述实验结果判断,还原CO(s)为C(s)的倾向是CO H2(填“大于”或“小于”)。
(2)721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为 (填标号)。 A.<0.25 ~ E.>0.50
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用·标注。
可知水煤气变换的ΔH 0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正= eV,写出该步骤的化学方程式: 。
4.(2018·全国Ⅱ卷,27)CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
①由上表判断,催化剂X Y(填“优于”或“劣于”),理由是 . . 。 在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是 (填标号)。 A.K积、K消均增加B.v积减小,v消增加C.K积减小,K消增加D.v消增加的倍数比v积增加的倍数大
催化剂X,催化剂Y积碳反应的活化能大,积碳反应的速率小;而消碳反应活化能相对小,消碳反应速率大
pc(CO2)、pb(CO2)、pa(CO2)
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在 p(CH4) 一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为 。
5.(2018·全国Ⅲ卷,28)三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:(1)SiHCl3在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成(HSiO)2O等,写出该反应的化学方程式 。
5.(2018·全国Ⅲ卷,28)三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
①343 K时反应的平衡转化率α= %。平衡常数K343 K= (保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是 ;要缩短反应达到平衡的时间,可采取的措施有 、 。
提高反应物压强(浓度)
6.(2017·全国Ⅱ卷,27)丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是 . 。
氢气是产物之一,随着n(氢气)/n(丁烷)增大,逆反应
6.(2017·全国Ⅱ卷,27)丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590 ℃之前随温度升高而增大的原因可能是 、 ; 590 ℃之后,丁烯产率快速降低的主要原因可能是 . 。
升高温度有利于反应向吸热方向进行
溶液、电化学与化学平衡的综合
1.(2020·全国Ⅱ卷,26)化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许 离子通过,氯气的逸出口是 (填标号)。
1.(2020·全国Ⅱ卷,26)化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为 。
(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,逸出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 ml ClO2消耗NaClO2的量为 ml;产生“气泡”的化学方程式为 。
(5)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是 (用离子方程式表示)。工业上是将氯气通入30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1 000 kg该溶液需消耗氯气的质量为 kg(保留整数)。
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是 .(填标号)。 A.T1>T2B.a点的反应速率小于c点的反应速率C.a点的正反应速率大于b点的逆反应速率D.b点时二聚体的浓度为0.45 ml·L-1
水会阻碍中间物Na的生成;水会电解生成OH-,进一步与Fe2+反应生成 Fe(OH)2
该电解池的阳极为 ,总反应为 。电解制备需要在无水条件下进行,原因为 . 。
3.(2019·全国Ⅲ卷,28)近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:
可知反应平衡常数K(300 ℃) K(400 ℃)(填“大于”或“小于”)。设HCl初始浓度为c0,根据进料浓度比 c(HCl)∶c(O2)=1∶1的数据计算K(400 ℃)= (列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比 c(HCl)∶c(O2)过低、过高的不利影响分别是 。
O2和Cl2分离能耗较高、HCl转化率较低
(3)在一定温度的条件下,进一步提高HCl的转化率的方法是 . 。(写出2种)
负极区发生的反应有 (写反应方程式)。电路中转移1 ml电子,需消耗氧气 L(标准状况)。
(4)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如图所示:
4.(2017·全国Ⅲ卷,28)砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图: 。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式: 。 该反应需要在加压下进行,原因是 。
增加反应物O2的浓度,提高As2S3的转化速率
2ΔH1-3ΔH2-ΔH3
②tm时,v正 v逆(填“大于”“小于”或“等于”)。 ③tm时,v逆 tn时v逆(填“大于”“小于”或“等于”),理由是 . 。④若平衡时溶液的pH=14,则该反应的平衡常数K为 。
NO.2 “拆”大题拆分——这么拆,这么练,各个击破!
1.反应热的比较(1)分清是ΔH还是热量的比较。热量无正负,只比较数值;ΔH有正负,比较大小注意带符号比较。(2)直接比较法①吸热反应的ΔH肯定比放热反应的大(前者大于0,后者小于0)。②等量的可燃物完全燃烧所放出的热量比不完全燃烧所放出的热量多。
④对于可逆反应,因反应不能进行完全,实际反应过程中放出或吸收的热量要小于相应热化学方程式中的反应热数值。
2.反应热的三种计算方式(1)利用键能计算:ΔH=∑E(反应物)-∑E(生成物),即ΔH等于反应物的键能总和与生成物的键能总和之差。(2)由ΔH含义计算:ΔH=H(生成物)-H(反应物),这类计算通常会通过图像的方式给出计算所需的数据。(3)盖斯定律的应用:盖斯定律既可以计算出目标反应的ΔH,也可以得出目标反应的热化学方程式。①调方向:根据目标方程式反应物、生成物的位置,调整已知方程式的反应方向。满足目标方程式各物质的位置要求,注意方程式方向改变,ΔH符号随之改变,但数值不变。
②调化学计量数:把目标方程式中不存在的物质的化学计量数调整为相等, ΔH随之进行调整,与化学计量数成比例。③相加:把调整好的方程式相加就得到目标方程式,必要时可约简化学计量数,同时也得到相应方程式的反应热ΔH。
答案 -49 A ΔH1为正值,ΔH2和ΔH为负值,反应①的活化能大于反应②的活化能
2.(1)(2020·全国Ⅰ卷,28)钒催化剂参与反应的能量变化如图所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为: 。
ΔH1= kJ·ml-1。
(3)若某温度下,CH3COOH(aq)与NaOH(aq)反应的ΔH=-46.8 kJ·ml-1, H2SO4(aq)与NaOH(aq)的中和热ΔH2=-57.3 kJ·ml-1,则CH3COOH在水溶液中电离的反应热ΔH1= 。
解析 (3)醋酸和NaOH的中和反应(反应热ΔH),可以分为CH3COOH的电离 (反应热ΔH1)、H+和OH-的中和(反应热ΔH2)两步,故ΔH1=ΔH-ΔH2= -46.8 kJ·ml-1-(-57.3 kJ·ml-1)=+10.5 kJ·ml-1。
答案 (3)+10.5 kJ·ml-1
答案 (4)+124 kJ·ml-1 -4 566
化学平衡状态及移动方向的判断
1.化学平衡状态的判定(1)直接判定:v正=v逆(实质)①一定是用同一物质表达的正反应速率与逆反应速率相等(即该物质的生成速率与消耗速率相等)。②对于用不同物质表达的速率,可通过化学方程式中的化学计量数转化为同一物质,但必须是不同方向的速率。
(2)间接判定关键是看欲判定的条件因素是否与可逆化学反应具备相关性,也就是当化学反应向某一方向进行时,该因素是否随之发生变化:①若条件随反应进行发生变化,说明两者具备相关性,当该条件不变时,建立平衡。②若条件不随反应进行发生变化,说明两者不具备相关性,条件不变时,不一定建立平衡。2.化学平衡移动的判断(1)判断转化率的变化时,不要把平衡正向移动与反应物转化率提高等同起来,要视具体情况而定。(2)压强影响的实质是浓度的影响,所以只有当这些“改变”造成浓度改变时,平衡才有可能移动。
(3)化学平衡移动的目的是“减弱”外界条件的改变,而不是“抵消”外界条件的改变。也就是说,新平衡建立后该物理量介于改变前后的值之间。①反应物A的浓度由1 ml·L-1增大为2 ml·L-1,平衡右移,平衡后A的浓度: 1 ml·L-1
(5)虚拟过程法判断平衡移动:在判断平衡移动时,如果不好直接得出结论,可用构造虚拟过程的方法,比如在一定温度下,2 ml SO2和1 ml O2在容器甲中建立的平衡体系中,再加入2 ml SO2和1 ml O2的混合气体,可假定在另一个相同体积的容器乙中先建立平衡,此时这两个平衡体系完全一致,然后把乙中气体压入容器甲,甲中各物质的量增倍,则平衡右移。3.等效平衡(1)等效平衡的概念在一定条件(恒温、恒容或恒温、恒压)下,同一可逆反应体系,不管是从正反应开始,还是从逆反应开始,在达到化学平衡状态时,任何相同组分的百分含量(体积分数、物质的量分数等)均相同,这样的化学平衡互称等效平衡。①相同的外界条件:通常可以是恒温、恒容或恒温、恒压。
②平衡状态只与始态有关,而与途径无关(无论反应从正反应方向开始,还是从逆反应方向开始,或是从中间状态开始;不管投料是一次还是分成几次;反应容器经过扩大—缩小或缩小—扩大的过程),只要起始浓度相当,就达到相同的平衡状态。(2)等效平衡的判定①恒温、恒容条件a.对于反应前后气体分子数改变的可逆反应,对于几种不同的起始状态,如果通过方程式的化学计量数转换为反应同一侧(“一边倒”换算),与原平衡完全相同,则两平衡等效。b.对于反应前后气体分子数不变的可逆反应,通过方程式的化学计量数转换为反应同一侧,只要各物质的物质的量之比与原平衡相同,则两平衡等效。
②恒温、恒压条件不管反应前后气体分子数是否改变,只要通过方程式的化学计量数转换为反应同一侧的状态,各物质的物质的量之比与原平衡相同,则达平衡后与原平衡等效。
答案 (1)升高温度 减小压强(增大体积)
答案 (2)1∶4 变大
(2)(2020·全国Ⅲ卷,28)CO2催化加氢生成乙烯和水的反应中,产物的物质的量之比n(C2H4)∶n(H2O)= 。当反应达到平衡时,若增大压强,则n(C2H4) (填“变大”“变小”或“不变”)。
(1)①在31 min时,若只改变某一条件使平衡发生移动,40 min、50 min时各物质的浓度如上表所示,则改变的条件是 。
答案 (1)①减小二氧化碳浓度
解析 (1)①在31 min时,改变某一条件,反应重新达到平衡时c(CO2)= 0.017 ml·L-1,c(N2)=0.034 ml·L-1,c(NO)=0.032 ml·L-1,已知反应条件为恒温恒容,依据数据分析,氮气浓度增大,二氧化碳和一氧化氮浓度减小,且该反应为反应前后气体体积不变的反应,所以改变的条件应为减小二氧化碳浓度,平衡正向移动。
② 在51 min时,保持温度和容器容积不变再充入NO和N2,使两者的浓度均增加至原来的两倍,此时反应v正 (填“>”“<”或“=”)v逆。
在T ℃时,图中M、N点能表示该反应达到平衡状态,理由是 。 改变温度,v(NO2)会由M点变为A、B或C点,v(N2O4)会由N点变为D、E或F点,当升高到某一温度时,反应重新达到平衡,相应的点分别为 (填字母)。
(1)表示CH3CH2OH体积分数曲线的是 (填字母,下同)。
解析 (1)反应为吸热反应,升高温度,平衡向正反应方向移动,平衡时CO2与H2的含量减小,CH3CH2OH(g)、H2O(g)的含量增大,CH3CH2OH与H2O按物质的量之比1∶3生成,平衡时H2O的含量是CH3CH2OH含量的三倍;曲线a、曲线b随温度升高含量增大,且曲线a的含量高,所以曲线a表示H2O、曲线b表示CH3CH2OH;曲线c、曲线d随温度升高含量减小,且曲线c的含量高,所以曲线c表示H2、曲线d表示CO2。
(2)一定温度下,反应达到平衡状态的标志是 。 A.平衡常数K不再增大B.CO2的转化率不再增大C.混合气体的平均相对分子质量不再改变D.反应物不再转化为生成物
解析 (2)平衡常数K只受温度影响,温度不变,平衡常数不变,不能说明反应达到平衡状态,故A错误;CO2的转化率不再增大,说明反应达到最大限度,即达到平衡状态,故B正确;混合气体总质量不变,随反应进行,混合气体总物质的量变化,平均相对分子质量变化,当混合气体的平均相对分子质量不再改变,说明反应达到平衡状态,故C正确;化学平衡是动态平衡,所以反应物和生成物一直在不停地转化,故D错误。
(3)一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
答案 (3)0.4
1.化学反应速率的计算与比较
(2)同一反应用不同的物质表示反应速率时,数值可能不同,但意义相同。不同物质表示的反应速率,存在如下关系:v(A)∶v(B)∶v(C)∶v(D)= m∶n∶c∶d。
(3)化学反应速率的大小比较(注意把速率的单位换算成相同单位)。①通过反应条件比较大小,高温、高压、增大浓度、使用催化剂时化学反应速率都要加快。②用不同物质表达的反应速率要通过方程式转化为同一物质再作比较。③对于有催化剂存在的多步反应,活化能小的反应的反应速率快于活化能大的反应的反应速率。
②化学平衡常数只与温度有关,与反应物或生成物的浓度无关。③平衡常数表达式与方程式的书写形式有关。对于同一个反应,当方程式的化学计量数不同时,对应有不同的平衡常数(数值、单位均不同);当方程式逆写时,平衡常数与原平衡常数互为倒数。(3)压强平衡常数Kp①Kp仅适用于气相发生的反应。②在气相的化学平衡体系中,用各气体物质的分压替代浓度计算得到的平衡常数就是压强平衡常数。
④各组分分压=总压×各组分物质的量分数。
3.基元反应与化学反应速率常数(1)基元反应①基元反应是指在反应中,反应物微粒(分子、离子、自由基等)一步直接转化为产物的反应。②绝大多数的反应不是基元反应,需要经历若干个基元反应才能完成。
②化学反应速率常数在数值上等于各反应物浓度为1 ml·L-1时的反应速率数值。
(2)判断反应的热效应升高温度,K增大,则正反应为吸热反应;K减小,则正反应为放热反应。
6.催化剂的催化原理与活化能(1)催化剂的催化原理主要是改变反应的路径,生成多种中间产物,催化反应往往由多步基元反应组成,其中活化能最大的基元反应,反应速率最慢,决定整个反应的反应速率。(2)催化剂的主要作用是提供一个活性位点,与反应物分子结合生成中间吸附产物。整个催化历程总体上可分为吸附—反应—脱附三个阶段,每个阶段可能包含多步反应。首先,反应物分子被吸附在催化剂表面,催化剂与反应物分子反应生成中间产物,然后,这些中间产物继续反应或脱离催化剂表面生成最终产物。(3)反应物分子在催化剂表面的吸附—反应—脱附过程的反应活化能远小于反应物分子直接反应的活化能,使得反应更容易进行,反应速率大大加快。(4)由于在整个化学反应中催化剂经历了反应又生成的变化,所以催化剂在整个反应前后化学组成没有发生变化,但是催化剂的物理状态会发生变化(块状、颗粒变为粉末)。
回答下列问题:①将组成(物质的量分数)为2m% SO2(g)、m% O2(g)和q% N2(g)的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若SO2转化率为α,则SO3压强为 ,平衡常数Kp= (以分压表示,分压=总压×物质的量分数)。
解析 ②升高温度,反应速率常数k增大,反应速率v提高,但α降低使反应速率逐渐下降。t
答案 ②升高温度,k增大使v逐渐提高,但α降低使v逐渐下降。t
答案 ②(1-α) AD
解析 (1)根据①×2-②=③,可推知平衡常数之间的关系。
(2)在1 L恒容密闭容器中充入2 ml NO(g)和1 ml Cl2(g),在不同温度下测得c(NOCl)与时间t的关系如图1 所示:
①反应开始到10 min时,NO的平均反应速率v(NO)= ml·L-1·min-1。
答案 (2)①0.1
②T2时该反应的平衡常数K为 。
③T2时Cl2的平衡转化率为 。
(3)若按投料比n(NO)∶n(Cl2)=2∶1把NO和Cl2加入一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图2所示。①该反应的ΔH (填“>”“<”或“=”)0。
解析 (3)①根据图像可知,升高温度,平衡时NO的转化率减小,说明平衡逆向移动,该反应正反应属于放热反应,ΔH<0。
(3)若按投料比n(NO)∶n(Cl2)=2∶1把NO和Cl2加入一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图2所示。②在p压强条件下,M点时容器内NO的体积分数为 。
(3)若按投料比n(NO)∶n(Cl2)=2∶1把NO和Cl2加入一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图2所示。③若反应一直保持在p压强条件下进行,则M点的分压平衡常数Kp= (用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
答案 (1)放热 ①
速率、平衡图像题的综合分析
1.高考中速率、平衡图像题的特点(1)近三年高考试题速率、平衡图像的呈现
(2)化学平衡相关图像题目的特点①把可逆化学反应的特点通过图像展示给考生,要求考生通过对图像的解读获取反应相关信息来解答相关问题。②图像从2019年的速率图像过渡为近两年的平衡图像,涉及的化学反应主要是容器中气体间的反应。③图像的横坐标基本是温度、时间、压强;纵坐标多为平衡气体分压(各组分物质的量分数)、浓度、反应物的平衡转化率等。2021年开始变化较大,纵坐标引入压强平衡常数的对数,横坐标把温度转变为温度的倒数。同时开始出现多坐标轴,实际是把两个图像呈现在一幅图中,需要分清曲线对应的坐标轴。这些创新可能会成为以后平衡图像试题的一个方向。④从上面的总结中可以看出,平衡图像类题目解答所用的理论依据基本都是条件对化学反应速率、化学平衡的影响。
2.化学速率、平衡图像的解答方法(1)图像信息的获取①看轴:弄清纵、横坐标的物理含义。②看面:分析多条曲线的差异(不同温度、不同压强)与相互关系。③看线:弄清线的走向、变化趋势及线的陡与平所代表的化学意义;把线的变化趋势解读为可逆化学反应的特点(ΔH、反应前后气体的变化)。④看点:弄清曲线上点的含义,特别是一些特殊点,如与坐标轴的交点、曲线的交点、折点、最高点与最低点等;尤其这些特殊点的数值是相关计算的依据。
(2)图像信息的应用①在准确解读图像信息的基础上,对试题信息进行加工处理
②找准切入口,用好图像信息a.从曲线的变化趋势着手通过温度、压强对可逆反应平衡的影响特点,确定化学反应的ΔH以及反应前后分子数的变化。b.从点入手尤其是给出坐标数值的点(包括坐标轴上的起点),这些都是进行平衡相关计算(转化率、平衡常数、反应速率等)的数据信息来源。c.分清直线(水平段居多)、曲线变化(上升、下降、平缓、转折等)代表的化学含义,同时对走势有转折变化的曲线,要分段分析,找出各段曲线的变化趋势及其含义,每一段可能发生了不同的反应。
由图可知,NOCl分解为NO和Cl2反应的ΔH 0(填“大于”或“小于”)。
答案 (2)①-49
②合成总反应在起始物n(H2)/n(CO2)=3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 x(CH3OH),在t=250 ℃下的x(CH3OH)-p、在p=5×105 Pa下的x(CH3OH)-t如图所示。
(2)(2021·全国甲卷,28)二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
图中对应等压过程的曲线是 ,判断的理由是 ; 当x(CH3OH)=0.10时, CO2的平衡转化率α= ,反应条件可能为 或 。
答案 ②b 总反应ΔH<0,升高温度时平衡向逆反应方向移动,甲醇的物质的量分数变小 33.3% 5×105 Pa, 210 ℃ 9×105 Pa,250 ℃
答案 (1)0.975 该反应气体分子数减少,增大压强,α提高。5.0 MPa> 2.5 MPa=p2,所以p1=5.0 MPa 温度、压强和反应物的起始浓度(组成)
解析 (1)由题给反应式知,该反应为气体分子数减少的反应,其他条件一定时,增大压强,SO2平衡转化率增大,故p1=5.0 MPa。结合题图知,5.0 MPa、550 ℃时对应的SO2平衡转化率为0.975。影响平衡转化率的因素有温度、压强、反应物的起始浓度等。
(2)(2020·全国Ⅲ卷,28)CO2催化加氢生成乙烯和水的反应中,理论计算表明,原料初始组成n(CO2)∶n(H2)=1∶3,在体系压强为0.1 MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。
(ⅰ)图中,表示C2H4、CO2变化的曲线分别是 、 。CO2催化加氢合成C2H4反应的ΔH 0(填“大于”或“小于”)。 (ⅱ)根据图中点A(440 K,0.39),计算该温度时反应的平衡常数Kp= (MPa)-3(列出计算式。以分压表示,分压=总压×物质的量分数)。
(1)①其他条件相同、催化剂不同,SO2的转化率随反应温度的变化如图1, Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑催化剂价格因素,选择Fe2O3的主要优点是 。
答案 (1)①Fe2O3作催化剂时,在相对较低的温度可获得较高的SO2转化率,从而节约能源
解析 (1)①由题图1可知,Fe2O3作催化剂时,与其他催化剂相比较,SO2的转化率达到最高时,温度相对较低。
②某科研小组用Fe2O3作催化剂。在380 ℃时,分别研究了n(CO)∶n(SO2)为1∶1、3∶1时,SO2转化率的变化情况(图2)。则图2中表示n(CO)∶n(SO2)= 3∶1的变化曲线为 。
解析 ②增大n(CO)∶n(SO2),SO2的转化率增大,则题图2中表示n(CO)∶n(SO2)=3∶1的变化曲线为曲线a。
答案 (2)2k2•Kp BD 反应达到平衡状态时,v(NO2)=2v(N2O4)
NO.3 “组”题点组合——考什么,练什么,整体突破!
1.(2021·全国乙卷,28)一氯化碘(ICl)是一种卤素互化物,具有强氧化性,可与金属直接反应,也可用作有机合成中的碘化剂。回答下列问题:(1)历史上海藻提碘中得到一种红棕色液体,由于性质相似①,Liebig误认为是ICl,从而错过了一种新元素的发现,该元素是 。
[审题指导]①红棕色液体与碘单质性质相似,从物质的颜色、状态、性质确认为溴单质。
③376.8 ℃建立平衡,烧瓶中压强为32.5 kPa,结合前面得出的Cl2的分压0.1 kPa, 可以知道ICl、I2的分压和为32.5 kPa-0.1 kPa=32.4 kPa,结合I2初始分压数值 20.0 kPa,利用三段式进行计算。
回答下列问题:(1)写出NO与NH3反应生成N2和液态水的热化学方程式: 。
解析 (2)反应物的活化能越高,化学反应速率越慢,故慢反应Ⅱ的活化能最高;及时分离出O2可以使反应Ⅲ平衡正向移动,生成更多M,促进前两步反应进行。
答案 (2)Ⅱ 使反应Ⅲ平衡正向移动,释放出活性中心M
①t1、t3时改变的条件分别是 、 。
答案 (3)①升高温度 加催化剂
②下列时间段中,氨的百分含量最低的是 (填字母)。 a.t0~t1b.t2~t3c.t3~t4d.t5~t6
解析 ②所给时间段均为平衡状态,t1时是升高温度,平衡逆向移动,达到新平衡时氨气量减少,故氨的百分含量t2~t3时间段小于t0~t1时间段,t3时加入催化剂,平衡不移动,则氨的百分含量t3~t4时间段等于t2~t3时间段,t4时,正反应速率不变,逆反应速率降低,平衡正向移动,说明t4时移走了生成物,氨气量减少,t5时重新达到平衡,根据勒夏特列原理,平衡移动无法抵消条件改变,故氨的百分含量t5~t6时段小于t3~t4时段,则氨的百分含量最低的时段为t5~t6,选d。
③在恒温密闭容器中,进料浓度比c(H2)∶c(N2)分别等于3∶2、3∶1、7∶2时N2平衡转化率随体系压强的变化如图所示:
表示进料浓度比c(H2)∶c(N2)=7∶2的对应曲线是 (填字母),设R点c(NH3)=x ml/L,则化学平衡常数K= (列出计算式)。
3.(2021·广西南宁三模)“十三五”期间,中国应对气候变化工作取得显著成效,并向国际社会承诺2030年实现“碳达峰”,2060年实现“碳中和”。CO2的回收及综合利用越来越受到国际社会的重视,将CO2转化为高附加值化学品已成为有吸引力的解决方案。Ⅰ.CO2合成二甲醚(DME):
答案 Ⅰ.(1)-123
解析 Ⅰ.(1)由盖斯定律得,ΔH=2ΔH1+ΔH2=2×(-49 kJ·ml-1)+(-25 kJ·ml-1)=-123 kJ·ml-1。
(2)将1 ml CO2、3 ml H2通入容积为1 L的恒容密闭容器中合成二甲醚, 200 ℃时容器内CO2的物质的量随时间的变化如表所示:
①0~40 min内,消耗H2的平均反应速率为 ml·L-1·min-1。
答案 (2)①0.052 5
②能说明反应已达平衡状态的是 (填字母)。 a.c(CO2)∶c(H2O)=1∶6b.混合气体的密度不变c.2v正(H2)=v逆(H2O)d.密闭容器内压强不变
(3)在不同温度和不同氢碳比时,合成二甲醚反应CO2的平衡转化率如图1所示,则图中氢碳比由大到小的顺序是 (用a、b、c、d表示)。
答案 (3)d>c>b>a
解析 (3)在相同温度时,n(H2)越大,即氢碳比越大,CO2的平衡转化率越高,故d>c>b>a。
(4)在503 K时,当以氢碳比为0.9时合成二甲醚(如图2),则化学平衡常数Kp= (用气体的平衡分压代替物质的量浓度计算压强平衡常数Kp,气体分压=气体总压×各气体的体积分数,列出表达式)。
3.(2021·广西南宁三模)“十三五”期间,中国应对气候变化工作取得显著成效,并向国际社会承诺2030年实现“碳达峰”,2060年实现“碳中和”。CO2的回收及综合利用越来越受到国际社会的重视,将CO2转化为高附加值化学品已成为有吸引力的解决方案。
①图3中甲醇的平衡产率随温度升高而降低的原因是 。
答案 Ⅱ.(5)①CO2合成甲醇与CO合成甲醇反应均为放热反应,升高温度,平衡逆向移动,甲醇平衡产率降低
解析 Ⅱ.(5)①CO2合成甲醇与CO合成甲醇反应均为放热反应,升高温度,平衡逆向移动,甲醇平衡产率降低。
②由图4可知,不同压强下CO2的平衡转化率在550 ℃后趋于相等,原因是 。
答案 ②温度高于550 ℃后,反应(ⅱ)起主要作用,它是体积不变的反应,所以不同的压强下平衡转化率趋于相等
解析 ②温度高于550 ℃后,反应(ⅱ)起主要作用,它是体积不变的反应,所以不同的压强下平衡转化率趋于相等。
①ΔH1= kJ·ml-1。 ②提高该反应平衡转化率②的方法有 、 。 ③容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α③。反应的平衡常数Kp= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:①阴极上的反应式为 。 ②若生成的乙烯和乙烷的体积比为2∶1,则消耗的CH4和CO2体积比⑤为 。
[审题指导]①燃烧热是1 ml物质完全燃烧[生成CO2、H2O(l)]所放出的热,据此写出相关物质燃烧的热化学方程式,利用盖斯定律计算目标反应的ΔH。②提高反应平衡转化率意味着平衡右移,根据反应特点(体积变化、ΔH)确定条件。③利用特殊值简化计算,设定加入乙烷、氢气都为1 ml,列出三段式。注意是恒压反应,依据提示信息计算。
2.(2021·河南漯河二模)H2S广泛存在于天然气等燃气及废水中,热分解或氧化H2S有利于环境保护并回收硫资源。回答下列问题:
①A、B两点化学平衡常数较大的是 (填“KA”或“KB”)。
解析 (2)①升高温度,生成物的物质的量增大,即平衡正向移动,则该反应为吸热反应,KB>KA。
②A点时S2的体积分数是 。
③若在两个等体积的恒容容器中分别加入2.0 ml H2S、1.0 ml H2S,测得不同温度下H2S的平衡转化率如图2所示。代表1.0 ml H2S分解的曲线是 (填“甲”或“乙”);M、N两点容器内的压强:p(N) 2p(M)(填“大于”或“小于”)。
解析 ③加入2 ml H2S的容器与加入1 ml H2S的容器相比,利用等效的思想,相当于加压,即转化率更小,所以甲对应的为1 ml H2S分解的曲线; M、N两点容器内H2S的转化率相同,平衡时N点气体物质的量为M点物质的量的2倍,但N点温度较高,所以2p(M)
答案 (3)1.01
(4)利用如图4所示的电化学装置处理工业尾气中的硫化氢可实现硫元素的回收,写出电极甲上的电极方程式: 。
3.(2021·山西阳泉三模)NO、NO2是大气污染物,但只要合理利用也是重要的资源。请回答下列问题:
①反应在D点达到平衡后,若此时升高反应温度,同时扩大容器体积使压强减小,在重新达到平衡过程中,D点会向A~G点中的 点移动。
解析 (3)①反应在D点达到平衡后,对反应容器升温的同时扩大体积使体系压强减小,则平衡会逆向移动,NO的体积分数增加,重新达到的平衡状态可能是图中A点;
②某研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(即NO的转化率),结果如图3所示。温度低于200 ℃ 时,图中曲线Ⅰ脱氮率随温度升高而变化不大的主要原因是 ;a点 (填“是”或“不是”)对应温度下的平衡脱氮率,理由是 。
解析 ②温度低于200 ℃时,图中曲线Ⅰ脱氮率随温度升高而变化不大的主要原因是温度较低时,催化剂的活性偏低;a点不是对应温度下的平衡脱氮率,因为该反应为放热反应,升高温度平衡逆向移动,平衡脱氮率减小,根据曲线Ⅱ 450 ℃时的脱氮率可知,a点对应温度下的平衡脱氮率应更高,即a点不是对应温度下的平衡脱氮率。
答案 ②温度较低时,催化剂的活性偏低 不是 因为该反应为放热反应,根据曲线Ⅱ可知,a点对应温度的平衡脱氮率应该更高
①阴极区的电极反应式为 。
高考化学二轮复习化学反应原理题突破08 反应原理综合题(课件精讲) (含解析): 这是一份高考化学二轮复习化学反应原理题突破08 反应原理综合题(课件精讲) (含解析),共22页。PPT课件主要包含了考情分析,化学平衡常数,8×10-3,典例分析,解得x=001,经典三段式法,56×104,速率常数,计算技巧,用压强进行的计算等内容,欢迎下载使用。
高考化学二轮复习化学反应原理题突破06 反应原理综合题(课件精讲) (含解析): 这是一份高考化学二轮复习化学反应原理题突破06 反应原理综合题(课件精讲) (含解析),共23页。PPT课件主要包含了化学反应速率,适用于任何物质,不能用于固体和纯液体,只适用于气体物质,典例分析,催化剂,化学平衡,acdeg,abcdg,bdg等内容,欢迎下载使用。
高考化学二轮复习化学反应原理题突破05 反应原理综合题(课件精讲) (含解析): 这是一份高考化学二轮复习化学反应原理题突破05 反应原理综合题(课件精讲) (含解析),共21页。PPT课件主要包含了基础图像,图像拓展,典例1,-116,系统II等内容,欢迎下载使用。












