




2022荆州荆州中学高二上学期期末化学试题含答案
展开荆州中学2021-2022学年上学期期末考试
高二化学试卷
可能用到的相对原子质量:H-1 C-12 O-16 Cl-35.5 Co-59 Cu-64
第Ⅰ卷(选择题)
一、选择题(本题共15题,每题3分,共45分。每题只有一个正确答案)
1. 习主席在十九大报告中指出:“绿水青山就是金山银山。”下列做法不利于环境保护的是
A. 开发清洁能源,提高能源的利用率
B. 对废电池做深埋处理
C. 使用Na2S做沉淀剂去除工业废水中的Cu2+
D. 施用适量石膏(CaSO4·2H2O)可降低盐碱地(含较多NaCl、Na2CO3)的碱性
2. 下列说法中正确的是
A. 生成物总能量大于反应物的总能量时,ΔH<0
B. 已知反应H2(g)+I2(g)⇌2HI(g)的平衡常数为K,则2H2(g)+2I2(g)⇌4HI(g)的平衡常数为2K
C. 由能量判据和熵判据组合而成的复合判据,将更适合于所有的过程
D. 反应NH3(g)+HCl(g)=NH4Cl(s)在低温下能自发进行,说明该反应的ΔH>0
3. 下列叙述正确的是
A. 可表示单核10电子粒子基态时的电子排布图
B. 2s的电子云半径比1s的电子云半径大,说明2s的电子比1s的多
C. s能级上电子的能量总小于p能级上电子的能量
D. 电子仅在激发态跃迁到基态时才会产生原子光谱
4. 下列关于电化学腐蚀、防护与利用的说法中,正确的是
A.铜板打上铁铆钉后,铜板更易被腐蚀 | B.暖气片表面刷油漆可防止金属腐蚀 | C.连接锌棒后,电子由铁管道流向锌 | D.阴极的电极反应式为Fe – 2e- = Fe2+ |
A. A B. B C. C D. D
5. NA为阿伏加德罗常数的值,下列有关说法正确的是
A. 500mL2mol·L-1FeCl3溶液中含有的Fe3+的数目小于NA
B. 1L0.1mol·L-1的NaHCO3溶液中HCO和CO离子数之和为0.1NA
C. 已知CH3COONH4溶液呈中性,则1L1.0mol·L-1CH3COONH4溶液中有NA个NH
D. 等体积、等物质的量浓度的NaCl和KCl溶液中,阴、阳离子数目之和均为2NA
6. 下列各组离子在相应的条件下可能大量共存的是
A. 能使石蕊试液变红的溶液中:CO、K+、Cl-、Na+
B. 25℃时,由水电离产生的c(OH-)=1.0×10-10mol·L-1的溶液中:NO、Mg2+、Na+、SO
C. 25℃时,=1.0×1012的溶液中:NH、Fe2+、Cl-、NO
D. 0.1mol·L-1的NaHCO3溶液中:Al3+、K+、Cl-、SO
7. 为探究锌与稀硫酸反应生成氢气的速率用[v(H2)来表示],向反应混合液中加入某些质,下列判断正确的是
A. 加入NaHSO4固体,v(H2)不变 B. 加入少量水,v(H2)减小
C. 加入Na2SO4固体,v(H2)减小 D. 滴加少量HNO3溶液,v(H2)增大
8. 我国科研人员研究发现合成氨的反应历程有多种,其中有一种反应历程如图所示(吸附在催化剂表面的物质用*表示)。下列说法错误的是
A. N2生成NH3是通过多步还原反应生成的
B. 该历程中既有共价键的断裂也有共价键的形成
C. 适当提高N2分压,可以加快N2(g)→*N2反应速率,提高N2在此步骤的转化率
D. 大量氨分子吸附在催化剂表面,将降低反应速率
9. 下列有关工业生产的叙述正确的是
A. 工业上通常采用电解熔融的MgO制得金属Mg
B. 在铁的表面镀铝的工艺中,镀件作阴极,镀层金属为阳极,饱和氯化铝溶液作为电镀液
C. 电解饱和食盐水制烧碱采用阳离子交换膜法,可防止阴极室产生的OH-进入阳极室
D. 电解精炼铜时,同一时间内阳极减少的质量一定等于阴极增加的质量
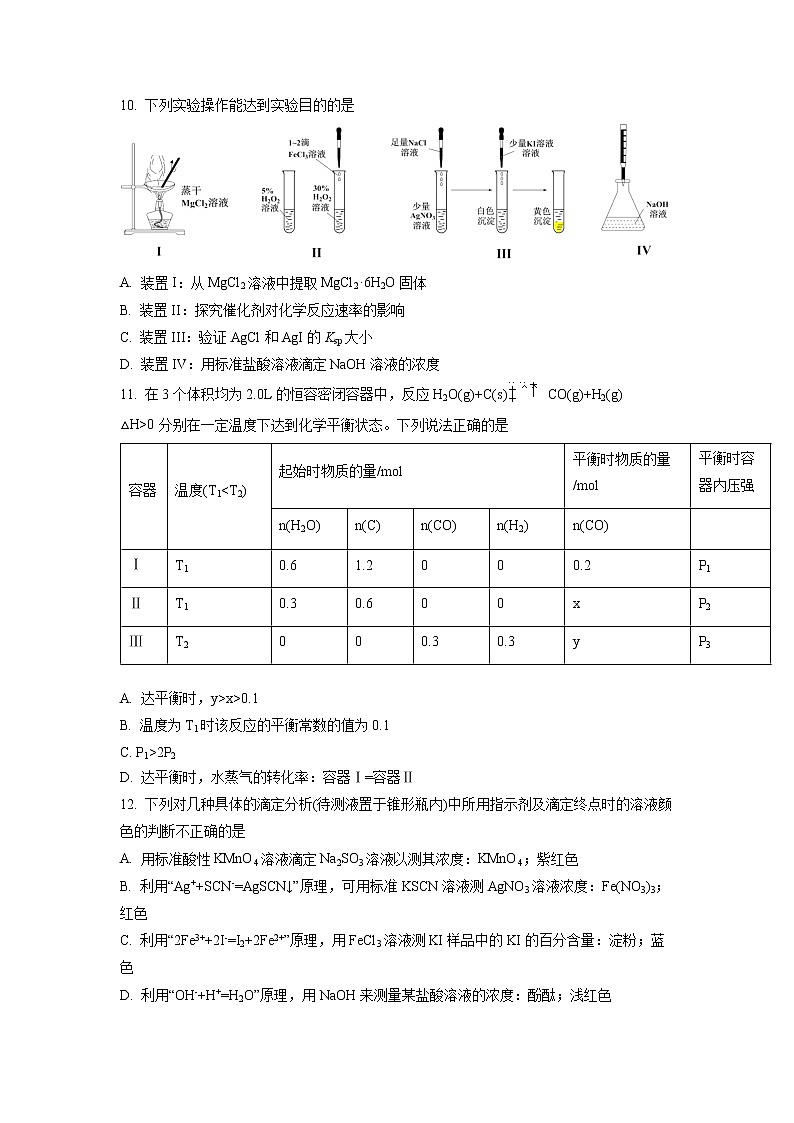
10. 下列实验操作能达到实验目的的是
A. 装置I:从MgCl2溶液中提取MgCl2·6H2O固体
B. 装置II:探究催化剂对化学反应速率的影响
C. 装置III:验证AgCl和AgI的Ksp大小
D. 装置IV:用标准盐酸溶液滴定NaOH溶液的浓度
11. 在3个体积均为2.0L的恒容密闭容器中,反应H2O(g)+C(s)CO(g)+H2(g) △H>0分别在一定温度下达到化学平衡状态。下列说法正确的是
容器 | 温度(T1<T2) | 起始时物质的量/mol | 平衡时物质的量/mol | 平衡时容器内压强 | |||
n(H2O) | n(C) | n(CO) | n(H2) | n(CO) |
| ||
Ⅰ | T1 | 0.6 | 1.2 | 0 | 0 | 0.2 | P1 |
Ⅱ | T1 | 0.3 | 0.6 | 0 | 0 | x | P2 |
Ⅲ | T2 | 0 | 0 | 0.3 | 0.3 | y | P3 |
A. 达平衡时,y>x>0.1
B. 温度为T1时该反应的平衡常数的值为0.1
C. P1>2P2
D. 达平衡时,水蒸气的转化率:容器Ⅰ=容器Ⅱ
12. 下列对几种具体的滴定分析(待测液置于锥形瓶内)中所用指示剂及滴定终点时的溶液颜色的判断不正确的是
A. 用标准酸性KMnO4溶液滴定Na2SO3溶液以测其浓度:KMnO4;紫红色
B. 利用“Ag++SCN-=AgSCN↓”原理,可用标准KSCN溶液测AgNO3溶液浓度:Fe(NO3)3;红色
C. 利用“2Fe3++2I-=I2+2Fe2+”原理,用FeCl3溶液测KI样品中的KI的百分含量:淀粉;蓝色
D. 利用“OH-+H+=H2O”原理,用NaOH来测量某盐酸溶液的浓度:酚酞;浅红色
13. 常温下,分别取浓度不同、体积均为20.00mL的3种HCl溶液,分别滴入浓度为1.000mol·L-1,0.1000mol·L-1和0.01000mol·L-1的NaOH溶液,测得3个反应体系的pH随V(NaOH)的变化的曲线如图,在V(NaOH)=20.00mL前后出现突跃。下列说法不正确的是
A. 3种HCl溶液的c(HCl):最大的是最小的100倍
B. 曲线a、b、c对应的c(NaOH):a>b>c
C. 当V(NaOH)=20.00mL时,3个体系中均满足:c(Na+)=c(Cl-)
D. 当V(NaOH)相同时,pH突跃最大的体系中的c(H+)最大
14. 一种利用双膜法电解回收CoCl2溶液中Co装置如图所示,电解时Co会析出在Co电极上。下列说法正确的是
A. a为电源的正极
B. 电解后H2SO4溶液的浓度减小
C. 电解后盐酸溶液的浓度增大
D. 常温时,Co电极的质量每增加5.9g,Ti电极上会析出1.12L气体
15. 金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度。它无电时也无需充电,只需更换其中的某些材料即可,其工作示意图如图,下列说法正确的是
A. 放电时,通入空气的一极为负极
B. 放电时,电池反应为4Li+O2+2H2O=4LiOH
C. 有机电解液可以是乙醇等无水有机物
D. 该电池无电时只需更换锂电极,不需要更换水性电解液
第Ⅱ卷(非选择题)
16. Ⅰ.回答下列问题:
(1)在实验室中配制FeCl3溶液时,配制方法是将FeCl3晶体溶于____中,然后加水稀释到所需浓度,这样操作的目的是____。
(2)如果盐的水解程度很大,则可用于无机化合物的制备。例如用TiCl4制备TiO2的反应可表示为:____,将所得产物TiO2·xH2O焙烧得到TiO2。
Ⅱ.以废旧铅酸蓄电池中的含铅废料和H2SO4为原料,可以制取高纯PbO,从而实现铅的再生利用。在此过程中涉及如下两个反应:
①2Fe2++PbO2+4H++SO=2Fe3++PbSO4+2H2O
②2Fe3++Pb+SO=2Fe2++PbSO4
(3)写出Pb与PbO2反应生成PbSO4的化学方程式____。
(4)在上述过程中,Fe2+的作用是____。
(5)下列实验方案,可证实上述过程,请将方案补充完整。
a.向酸化的FeSO4溶液中加入____溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.向a得到的溶液中加入____溶液恢复原来的颜色。
17. 氢氰酸(HCN)有剧毒,易挥发。金矿提金时,用NaCN溶液浸取金生成[Au(CN)2]-,再用锌置换出金,产生含氰废水需处理后排放。
(1)①写出基态锌离子的电子排布式____,基态氮原子的轨道表示式____。
②NaCN可用于制备CuCN,CuCN浊液中加入Na2S溶液可发生反应:2CuCN(S)+S2-(aq)Cu2S(s)+2CN-(aq),该反应的平衡常数K=____。[已知Ksp(CuCN)=3.5×10-20,Ksp(Cu2S)=1.0×10-48]。
(2)Cu2+可催化H2O2氧化废水中的CN-。其他条件相同时,总氰化物(CN-、HCN等)去除率随溶液初始pH变化如图所示。
①在酸性条件下,H2O2也能氧化CN-,但实际处理废水时却不在酸性条件下进行的原因是____。
②当溶液初始pH>10时,总氰化物去除率下降的原因可能是____。
(3)通过电激发产生HO•和OH-处理废水中CN-,可能的反应机理如图所示。虚线方框内历程可用方程式描述为____。
18. 钼(Mo)是一种重要的过渡金属元素,在电子行业有可能取代石墨烯,其化合物钼酸钠晶体(Na2MoO4·10H2O)可制造金属缓蚀剂。由钼精矿(主要成分MoS2,含有少量不反应杂质)制备钼及钼酸钠晶体的工艺流程如图:
(1)焙烧时,下列措施有利于使钼精矿充分反应的是____。(填序号)
a.适当增大空气的用量
b.增大钼精矿的量
c.将矿石粉碎
(2)已知焙烧产物为MoO3,“碱浸”过程中反应的离子方程式为____。
(3)已知钼酸钠的溶解度曲线如图所示,要获得钼酸钠晶体Na2MoO4·10H2O的操作2为____、____、过滤、洗涤、烘干。
(4)在实际生产中会有少量SO生成,用固体Ba(OH)2除去。在除SO前测定碱浸液中c(MoO)=0.80mol/L,c(SO)=0.02mol/L,当BaMoO4开始沉淀时,SO的去除率为____ %。(保留整数)[已知Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8,溶液体积变化可忽略不计]。
(5)在稀硫酸中利用电催化可将CO2同时转化为多种燃料,其原理如图所示。
铜电极上产生CH4的电极反应式为____,若铜电极上只生成5.6gCO,则铜极区溶液质量变化了____g。
19. 有机反应往往具有可逆性,同时还伴随副反应发生。请回答下列问题:
Ⅰ.利用甲醇(CH3OH)在一定条件下直接脱氢可制甲醛(HCHO),反应方程式为:CH3OH(g)HCHO(g)+H2(g) △H>0。
(1)已知CH3OH可以由CO和H2反应制备,制备过程中发生的反应有:
①CO(g)+2H2(g)CH3OH(g) △H=-907kJ/mol
②2CH3OH(g)CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
③CO(g)+H2O(g)CO2(g)+H2(g) △H=-41.2kJ/mol
则反应3CO(g)+3H2(g)CH3OCH3(g)+CO2(g)的△H=____。
(2)若在恒温恒容容器中进行上述制甲醛的反应,可判断反应达到平衡状态的是____(填序号)。
A. 混合气体的密度不变
B. CH3OH、HCHO的物质的量浓度之比为1:1
C. H2的体积分数不再改变
D. 混合气体的平均相对分子质量不变
Ⅱ.2—甲氧基—2—甲基丁烷(TAME)常用作汽油添加剂。在催化剂作用下,可通过甲醇与烯烃的液相反应制得,体系中同时存在如图反应:
反应Ⅰ:+CH3OH△H1
反应Ⅱ:+CH3OH△H2
反应Ⅲ: △H3
(3)反应Ⅰ、Ⅱ、Ⅲ以物质的量分数表示的平衡常数Kx与温度T变化关系如图所示。据图判断,A和B中相对稳定的是____。
(4)为研究上述反应体系的平衡关系,向某反应容器中加入1.0molTAME,控制温度为353K,测得TAME的平衡转化率为a。已知反应Ⅲ的平衡常数Kx3=8,则平衡体系中B的物质的量为____mol,反应I的平衡常数Kx1=____。
(5)为研究反应体系的动力学行为,向盛有四氢呋喃的另一容器中加入一定量A、B和CH3OH。控制温度为353K,A、B物质的量浓度c随反应时间t的变化如图所示。代表B的变化曲线为____(填“X”或“Y”);t=100s时,反应Ⅲ的V正____V逆(填“>”“<”或“=”)。
2024荆州荆州中学高一上学期期中化学试题含答案: 这是一份2024荆州荆州中学高一上学期期中化学试题含答案,文件包含湖北省荆州市荆州中学2023-2024学年高一上学期期中化学试题docx、湖北省荆州市荆州中学2023-2024学年高一上学期期中化学试题答案docx等2份试卷配套教学资源,其中试卷共7页, 欢迎下载使用。
2024荆州沙中学高二上学期9月月考化学试题含答案: 这是一份2024荆州沙中学高二上学期9月月考化学试题含答案,共8页。试卷主要包含了选择题等内容,欢迎下载使用。
2024荆州沙中学高二上学期9月月考化学试题含答案: 这是一份2024荆州沙中学高二上学期9月月考化学试题含答案,共8页。试卷主要包含了选择题等内容,欢迎下载使用。












