

2022-2023学年湖南省长郡中学高二上学期第一次月考化学试题含解析
展开湖南省长郡中学2022-2023学年高二上学期第一次月考化学试题
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.2007年2月,中国首条“生态马路”在上海复兴路隧道建成,它运用了“光触媒”技术,在路面涂上一种光催化剂涂料,可将汽车尾气中45%的NO和CO转化成N2和CO2。下列对此反应的叙述中正确的是( ).
A.使用光催化剂不改变反应速率 B.使用光催化剂能增大NO的转化率
C.升高温度能加快反应速率 D.改变压强对反应速率无影响
【答案】C
【详解】A. 使用光催化剂改变反应速率可以加快化学反应速率,A不正确;
B. 使用光催化剂对正、逆反应的速率的影响是相同的,不能增大NO的转化率,B不正确;
C. 升高温度能提高活化分子的百分数,故能加快反应速率,C正确;
D. 该反应中的所有组分均为气体,故改变压强对反应速率有影响,D不正确。
故选C。
2.下列说法正确的是
A.一定温度下,反应MgCl2(l)Mg(l)+Cl2(g)的ΔH>0,ΔS<0
B.凡是放热反应都是自发的,凡是吸热反应都是非自发的
C.常温下,2H2O2H2↑+O2↑,即常温下水的分解反应是自发反应
D.已知2KClO3 (s) =2KCl(s) + 3O2(g) ΔH=﹣78.03 kJ·mol-1,ΔS=+ 494.4 J·mol-1·k-1,此反应在任何温度下都能自发进行
【答案】D
【详解】A.MgCl2(l)Mg(l)+Cl2(g),反应后物质的量增多,且生成了气体,△S>0,故A错误;
B.反应的自发性是由熵变和焓变共同决定的,若△H<0,△S>0,则一定自发,若△H>0,△S<0,则一定不能自发,若△H<0,△S<0或△H>0,△S>0,反应能否自发,和温度有关,故B错误;
C.水性质稳定,常温下,水不分解,常温下水的分解反应是不自发反应,故C错误;
D.氯酸钾的分解2KClO3(s)=2KCl(s)+3O2↑(g)△H<0,△S>0,根据△G=△H-T•△S<0一定成立,此反应在任何温度下都能自发进行,故D正确;
故选D。
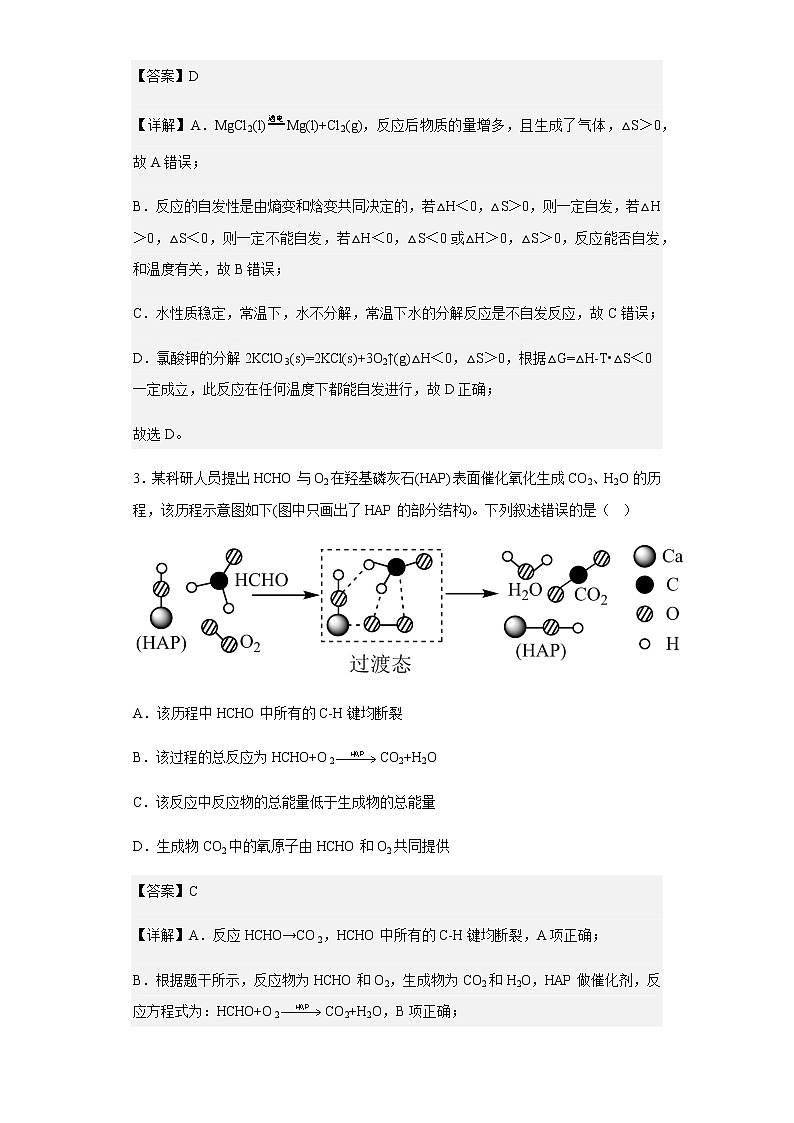
3.某科研人员提出HCHO与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程,该历程示意图如下(图中只画出了HAP的部分结构)。下列叙述错误的是( )
A.该历程中HCHO中所有的C-H键均断裂
B.该过程的总反应为HCHO+O2CO2+H2O
C.该反应中反应物的总能量低于生成物的总能量
D.生成物CO2中的氧原子由HCHO和O2共同提供
【答案】C
【详解】A.反应HCHO→CO2,HCHO中所有的C-H键均断裂,A项正确;
B.根据题干所示,反应物为HCHO和O2,生成物为CO2和H2O,HAP做催化剂,反应方程式为:HCHO+O2CO2+H2O,B项正确;
C.该反应与甲醛和氧气燃烧:HCHO+O2CO2+H2O能量变化大致相同,甲醛燃烧为放热反应,故题中反应也为放热反应,反应物的总能量高于生成物的总能量,C项错误;
D.根据图示反应时HCHO中C-H键均断裂,连接O2提供的一个O原子形成CO2,则生成物CO2中的氧原子由HCHO和O2共同提供,D项正确;
答案选C。
4.Burns和Dainton研究发现Cl2与CO合成COCl2的反应机理如下:
①Cl2(g)⇌2Cl•(g) 快
②CO(g)+Cl•(g)⇌COCl•(g) 快
③COCl•(g)+Cl2(g)⇌COCl2(g)+Cl•(g) 慢
反应②的速率方程为v正=k正c(CO)×c(Cl•),v逆=k逆c(COCl•)。下列说法错误的是
A.反应①的活化能大于反应③的活化能
B.反应②的平衡常数K=
C.要提高合成COCl2的速率,关键是提高反应③的速率
D.选择合适的催化剂能提高单位时间内COCl2的产率
【答案】A
【解析】根据有效碰撞理论,活化能越小,反应速率越大;催化剂降低反应的活化能,提高反应速率,但不改变反应最终的平衡产率。
【详解】A.活化能越小,反应速率越快,则反应①的活化能小于反应③的活化能,故A错误;
B.反应②存在v正=k正c(CO)×c(Cl•),v逆=k逆c(COCl•),平衡时正逆反应速率相等,,故B正确;
C.慢反应决定整个反应速率,要提高合成COCl2的速率,关键是提高反应③的速率,故C正确;
D.选择合适的催化剂加快化学反应速率,所以能提高单位时间内COCl2的产率,故D正确;
故选A。
5.常温下,现有pH=3的盐酸和醋酸溶液,下列说法正确的是
A.两种酸溶液中c(CH3COO-)=c(Cl-)
B.分别加水稀释10倍后溶液的pH均变为4
C.中和等物质的量的氢氧化钠,消耗酸的体积:盐酸<醋酸
D.等体积的两种酸溶液分别与足量的锌粒反应,产生气体的体积相等
【答案】A
【详解】A.盐酸和醋酸溶液中存在电离守恒,c(CH3COO-)+c(OH-)=c(H+),c(Cl-)+c(OH-)=c(H+),两者pH相同则两溶液的c(OH-)和c(H+)分别相等,则c(CH3COO-)=c(Cl-),故A正确;
B.盐酸是强酸,稀释10倍时,pH=4,醋酸是弱酸,存在电离平衡,稀释10倍时,电离平衡向右移动,pH小于4,故B错误;
C.相同pH的盐酸的浓度比醋酸的浓度小的多,中和等物质的量的氢氧化钠,消耗酸的体积:盐酸>醋酸,故C错误;
D.相同pH的盐酸的浓度比醋酸的浓度小的多,等体积的两种酸溶液分别与足量的锌粒反应,醋酸产生气体的体积多,故D错误;
故答案为A。
6.反应A→C分两步进行:①A→B,②B→C。反应过程能量变化曲线如图所示(E1、E2、E3、E4表示活化能)。下列说法错误的是
A.三种物质中B最不稳定 B.A→B反应的活化能为E1
C.B→C反应的ΔH=E4-E3 D.加入催化剂不能改变反应的焓变
【答案】C
【详解】A、A、B、C三种物质中,B的能量最高,所以B最不稳定,A正确;B、反应物A变成活化分子需吸收能量E1,所以A→B反应的活化能为E1,B正确;C、B的能量高于C的能量,所以B→C为放热反应,ΔH=-(E4-E3),C错误;D、催化剂不能改变反应的焓变,D正确。正确答案为C。
7.将1molCO和2molH2充入一容积为1L的密闭容器中,分别在250℃、T℃(T℃≠250℃)下发生反应:CO(g)+2H2(g)CH3OH(g);△H=akJ/mol,如图。下列分析中正确的是
A.250℃时,0~10minH2反应速率为0.015mol/(L•min)-1
B.平衡常数K:T℃时大于250℃
C.其他条件不变,若减小容积体积,CO体积分数增大
D.平衡时CO的转化率:T℃时小于250℃时
【答案】B
【详解】依据先拐先平的判断方法可知T<250℃,升高温度,甲醇物质的量减少,平衡逆移,所以正反应为放热反应,△H<0。
A.0~10min内甲醇物质的量增加了0.15mol,根据方程式氢气的变化量为:0.15mol×2=0.3mol,所以v(H2)==0.03 mol/(L•min),选项A错误;
B.根据上面分析可知a<0,即升高温度,平衡逆向移动,K减小,所以平衡常数K:T℃时大于250℃,选项B正确;
C.其他条件不变,若减小容积体积,压强增大,平衡正移,CO的物质的量减少,CO物质的量分数减小,所以CO体积分数减小,选项C错误;
D.A和B两条曲线,250℃时,先达化学平衡状态,250°C>T°C,温度越高,CO转化率越低,正反应放热,所以a<0,而且T<250℃,温度越低CO的转化率越大,所以CO的转化率:T℃时大于250℃时,选项D错误;
答案选B。
8.一定温度下,在3个1.0L的恒容密闭容器中分别进行反应,达到平衡。相关数据如表。下列说法不正确的是
容器
温度/K
物质的起始浓度/(mol∙L-1)
物质的平衡浓度/(mol∙L-1)
c(X)
c(Y)
c(Z)
c(Z)
I
400
0.20
0.10
0
0.080
II
400
0.40
0.20
0
a
III
500
0.20
0.10
0
0.025
A.平衡时,X的转化率:II>I B.平衡常数:K(Ⅱ)=K(Ⅰ)
C.达到平衡所需时间:III<I D.a=0.16
【答案】D
【详解】A.Ⅱ可以看成是向2L的容器中,充入0.4mol的X和0.2mol的Y(则Ⅰ、Ⅱ的平衡等效),平衡后再将容器压缩至1L,由于压强增大,平衡向右移动,所以Ⅱ中X的转化率>Ⅰ,A正确;
B.平衡常数只和温度有关,Ⅰ、Ⅱ的温度相同,则这两个平衡的平衡常数也相同,B正确;
C.Ⅲ的温度比Ⅰ高,Ⅲ的化学反应速率也快,则Ⅲ先达到平衡,所用时间较短,C正确;
D.结合选项A可知,Ⅱ平衡等效于Ⅰ的平衡增压后右移,则a>0.16,D错误;
故选D。
9.下列四图中,曲线变化情况与所给反应(a、b、c、d均大于0)相对应的是
A
B
C
D
2SO2(g)+O2(g)⇌2SO3(g) ∆H=-akJ/mol
N2(g)+3H2(g) ⇌2NH3(g) ∆H=-bkJ/mol
N2O4(g)⇌2NO2(g) ∆H=+ckJ/mol
CO2(g)+C(s) ⇌2CO(g) ∆H=+dkJ/mol
A.A B.B C.C D.D
【答案】C
【详解】A.依据先拐先平,温度高分析,图像中应该为高温下先达平衡,可是图象中先拐的为温度低的反应,不符合平衡建立的规律,故A错误;
B.反应是气体体积减小的放热反应,压强增大正逆反应速率增大,平衡正向进行,正反应速率大于逆反应速率,图象不符合,故B错误;
C.反应是气体体积增大的反应,增大压强平衡逆向进行,四氧化二氮物质的量分数增大,压强一定,温度越高平衡正向进行,四氧化二氮物质的量分数减小,图像符合变化特征,故C正确;
D.增大二氧化碳物质的量,相当于增大压强平衡逆向进行,二氧化碳转化率减小,故D错误;
故选C。
10.相同温度下,根据三种酸的电离常数,下列判断正确的是
酸
HX
HY
HZ
电离常数K
9×10-7
9×10-6
1×10-2
A.三种酸的强弱关系:HX>HY>HZ
B.反应HZ+Y-=HY+Z-不能发生
C.由电离常数可以判断:HZ属于强酸,HX和HY属于弱酸
D.相同温度下,1mol·L-1HX溶液的电离常数等于0.1mol·L-1HX溶液的电离常数
【答案】D
【详解】A.酸的电离常数越大,酸的电离程度越大,其酸性越强,根据表中数据可知,酸的电离常数:HZ>HY>HX,则酸性强弱关系:HZ>HY>HX,A错误;
B.根据酸性较强的酸可制取酸性较弱的酸可知HZ+Y-===HY+Z-能够发生,B错误;
C.在水溶液中完全电离的为强酸、部分电离的为弱酸,这几种酸都部分电离,均为弱酸,C错误;
D.电离常数只与温度有关,温度不变,电离常数不变,D正确;
故选:D。
11.一定条件下,相关有机物(均为气态)分别与氢气发生加成反应生成1mol气态环己烷的能量变化如图所示:
下列推理错误的是
A.碳碳双键加氢时放热,放出的热量与碳碳双键数目及相对位置有关
B.(g)+H2(g)→(g) △H=-21kJ·mol-1
C.∣△H2∣>∣△H3∣,说明单双键交替的两个碳碳双键间存在相互作用,有利于物质稳定
D.3∣△H1∣>∣△H4∣,说明苯分子中不存在三个完全独立的碳碳双键
【答案】B
【详解】A.由题干图示信息可知,、、、均小于0,则碳碳双键加氢时放热,由、、可知放出的热量与碳碳双键数目有关,由、可知放出的热量与双键的相对位置有关,A正确;
B.由题干图示可知,反应III为:(g)+2H2(g)=(g) =-229kJ/mol,反应IV: (g)+3H2(g)=(g) =-208kJ/mol,则反应(g)+H2(g)→(g) 可由反应IV-III得到,根据盖斯定律可知,△H=-=(-208kJ/mol)-(-229kJ/mol)=+21kJ·mol-1,B错误;
C.由题干图示信息可知,∣△H2∣>∣△H3∣,说明单双键交替的两个碳碳双键间存在相互作用,即具有的总能量比的更低,则有利于物质稳定,C正确;
D.由题干图示信息可知,3∣△H1∣>∣△H4∣,说明苯分子中不存在三个完全独立的碳碳双键,D正确;
故答案为:B。
二、多选题
12.某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO,其过程如下:
下列说法不正确的是
A.该过程中CeO2没有消耗 B.该过程实现了太阳能向化学能的转化
C.图中 D.的反应热小于
【答案】CD
【详解】A.通过太阳能实现总反应,反应中CeO2没有消耗,CeO2作催化剂,A正确;
B.该过程中在太阳能作用下将H2O、CO2转变为H2、CO,所以把太阳能转变成化学能,B正确;
C.由图中转化关系可知:,C不正确;
D.①(1);②,根据盖斯定律①+②得:;因大于0,故,D不正确;
故选CD。
13.CH4与CO2重整生成H2和CO的过程中主要发生下列反应
在恒压、反应物起始物质的量比条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是
A.升高温度、增大压强均有利于提高CH4的平衡转化率
B.曲线B表示CH4的平衡转化率随温度的变化
C.相同条件下,改用高效催化剂能使曲线A和曲线B相重叠
D.恒压、800K、n(CH4):n(CO2)=1:1条件下,反应至CH4转化率达到X点的值,改变除温度外的特定条件继续反应,CH4转化率能达到Y点的值
【答案】BD
【详解】A.甲烷和二氧化碳反应是吸热反应,升高温度,平衡向吸热反应即正向移动,甲烷转化率增大,甲烷和二氧化碳反应是体积增大的反应,增大压强,平衡逆向移动,甲烷转化率减小,故A错误;
B.根据两个反应得到总反应为CH4(g)+2CO2(g) H2(g)+3CO(g) +H2O (g),加入的CH4与CO2物质的量相等,CO2消耗量大于CH4,因此CO2的转化率大于CH4,因此曲线B表示CH4的平衡转化率随温度变化,故B正确;
C.使用高效催化剂,只能提高反应速率,但不能改变平衡转化率,故C错误;
D.800K时甲烷的转化率为X点,可以通过改变二氧化碳的量来提高甲烷的转化率达到Y点的值,故D正确。
综上所述,答案为BD。
14.中国科学院化学研究所报道了化合物1催化CO2氢化机理。其机理中化合物1(催化剂,固态)→化合物2(中间产物,固态)的过程和其相对能量曲线如下图所示。下列说法错误的是
A.化合物1与CO2反应生成化合物2的过程中有两个过渡态TS11-2、TS21-2,说明这一过程包含两个基元反应
B.图中Ⅰl-2与化合物2互为同分异构体
C.过程①的活化能高于过程②的活化能
D.过程①的热化学方程式为:I(s)+CO2(g)=I1-2 (s) △H=2.08 kJ·mol-1
【答案】CD
【详解】A.由相对能量曲线可知,化合物1与CO2反应生成化合物2的过程中有两个过渡态TS11-2、TS21-2,说明这一过程包含两个基元反应,故A正确;
B.图中Ⅰl-2与化合物2的化学式相同,结构式不同,互为同分异构体,故B正确;
C.过程①的活化能为:(6.05-0.00)=6.05kcal·mol-1,②的活化能为:(11.28-2.08)=9.20 kcal·mol-1,过程①的活化能小于过程②的活化能,故C错误;
D.过程①的热化学方程式为:I(s)+CO2(g)=I1-2 (s) △H=2.08 kcal·mol-1,故D错误;
故选CD。
三、原理综合题
15.二甲醚(DME)被誉为“21世纪的清洁燃料”,由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g)CH3OH(g) ΔH1=-90.7kJ·mol-1 K1
②2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1 K2
③CO(g)+H2O(g)CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 K3
回答下列问题:
(1)反应3H2(g)+3CO(g)CH3OCH3(g)+CO2(g)的ΔH=___________kJ·mol-1;该反应的平衡常数K=___________(用K1、K2、K3表示)。
(2)下列措施中,能提高①中CH3OH产率的有___________。
A.使用过量的CO B.升高温度 C.增大压强 D.使用催化剂
(3)一定温度下,将0.2mol CO和0.1mol H2O(g)通入2L恒容密闭容器中,发生反应③,5min后达到化学平衡,平衡后测得H2的体积分数为0.1,则0~5min内v(H2O)=___________,CO的转化率α(CO)=___________。
(4)将合成气以=2通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)CH3OCH3(g)+H2O(g) ΔH,其中CO的平衡转化率随温度、压强的变化关系如图所示,下列说法正确的是___________(填字母)。
A.ΔH<0
B.p1>p2>p3
C.若在p3和316℃时,起始时=3,则平衡时,α(CO)小于50%
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(DME)。观察图,当约为___________时最有利于二甲醚的合成。
【答案】(1) -246.1 K12·K2·K3
(2)AC
(3) 0.003mol·L-1·min-1 15%
(4)AB
(5)2.0
【解析】(1)
根据盖斯定律,因此有ΔH=①+②+③,则ΔH=2×ΔH1+ΔH2+ΔH3=-246.1kJ·mol-1,根据化学平衡常数的数学表达式,得出、、、,从而推出K=K12·K2·K3。
(2)
A.使用过量的CO,c(CO)增大,平衡向正反应方向移动,CH3OH产率增加,故A符合题意;
B.该反应为放热反应,升高温度,平衡向逆反应方向移动,CH3OH产率降低,故B不符合题意;
C.反应前的气体系数之和大于反应后气体系数,增大压强,平衡向正反应方向移动,CH3OH的产率增大,故C符合题意;
D.使用催化剂,只能改变反应达到平衡的时间,不影响平衡的移动,使用催化剂不影响CH3OH产率,故D不符合题意;
答案为AC。
(3)
反应③中反应前后气体系数之和相等,即反应前后气体物质的量保持不变,达到平衡后H2的物质的量为0.3mol×0.1=0.03mol,此时消耗H2O的物质的量为0.03mol,0~5min内,v(H2O)==0.003mol·L-1·min-1;0~5min内,消耗n(CO)=0.03mol,CO的转化率为=15%。
(4)
A.根据图像,随着温度的升高,CO的平衡转化率减小,说明升高温度,平衡向逆反应方向进行,根据勒夏特列原理,该反应的正反应方向为放热反应,即ΔH<0,故A正确;
B.作等温线,根据勒夏特列原理,根据化学计量数,增大压强,反应向正反应方向进行,CO的转化率增大,从而推出p1>p2>p3,故B正确;
C.=3,相当于在=2基础上通入H2,通入H2,反应向正反应方向进行,CO的转化率增大,CO的转化率大于50%,故C错误;
答案为AB。
(5)
根据图,约为2时,CO的转化率最大,DME的选择性最高,此时最有利于二甲醚的合成。
16.I.磷能形成多种含氧酸。
(1)次磷酸(H3PO2)是一种精细化工产品,向10mLH3PO2溶液中加入等物质的量浓度的NaOH溶液后,所得的溶液中只有两种阴离子。
①写出H3PO2溶液与足量NaOH溶液反应后形成的正盐的化学式:_______。
②常温下,,0.1mol/L的H3PO2溶液在加水稀释过程中,下列表达式的数据一定变小的是_______(填标号)。
A.c(H+) B. C.
(2)亚磷酸(H3PO3)是二元中强酸,25℃时亚磷酸的电离常数为。试从电离平衡移动的角度解释数据的差异:_______。
(3)25℃时,HF的电离常数为;H3PO4的电离常数为,,。足量溶液和H3PO4溶液反应的离子方程式为_______。
(4)①相同温度下,等物质的量浓度的上述三种磷的含氧酸中,c(H+)由大到小的顺序为_______(用酸的分子式表示)。
②已知:,则溶液与足量0.1mol/LNaOH溶液反应生成1molH2O(l)放出的热量为_______(填标号)。
A.=57.3kJ B.<57.3kJ C.>57.3kJ D.无法确定
II.已知25℃时水溶液呈弱碱性:;。
(5)25℃时,向N2H4水溶液中加入H2SO4,欲使,同时,应控制溶液中c(OH-)的范围为_______(用含a、b式子表示)。
【答案】(1) NaH2PO2 AB
(2)H3PO3第一步电离出的H+对第二步电离起到抑制作用
(3)
(4) B
(5)
【解析】(1)
①向10mLH3PO2溶液中加入等物质的量浓度的NaOH溶液后,所得的溶液中只有两种阴离子,则表明H3PO2为一元酸,H3PO2与NaOH反应只能生成正盐,正盐的化学式:NaH2PO2。
②常温下,,则H3PO2为弱酸,0.1mol/L的H3PO2溶液在加水稀释过程中,H3PO2的浓度不断减小。
A.随着溶液浓度的不断减小,尽管H3PO2的电离程度不断增大,但c(H+)仍然不断减小,A符合题意;
B.Ka不变,c()不断减小,所以=不断减小,B符合题意;
C.=Ka(H3PO2),温度不变时,Ka(H3PO2)不变,C不符合题意;
故选AB。答案为:NaH2PO2;AB;
(2)
H3PO3H++、H++,25℃时亚磷酸的电离常数为。从电离方程式可以看出,两步电离都产生H+,则第一步电离产生的H+必然抑制第二步电离,所以数据的差异较大的原因:H3PO3第一步电离出的H+对第二步电离起到抑制作用。答案为:H3PO3第一步电离出的H+对第二步电离起到抑制作用;
(3)
因为K2(H3PO4)<K(HF)<K1(H3PO4),所以足量NaF溶液和H3PO4溶液反应时,H3PO4只能电离出1个H+,则离子方程式为。答案为:;
(4)
①相同温度下,等物质的量浓度的三种磷的含氧酸中,第一步电离常数,则c(H+)由大到小的顺序为。
②,因为H3PO4是弱酸,电离时需要吸收热量,所以0.1mol/L H3PO4溶液与足量0.1mol/LNaOH溶液反应生成1molH2O(l)时,放出的热量<57.3kJ,故选B。答案为:;B;
(5)
II.已知25℃时水溶液呈弱碱性:;。
25℃时,向N2H4水溶液中加入H2SO4,,则c(OH-)=<10-a;,则c(OH-)=>10-b;所以溶液中c(OH-)的范围为。答案为:。
【点睛】酸的电离常数越大,相同浓度时电离能力越强。
四、填空题
17.硫酸在工业生产中有着重要的意义,是工业制硫酸的重要原料。
(1)T℃时,向2.0L的恒容密闭容器中充入和,发生如下反应:
①20s后反应达到平衡,和相等,___________,平衡后向容器中再充入和,此时,v(正)___________v(逆)。(填“>”、“=”或“<”)
②相同温度下,起始投料变为和,的平衡转化率___________。(填“增大”、“不变”或“减小”)
(2)密闭容器中,加入足量的焦炭(沸点4827℃)和反应,生成和硫蒸气()。
①反应在某温度达到平衡时,和的体积分数都等于40%,中x=___________。
②按相同投料方式发生上述反应,相同时间内测得与的生成速率随温度变化的关系如图1所示。其它条件相同时,在不同催化剂作用下,转化率与温度关系如图2所示。
700℃时,催化剂___________(填“甲”或“乙”)活性更高,A、B、C三点对应的反应状态中,达到平衡状态的是___________(填字母)。
【答案】(1) 0.02 > 减小
(2) 2 乙 B
【解析】(1)
①根据三段式可知
20s后反应达到平衡,和相等,则0.5-2x=0.3-x,解得x=0.2,所以0.4mol/L÷20s=0.02,平衡常数为。平衡后向容器中再充入和,此时浓度熵为,平衡正向进行,则v(正)>v(逆)。
②相同温度下,起始投料变为和,相当于是减小压强,平衡逆向进行,则的平衡转化率减小。
(2)
①根据三段式可知
反应在某温度达到平衡时,和的体积分数都等于40%,即1-y=y,解得y=0.5,,解得x=2。
②700℃时,催化剂乙对应的转化率高,因此催化剂乙的活性更高,由于催化剂不能改变平衡转化率,所以C点不是平衡点,又因为A点二者的速率相等,不满足速率之比是化学计量数之比,而B点二氧化硫和硫蒸汽的速率之比是2:1,满足速率之比是化学计量数之比,所以A、B、C三点对应的反应状态中,达到平衡状态的是B。
五、工业流程题
18.亚氯酸钠是一种高效含氯消毒剂和漂白剂。下图为制备亚氯酸钠的装置图(夹持装置省略)。
已知:NaClO2饱和溶液在低于38℃时会析出,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
请回答下列问题:
(1)装置A中装稀硫酸的仪器名称为_______,用装置A来制取ClO2,发生反应的离子方程式为_______。
(2)装置B的作用是_______。
(3)研究测得C装置吸收液中对粗产品中NaClO2含量的影响如下图所示。则最佳条件为_______,_______。
(4)装置C中生成NaClO2的反应,n(氧化剂):n(还原剂)=_______;装置C采用“冰水浴”防止温度过高的目的是_______。
(5)充分反应后,为从产品溶液中获取NaClO2晶体,从下列选项中选出合理的操作并排序:_______→_______→_______→干燥(填标号)。
a.趁热过滤 b.50℃水洗涤 c.加热蒸发结晶 d.冰水洗涤 e.55℃恒温减压蒸发结晶
【答案】(1) 分液漏斗
(2)防止倒吸
(3) 4 0.8
(4) 2:1 防止NaClO2分解成NaClO3和NaCl,同时防止分解加快
(5) e a b
【分析】装置A用H2O2与NaClO3发生氧化还原反应来制取ClO2,装置B用作安全瓶,生成的与装置C中的和反应制得,装置D用来处理尾气,防止污染空气。
(1)
装置A中装稀硫酸的仪器名称为分液漏斗;装置A中反应的离子方程式为
(2)
由图可知,装置B的作用是防止倒吸,起到安全瓶的作用。
(3)
由图像所示信息可知,的浓度由增大到时对的含量没有影响,所以最佳条件为由0.8到0.9对的含量没有影响。所以。
(4)
装置C中发生反应:,其中是氧化剂,是还原剂,则氧化剂和还原剂的物质的量之比为;由已知信息可知,饱和溶液在低于时会析出,高于时析出,高于时分解成和,同时受热分解加快,所以装置C采取“冰水浴”防止温度过高的目的是防止分解成和,同时防止分解加快。
(5)
由分析可知,充分反应后,为从产品溶液中获取晶体,合理的操作顺序为恒温减压蒸发结晶趁热过滤水洗涤干燥。
湖南省长郡中学2021-2022学年高二上学期期末考试化学试题 Word版含解析: 这是一份湖南省长郡中学2021-2022学年高二上学期期末考试化学试题 Word版含解析,共31页。试卷主要包含了5 K~39 Fe~56, 下列说法正确的是等内容,欢迎下载使用。
2022-2023学年湖南省长沙市雅礼中学高二上学期第一次月考化学试题含解析: 这是一份2022-2023学年湖南省长沙市雅礼中学高二上学期第一次月考化学试题含解析,共26页。试卷主要包含了单选题,多选题,原理综合题,填空题,实验题等内容,欢迎下载使用。
2022-2023学年湖南省长郡中学高一上学期第一次月考化学试题含解析: 这是一份2022-2023学年湖南省长郡中学高一上学期第一次月考化学试题含解析,共18页。试卷主要包含了单选题,多选题,填空题,实验题等内容,欢迎下载使用。












