





鲁科版高考化学一轮复习第5单元原子结构与元素周期律第3节化学键与化学反应课件
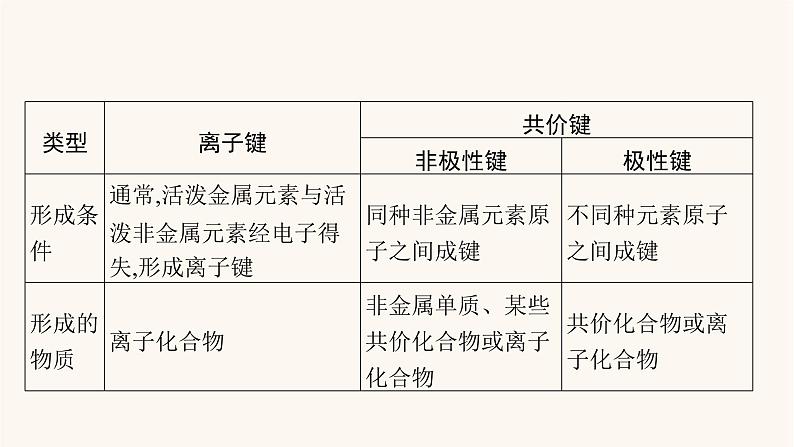
展开第五单元2022必备知识 自主预诊 知识梳理1.化学键(1)化学键的定义及分类。(2)化学反应的本质:反应物中旧化学键的断裂与生成物中新化学键的形成。2.离子键、共价键的比较 3.电子式(1)电子式定义。在元素符号周围用“·”或“×”表示原子 的式子。 (2)书写方法。最外层电子 (3)用电子式表示化合物的形成过程。①离子化合物:左边是原子的电子式,右边是离子化合物的电子式,中间用“→”连接,用弧形箭头标出电子转移的方向,相同的原子或离子不能合并。如NaCl的形成过程: ②共价化合物:左边是原子的电子式,右边是共价化合物的电子式,中间用“→”连接,相同的原子不能合并。如HCl的形成过程: 4.化学键与物质类别的关系 微点拨 化学键对物质性质的影响(1)对物质物理性质的影响。金刚石、晶体硅、石英、金刚砂等物质的硬度大、熔点高,就是因为其中的共价键很强,破坏时需消耗很多的能量。NaCl等部分离子化合物中也有很强的离子键,故其熔点也较高。(2)对物质化学性质的影响。N2分子中有很强的共价键,故在通常状况下,N2很稳定,H2S、HI等分子中的共价键较弱,故它们受热时易分解。5.分子间作用力(1)定义:把分子聚集在一起的作用力,又称范德华力。(2)特点:分子间作用力比化学键弱得多,它主要影响物质的熔点、沸点、溶解性等物理性质,而化学键主要影响物质的化学性质。(3)规律:一般来说,对于组成与结构相似的物质,相对分子质量 ,分子间作用力越大,物质的熔点、沸点也越高。例如熔点、沸点:I2>Br2>Cl2>F2。 越大 6.氢键(1)定义:分子间存在的一种比分子间作用力稍强的相互作用。(2)形成条件:除H外,形成氢键的原子通常是 。 (3)存在:氢键存在广泛,如蛋白质、醇、羧酸、H2O、NH3、HF等含H—F、H—N、H—O键的分子间(某些较复杂的有机物分子内也可以形成氢键)。分子间氢键会使物质的熔点和沸点升高。N、O、F 微点拨 (1)离子键中的“静电作用”既包括静电吸引力又包括静电排斥力。 (2)由活泼金属与活泼非金属形成的化学键不一定都是离子键,如AlCl3中Al—Cl键为共价键。 (3)非金属元素的两个原子之间一定形成共价键,但只由非金属元素形成的含有原子团的某些物质中也可能存在离子键,如NH4Cl、(NH4)2SO4、NH4NO3等。 (4)化学反应的本质是旧化学键的断裂和新化学键的形成,只有化学键的断裂不一定是化学变化,如熔融NaCl、粉碎石灰石等。(5)强碱、绝大多数盐、活泼金属氧化物及其过氧化物中存在离子键,这些物质都为离子化合物。(6)离子化合物溶于水或熔化后均电离出自由移动的阴、阳离子,离子键被破坏;共价化合物在熔融条件时不电离,所以,熔融状态时能导电的化合物一定是离子化合物。自我诊断1.判断正误,正确的打“√”,错误的打“×”。(1)化学键是相邻离子或原子间的强烈的作用力,既包括静电吸引力,又包括静电排斥力。( )(2)所有物质中都存在化学键。( )(3)由活泼金属元素与活泼非金属元素形成的化学键都是离子键。( )(4)原子最外层只有一个电子的元素原子跟卤素原子结合时,所形成的化学键一定是离子键。( )(5)非金属元素的两个原子之间形成的一定是共价键,但多个原子间也可能形成离子键。( )(6)离子化合物中可能含有共价键,共价化合物中一定不含离子键。( )答案 (1)√ (2)× (3)× (4)× (5)√ (6)√ 2.写出下列常见微粒的电子式。(1)原子:Na ,Cl 。 (2)简单离子:Na+ ,F- 。 (3)复杂离子:N ,OH- 。 (4)离子化合物:CaCl2 , Na2O 。 (5)含共价键的分子:N2 ,H2O ,CO2 ,HClO ,CCl4 ,H2O2 ,NH3 。 关键能力 考向突破 考向1 电子式、结构式的书写与判断【典例1】 用化学用语表示NH3+ HCl==NH4Cl中的相关微粒,其中正确的是( )答案 C 对点演练1下列电子式正确的是( ) 答案 C 误区警示 电子式书写的四个误区 考向2 物质类别与化学键类型的判断【典例2】 (2020山东烟台一中月考)下列各组物质中都既含有离子键又含有共价键的是( )A.NaOH、CaCl2、NH4Cl B.KOH、Na2O2、(NH4)2SC.MgO、CaBr2、NaCl D.Na2SO4、HCl、MgCl2答案 B 解析 既含有离子键又含有共价键的化合物肯定是离子化合物。A项,CaCl2中只含离子键;C项,MgO、CaBr2、NaCl三种物质中都只含离子键,无共价键;D项,HCl中只含共价键,MgCl2中只含离子键。对点演练2下列关于NaHSO4的说法正确的是( )A.因为NaHSO4是离子化合物,所以NaHSO4固体能够导电B.NaHSO4固体中阳离子和阴离子的个数比是2∶1C.NaHSO4固体熔融时破坏的是离子键和共价键D.NaHSO4固体溶于水时破坏的是离子键和共价键答案 D 解析 虽然NaHSO4是离子化合物,但其固体中不存在能自由移动的阴离子和阳离子,因而不能导电;NaHSO4固体中阳离子(Na+)和阴离子(HS )的个数比是1∶1;NaHSO4固体熔融时破坏的只是离子键,而溶于水时电离出Na+、H+和S ,破坏的是离子键和共价键。规律方法1.判断离子化合物和共价化合物的三种方法2.物质所含化学键类型的判断方法 考向3 化学反应中化学键的断裂与形成【典例3】 (2020黑龙江哈师大附中期中)下列过程中共价键被破坏的是( )①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水 ⑤冰融化 ⑥NH4Cl受热 ⑦氢氧化钠熔化 ⑧(NH4)2SO4溶于水A.④⑥ B.④⑥⑧C.①②④⑤ D.①④⑥⑦答案 A 解析 ①碘升华破坏的是分子间作用力;②溴蒸气被木炭吸附不会破坏共价键;③酒精是非电解质,溶于水不发生电离,破坏的是分子间作用力;④HCl气体溶于水,发生电离,HCl中的共价键被破坏;⑤冰融化不会破坏共价键;⑥NH4Cl受热分解,发生化学变化,生成氨气和HCl,有共价键被破坏;⑦氢氧化钠熔化时只有离子键被破坏;⑧(NH4)2SO4溶于水发生电离,离子键被破坏。综上所述,④⑥符合题意,A项正确。对点演练3在下列变化过程中,既有离子键被破坏又有共价键被破坏的是( )A.将SO2通入水中 B.烧碱溶于水C.将HCl通入水中 D.硫酸氢钠溶于水答案 D 归纳总结 物质的溶解或熔化与化学键变化(1)离子化合物的溶解或熔化过程。离子化合物溶于水或熔化后会电离成自由移动的阴离子、阳离子,离子键被破坏。(2)共价化合物的溶解过程。①有些共价化合物溶于水后,能与水反应,其分子内共价键被破坏,如CO2和SO2等。②有些共价化合物溶于水后,与水分子作用形成水合离子,从而发生电离,形成阴离子、阳离子,其分子内的共价键被破坏,如HCl、H2SO4等。③有些共价化合物溶于水后,其分子内的共价键不被破坏,如蔗糖(C12H22O11)、酒精(C2H5OH)等。(3)单质的溶解过程。某些活泼的非金属单质溶于水后,能与水反应,其分子内的共价键被破坏,如Cl2、F2等。必备知识 自主预诊 知识梳理1.化学键与化学反应的关系吸热 E1 E2 > 放热 E1 E2 <(1)并不是所有物质中都存在化学键,如稀有气体分子是单原子分子,分子中无化学键。(2)有化学键变化的不一定是化学变化。如NaCl晶体从溶液中析出只有化学键的形成,没有化学键的断裂,HCl溶于水电离成H+和Cl-等,只有旧化学键的断裂没有新化学键的形成,二者都没有发生化学变化。2.化学键与物质类别的关系(1)存在离子键的化合物 是离子化合物。 (2)离子化合物中 存在离子键, 存在共价键,如NaOH、Na2O2、(NH4)2SO4等。 (3)共价化合物中只有共价键, 离子键。 (4)含有共价键的化合物 是共价化合物,如NH4Cl、NaOH、Na2O2等。 (5)全部由非金属元素组成的化合物也可能是离子化合物,如NH4Cl、NH4NO3等铵盐,铵根离子和酸根离子之间以离子键结合。由金属元素和非金属元素形成的化合物也可能是共价化合物,如AlCl3。全部 一定可能没有不一定3.离子化合物与共价化合物比较 离子键 碱绝大多数盐活泼金属的氧化物过氧化物共价键4.化学键与物质性质的关系(1)对物理性质的影响:①NaCl、KOH等离子化合物中阴、阳离子间通过较强的 结合,将其粉碎或熔化需克服离子键,故硬度较 ,熔、沸点 。 ②CO2、H2O2、H2SO4、HF、I2等由分子构成的物质,分子之间 存在化学键,故熔、沸点较 。 ③C(金刚石)、Si、SiO2等由原子构成的物质,各原子之间通过 结合形成 结构,在将其粉碎或熔化时需克服原子之间的 ,故该类物质熔、沸点 ,硬度 。 离子键大较高不低共价键 立体网状共价键 很高很大(2)对化学性质的影响:N2分子中有很强的 ,故在通常状况下,N2很稳定,H2S、HI等分子中的 较弱,故它们受热时易分解。 共价键 共价键 自我诊断1.所有的物质中都含有化学键吗?提示 稀有气体元素的单质中不存在化学键。 2.判断正误,正确的打“√”,错误的打“×”。(1)1 mol KHSO4加热熔化可电离出2NA个阳离子( )(2)共价化合物溶于水,分子内共价键被破坏,单质溶于水,分子内共价键不被破坏( )(3)共价化合物熔点都低于离子化合物( )(4)分子内共价键越强,分子越稳定,其熔、沸点也越高( )(5)含有阳离子的化合物一定含有阴离子( )(6)含有离子键的物质不可能是单质( )答案 (1)× (2)× (3)× (4)× (5)× (6)√ 考向 化学键与化学反应【典例1】 下列有关化学键的叙述正确的是( )①化学键被破坏的变化,一定是化学变化②化学键被破坏的变化,不一定是化学变化③只要是化学变化一定有新化学键的形成④化学变化与化学键的断裂与形成没有必然的联系A.①③ B.②③C.②④ D.①④关键能力 考向突破 答案 B 解析 化学键被破坏的变化不一定是化学变化,如NaCl、金刚石的受热熔化,NaCl溶于水等;只有旧化学键的断裂而没有新化学键的形成,不是化学变化;只要是化学变化一定有旧化学键的断裂和新化学键的形成而且生成新的物质,故②③正确。【典例2】 室温下单质碘为固体,单质氯为气体。尽管两者存在的状态不同,但两者( )A.均含离子键B.都含离子键和共价键C.均含共价键D.均可与H2形成离子化合物答案C 解析单质碘与单质氯均只含共价键,二者与H2反应生成的化合物均为共价化合物。归纳总结物质变化与化学键变化 对点演练1下列说法中正确的是( )A.KOH中含有离子键也含有共价键,属于离子化合物B.N2属于单质,不存在化学键C.MgCl2中既含有离子键,又含有共价键D.NH4Cl中含有共价键,又全部由非金属元素组成,属于共价化合物答案A 解析 KOH中既含离子键,也有共价键,属于离子化合物,A正确;N2中含有共价键,B错误;MgCl2中不含共价键,C错误;NH4Cl属于离子化合物,D错误。对点演练2某元素的原子最外层只有一个电子,其原子与卤素原子结合时,所形成的化学键( )A.一定是离子键B.一定是共价键C.可能是离子键也可能是共价键D.以上说法都不正确答案C 解析 Na、H两种元素的原子最外层都只有一个电子,Na与Cl形成的化合物中含离子键,H与Cl形成的化合物中含共价键。网络构建化学键 核心速记1.化学反应的本质是旧键断裂,新键形成。2.化学反应中的物质变化和能量变化: 吸收能量E1 ↓反应物 反应产物 ↓ 释放能量E2E1>E2 反应吸收能量E1
2024年高考化学一轮复习课件(鲁科版)第5章 第28讲 化学键: 这是一份2024年高考化学一轮复习课件(鲁科版)第5章 第28讲 化学键,文件包含第5章第28讲化学键pptx、第5章第28练化学键docx、第5章第28讲化学键docx等3份课件配套教学资源,其中PPT共58页, 欢迎下载使用。
鲁科版高考化学一轮复习第5单元原子结构与元素周期律第2节元素周期律和元素周期表课件: 这是一份鲁科版高考化学一轮复习第5单元原子结构与元素周期律第2节元素周期律和元素周期表课件
鲁科版高考化学一轮复习第5单元原子结构与元素周期律第1节原子结构课件: 这是一份鲁科版高考化学一轮复习第5单元原子结构与元素周期律第1节原子结构课件












