





2024年高考化学一轮复习课件(鲁科版)第5章 第28讲 化学键
展开第28讲 化学键
[复习目标] 1.了解化学键的定义,了解离子键、共价键的形成。2.了解共价键的类型及键参数。
考点一 化学键与化合物类型 电子式
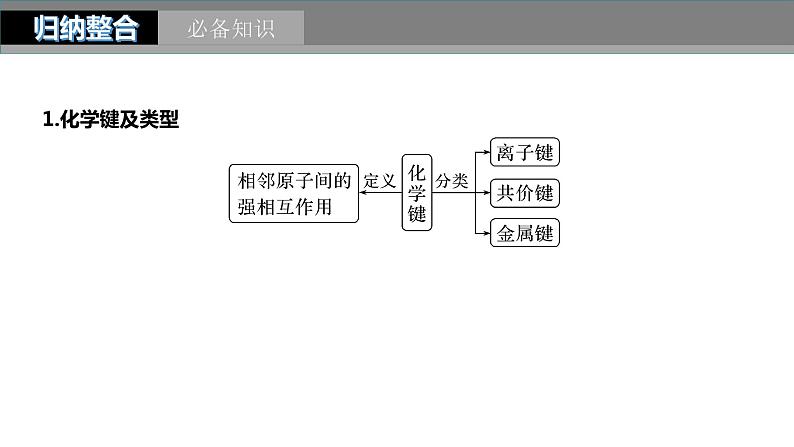
1.化学键及类型
2.三种化学键的比较
化学键 | 离子键 | 共价键 | 金属键 |
形成 | ___________________形成 | 原子间通过______形成 | 金属阳离子与自由电子间的强的作用 |
特征 | ____方向性、饱和性 | ____方向性、饱和性 | ____方向性、饱和性 |
表示方式(电子式) | — | ||
强弱比较 | 阴阳离子________、离子所带____________________ | ______和______ | 金属离子________及______________________________________________________ |
存在 | 离子化合物(离子晶体) | 单质(稀有气体除外)、共价化合物、部分离子化合物 | 金属单质、合金 |
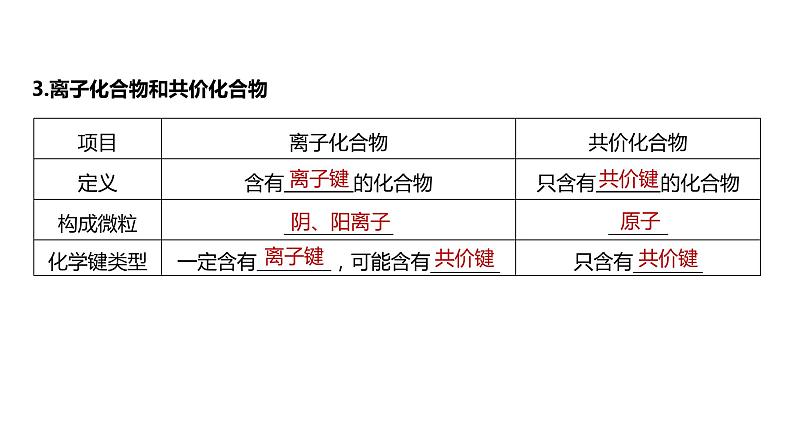
3.离子化合物和共价化合物
项目 | 离子化合物 | 共价化合物 |
定义 | 含有________的化合物 | 只含有________的化合物 |
构成微粒 |
|
|
化学键类型 | 一定含有______,可能含有______ | 只含有________ |
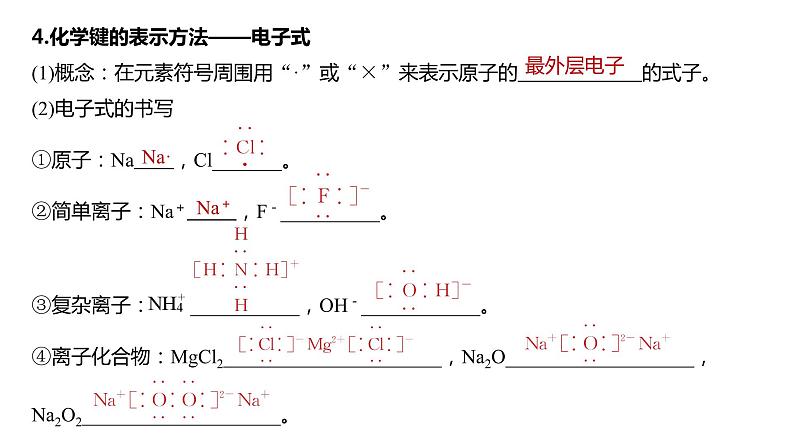
4.化学键的表示方法——电子式
(1)概念:在元素符号周围用“·”或“×”来表示原子的____________的式子。
(2)电子式的书写
①原子:Na ______,Cl ________。
②简单离子:Na+ ______,F- ________。
③复杂离子:NH______________________________________________________________,
OH-__________________________________________________________________________。
④离子化合物:MgCl2___________________________________________________________,
Na2O__________________________________________________________________________,
Na2O2_________________________________________________________________________。
⑤非金属单质及共价化合物:N2__________________________________________________,
H2O ____________,H2O2 ________________________________________________________。
(3)用电子式表示化合物的形成过程
①离子化合物
如NaCl:_____________________________________________________________________。
②共价化合物
如HCl:。
一、化学键与物质类别的关系
1.一定条件下,氨与氟气发生反应:4NH3+3F2===NF3+3NH4F,其中NF3的空间结构与NH3相似。下列有关说法错误的是( )
A.除F2单质外,反应物和生成物均为共价化合物
B.NF3中各原子均满足8电子稳定结构
C.NF3中只含极性共价键
D.NH4F中既含有离子键又含有共价键
2.现有下列物质:①NaCl ②Na2O ③Na2O2 ④NaOH ⑤AlCl3 ⑥H2O ⑦N2 ⑧NH4Cl
⑨CO2 ⑩H2O2
(1)只含离子键的物质有________(填序号,下同),只含共价键的物质有__________。
(2)属于离子化合物的有__________,其中含非极性键的离子化合物有__________,含有非极性键的共价化合物有__________。
判断离子化合物和共价化合物的三种方法
二、电子式的规范书写
3.判断下列电子式书写是否正确
(1)氮气,N⋮⋮N( );氨气,( )
(2)氯化钠,( );HF,( )
(3)过氧化氢,( );次氯酸,( )
(4)CaBr2,( );CaC2, ( )
4.写出下列微粒的电子式。
(1)—OH______________________________________________________________________,
H3O+_________________________________________________________________________。
(2)H2S________________________________________________________________________,
N2H4_________________________________________________________________________。
(3)NaH________________________________________________________________________,
NaBH4________________________________________________________________________。
考点二 共价键及其参数
1.共价键的本质及特征
共价键是原子间通过____________形成的化学键,其特征是具有________和________。
2.分类
分类依据 |
| 类型 |
形成共价键的原子轨道重叠方式 | ____键 | 轨道“________”重叠 |
____键 | 轨道“________”重叠 | |
形成共价键的电子对是否偏移 | ________键 | 共用电子对__________偏移 |
________键 | 共用电子对__________偏移 | |
原子间共用电子对的数目 | ____键 | 原子间有______共用电子对 |
____键 | 原子间有______共用电子对 | |
____键 | 原子间有______共用电子对 |
3.键参数
(1)概念
(2)键参数对分子性质的影响
①键能越____,键长越____,分子越稳定。
②
1.共价键的成键原子只能是非金属原子( )
2.在任何情况下,都是σ键比π键强度大( )
3.σ键能单独形成,而π键一定不能单独形成( )
4.σ键可以绕键轴旋转,π键一定不能绕键轴旋转( )
5.碳碳三键和碳碳双键的键能分别是碳碳单键键能的3倍和2倍( )
6.分子的稳定性与分子间作用力的大小无关( )
一、共价键的类型及数目判断
1.分析下列物质中含有哪些不同类型的共价键,在对应的空格处打“√”(σ键、π键需填写1 mol该物质所含σ键、π键的物质的量)。
物质 | 极性键 | 非极性键 | σ键 | π键 | 单键 | 双键 | 三键 |
N2 |
|
|
|
|
|
|
|
C2H4 |
|
|
|
|
|
|
|
SiO2 |
|
|
|
|
|
|
|
BF3 |
|
|
|
|
|
|
|
HCN |
|
|
|
|
|
|
|
二、键能、键长与物质稳定性
2.Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是______________________________________________
______________________________________________________________________________。
3.硅是重要的半导体材料,构成了现代电子工业的基础。碳和硅的有关化学键键能如表所示,简要分析和解释下列有关事实:
化学键 | C—C | C—H | C—O | Si—Si | Si—H | Si—O |
键能/ (kJ·mol-1) | 365 | 413 | 336 | 226 | 318 | 452 |
(1)硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是
______________________________________________________________________________
______________________________________________________________________________。
(2)SiH4的稳定性小于CH4,更易生成氧化物,原因是________________________________
______________________________________________________________________________。
1.正误判断,正确的打“√”,错误的打“×”。
(1)钠与N、O、Cl分别形成的化合物中只含有离子键(2018·全国卷Ⅱ,10B改编)( )
(2)1 mol乙烷和1 mol乙烯中,化学键数相同(2018·全国卷Ⅲ,8D)( )
(3)Na2O2与ClO2均含有非极性共价键(2018·全国卷Ⅲ,13C改编)( )
(4)氢元素与其他元素可形成共价化合物或离子化合物(2017·天津,5B)( )
(5)甲基的电子式:(2020·浙江7月选考,5D)( )
(6)B3N3H6(无机苯)的结构与苯类似,也有大π键。B3N3H6的熔点主要取决于所含化学键的键能 (2020·山东,7A)( )
(7)键能C—C>Si—Si、C—H>Si—H,因此C2H6稳定性大于Si2H6(2020·山东,4A)( )
(8)28 g C2H4分子中含有的σ键数目为4NA( 2022·辽宁,3B)( )
2. (2022·北京,9)由键能数据大小,不能解释下列事实的是( )
化学键 | C—H | Si—H | C==O | C—O | Si—O | C—C | Si—Si |
键能/ (kJ·mol-1) | 411 | 318 | 799 | 358 | 452 | 346 | 222 |
A.稳定性:CH4>SiH4
B.键长:C==O<C—O
C.熔点:CO2<SiO2
D.硬度:金刚石>晶体硅
3.[2020·浙江7月选考,26(1)(2)](1)气态氢化物热稳定性HF大于HCl的主要原因是______________________________________________________________________________
______________________________________________________________________________。
(2)CaCN2是离子化合物,各原子均满足8电子稳定结构,CaCN2的电子式是___________
______________________________________________________________________________。
第18讲 化学键(课件)-2024年高考化学一轮复习(新教材新高考): 这是一份第18讲 化学键(课件)-2024年高考化学一轮复习(新教材新高考),共57页。PPT课件主要包含了第18讲化学键,内容索引,考情分析,网络构建,PARTONE等内容,欢迎下载使用。
新高考化学一轮复习精品课件 第6章 第32讲 化学键 (含解析): 这是一份新高考化学一轮复习精品课件 第6章 第32讲 化学键 (含解析),共60页。PPT课件主要包含了必备知识,关键能力,共价键及其参数,真题演练明确考向,课时精练等内容,欢迎下载使用。
2024年高考化学一轮复习(新高考版) 第6章 第32讲 化学键: 这是一份2024年高考化学一轮复习(新高考版) 第6章 第32讲 化学键,文件包含2024年高考化学一轮复习新高考版第6章第32讲化学键pptx、2024年高考化学一轮复习新高考版第6章第32讲化学键docx、第6章第32讲化学键docx、第6章第32练化学键docx等4份课件配套教学资源,其中PPT共60页, 欢迎下载使用。