








- 鲁科版高中化学必修第一册第1章认识化学科学第1节走进化学科学课件+习题 课件 0 次下载
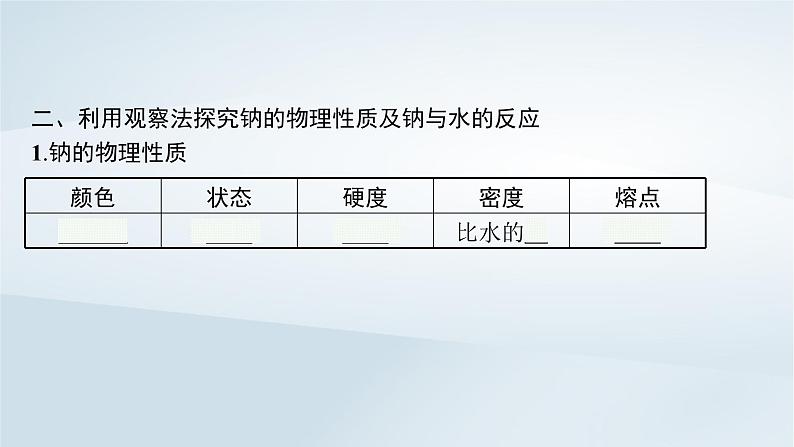
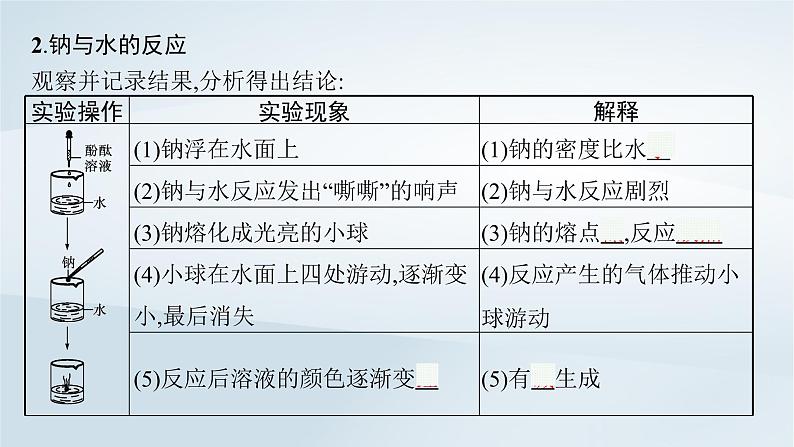
- 鲁科版高中化学必修第一册第1章认识化学科学第2节研究物质性质的方法和程序第2课时研究物质性质的基本程序课件+习题 课件 0 次下载
- 鲁科版高中化学必修第一册第1章认识化学科学第3节化学中常用的物理量__物质的量第1课时物质的量及其单位摩尔质量课件+习题 课件 0 次下载
- 鲁科版高中化学必修第一册第1章认识化学科学第3节化学中常用的物理量__物质的量第2课时气体摩尔体积课件+习题 课件 0 次下载
- 鲁科版高中化学必修第一册第1章认识化学科学第3节化学中常用的物理量__物质的量第3课时物质的量浓度课件+习题 课件 0 次下载
高中化学鲁科版 (2019)必修 第一册第2节 研究物质性质的方法和程序习题课件ppt
展开第1课时 研究物质性质的基本方法
必备知识基础练
1.下列对研究物质性质的常用方法的理解中正确的是( )
A.研究物质性质的常用方法只有观察法、实验法、分类法、比较法
B.观察法只能通过视觉来进行感知
C.观察的目的是对现象进行分析、对比、综合,并得出结论
D.观察是用感官来研究物质的性质,无法借助仪器
2.在烧杯中加水和苯(苯的密度为0.88 g·cm-3,与水互不相溶,且不与钠反应)各50 mL,将一小粒金属钠(密度为 0.97 g·cm-3)投入烧杯中,观察到的现象可能为( )
A.钠在水层中反应并四处游动
B.钠停留在苯层中不发生反应
C.钠在苯的液面上反应并四处游动
D.钠在苯与水的界面处反应并上下跳动
3.将一小块钠投入下列溶液中,既能产生气体又会出现沉淀的是( )
①稀硫酸 ②氢氧化钠溶液 ③硫酸铁溶液 ④氯化镁溶液 ⑤饱和澄清石灰水
A.①②⑤ B.①③⑤ C.②③④ D.③④⑤
4.(2022天津和平区高一期末)下列关于Na2O和Na2O2的叙述正确的是( )
A.都具有漂白性
B.都可以作为供氧剂
C.常温下都为淡黄色固体
D.与水反应后的溶液均呈碱性
5.下列关于钠的叙述正确的是( )
A.钠单质与氯化亚铁溶液反应生成氯化钠和铁单质
B.钠与水反应的现象能说明钠的熔点低,且与水反应放热
C.钠与酸溶液反应产生氢气,实质是钠与H2O的反应
D.将4.6 g金属钠投入95.4 g水中,所得溶液中溶质的质量分数等于8%
6.等质量的两块钠,第一块在足量氧气中加热,第二块在足量氧气(常温)中充分反应,则下列说法正确的是( )
A.第一块钠失去电子多
B.两块钠失去电子一样多
C.第二块钠的反应产物质量大
D.两块钠的反应产物质量相等
7.取一小块金属钠,放在燃烧匙里加热,下列实验现象描述正确的是( )
①金属先熔化 ②在空气中燃烧,放出黄色火花 ③燃烧后得白色固体 ④燃烧时火焰为黄色 ⑤燃烧后生成浅黄色固体物质
A.②⑤ B.①②③ C.①④⑤ D.④⑤
8.已知钠放置于空气中可发生如下变化:
NaNa2ONaOHNa2CO3·10H2ONa2CO3
根据此变化回答以下问题。
(1)请写出①②步转化的化学方程式: ; 。
(2)已知钠在空气中燃烧可生成一种淡黄色物质,该物质可与CO2、H2O发生反应,根据以上叙述回答:
①该淡黄色物质的化学式为 。
②该淡黄色物质与CO2、H2O反应的化学方程式分别为 , 。
关键能力提升练
9.(2022辽宁抚顺六校高一期末)利用如图所示装置进行金属钠与水反应的实验,液体添加完毕后,关闭活塞,打开右边胶塞,向煤油中加入一小块钠,立即塞好胶塞,可观察到的现象是( )
A.钠块始终保持在a处,直至完全消失
B.钠沉入U形管b处而后又慢慢浮到a处
C.钠块在水中上下跳动直至消失
D.随反应的进行,煤油与胶塞相接处液面下降,漏斗中液面上升
10.如右图所示,试管中盛有水,气球a中盛有干燥的Na2O2粉末,U形管中是滴有红墨水的浅红色的水溶液。将气球用橡皮绳紧系在试管口。实验时将气球中的Na2O2抖落到试管b的水中,将发生的现象是( )
A.U形管内红色的水褪色
B.试管内溶液变红
C.气球a被吹大
D.U形管中水位d<c
11.(2022山东日照高一期末)下列关于钠及其化合物的说法正确的是( )
A.Na与Na+都具有强还原性
B.Na2O和Na2O2长期露置于空气中最终产物不相同
C.将足量的Na、Na2O和Na2O2分别加入含有酚酞的水中,最终溶液均变为红色
D.将少量Na和Na2O2分别投入CuSO4溶液中,均既有沉淀生成又有气体放出
12.(双选)向一定量的饱和NaOH溶液中加入少量Na2O2固体,恢复到原温度时,下列说法正确的是( )
A.溶液中的Na+减少
B.溶液的碱性增强
C.溶质的质量分数不变
D.溶液的质量不变
13.2.3 g金属钠在干燥的空气中被氧化后得到3.5 g固体,由此可判断出产物是( )
A.Na2O
B.Na2O2
C.Na2O和Na2O2的混合物
D.无法确定
14.(双选)某实验小组通过下图所示实验,探究Na2O2与水的反应(已知Na2O2在溶液中可反应生成H2O2):
下列说法中正确的是( )
A.②中的大量气泡的主要成分是氧气
B.③中溶液变红,说明有酸性物质生成
C.④中现象可能是由于溶液中含有漂白性物质造成的
D.⑤中MnO2的主要作用是降低了水中氧气的溶解度
15.现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如下:
请回答下列问题:
(1)若规定气体的流动方向为从左到右,则组合实验装置时各仪器的连接顺序是:空气→Ⅳ→ → → (填“Ⅰ、Ⅱ、Ⅲ”,仪器不能重复使用)。
(2)装置Ⅳ中盛放的试剂是 ,其作用是 。
(3)装置Ⅱ的作用是 。
(4)操作中通空气和加热的先后顺序为 。
(5)加热装置Ⅰ时发生反应的化学方程式为 。
学科情境创新练
16.用脱脂棉包住约0.2 g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来。
(1)由实验现象所得出的有关Na2O2和H2O反应的结论是:a.有氧气生成;b. 。
(2)写出Na2O2和H2O反应的化学方程式: 。
(3)某学校研究性学习小组拟用右图所示装置进行实验,以证明上述结论。
①用以验证结论a的实验操作方法及现象是 。
②用以验证结论b的实验操作方法及现象是 。
(4)该研究性学习小组的同学认为Na2O2和H2O反应可生成H2O2,现请你设计一个简单的实验以证明Na2O2和足量的H2O充分反应后的溶液中有H2O2存在(只要求列出实验所用的试剂及观察到的现象)。
试剂: 。
现象: 。
参考答案
1.C 研究物质性质的常用方法除了观察法、实验法、分类法、比较法外,还有其他的方法,A项错误;观察时可以通过视觉、触觉、听觉、嗅觉等进行感知,不只是通过视觉来进行感知,B项错误;观察的目的是通过现象得出一定的结论,C项正确;观察也可以借助仪器进行,从而提高观察的灵敏度,D项错误。
2.D 钠的密度介于水和苯之间,将一小粒金属钠投入烧杯中,钠开始时在苯与水的界面处,钠与水发生反应生成氢气,氢气推动钠球上升,H2逸出后钠又回到水面继续反应,如此反复多次,直到Na与水完全反应。
3.D 将钠投入稀硫酸中,钠与硫酸反应生成可溶性的硫酸钠和水,所以只能生成气体不会产生沉淀,故不选①;将钠投入氢氧化钠溶液,钠和水反应生成可溶性的氢氧化钠和氢气,所以只能生成气体不会产生沉淀,故不选②;将钠投入硫酸铁溶液,钠和水反应生成可溶性的氢氧化钠和氢气,氢氧化钠和硫酸铁发生复分解反应生成难溶性的氢氧化铁沉淀,所以既能产生气体又能出现沉淀,故选③;将钠投入氯化镁溶液,钠和水反应生成可溶性的氢氧化钠和氢气,氢氧化钠和氯化镁溶液反应生成难溶性的氢氧化镁沉淀,所以能产生沉淀和气体,故选④;将钠投入饱和澄清石灰水,钠和水反应生成可溶性的氢氧化钠和氢气,水的质量减少,会有氢氧化钙固体析出,所以能产生沉淀和气体,故选⑤。
4.D Na2O没有强氧化性,不具有漂白性;Na2O2有强氧化性,具有漂白性,A错误。Na2O与水或二氧化碳反应时不能生成氧气,不能作为供氧剂;Na2O2与水或二氧化碳反应能生成氧气,可以作为供氧剂,B错误。常温下,Na2O是白色固体,Na2O2是淡黄色固体,C错误。Na2O和Na2O2都能与水反应生成氢氧化钠,使溶液呈碱性,D正确。
5.B 钠单质与氯化亚铁溶液反应时,钠先与水反应生成氢氧化钠,后生成氢氧化亚铁,不能置换出铁;钠与酸反应时直接与酸解离产生的H+反应;将4.6 g金属钠投入95.4 g水中,所得氢氧化钠的质量是8 g,但因为放出氢气,溶液的质量小于100 g,故溶质的质量分数大于8%。
6.B 钠在反应后都变为+1价,所以B项正确,A项错误;钠与氧气在加热时生成过氧化钠,钠与氧气在常温时生成氧化钠,前者的质量大于后者,C、D项错误。
7.C 根据钠在氧气中燃烧的现象可知①④⑤正确,故选C项。
8.答案 (1)4Na+O22Na2O Na2O+H2O2NaOH
(2)①Na2O2 ②2Na2O2+2CO22Na2CO3+O2
2Na2O2+2H2O4NaOH+O2↑
解析 (1)根据题目中图示转化关系,①②转化反应的化学方程式分别为4Na+O22Na2O,Na2O+H2O2NaOH。
(2)钠在空气中燃烧可生成淡黄色的Na2O2,Na2O2与CO2、H2O反应的化学方程式分别为2Na2O2+2CO22Na2CO3+O2,2Na2O2+2H2O4NaOH+O2↑。
9.D 由于密度:水>钠>煤油,向题给装置中加入一小块钠,钠块落在a处,但钠块底部与水接触发生反应生成H2,H2推动钠块向上运动进入煤油层并与水脱离,受重力作用,钠块又会落回a处,重复上述运动,直至钠块完全消失,A、B、C均错误。钠与水反应产生氢气,氢气在煤油与胶塞相接处聚集,气体压强逐渐增大,右边胶塞处液面下降,左边漏斗中液面上升,D正确。
10.C 由于发生反应:2Na2O2+2H2O4NaOH+O2↑,产生的O2使气球变大,同时该反应放出大量的热,使广口瓶中空气受热膨胀而导致U形管中水位d>c。
11.D Na具有强还原性,Na+不具有强还原性,A错误;Na2O和Na2O2长期露置于空气中,先与水蒸气反应生成NaOH,再吸收CO2转化为Na2CO3,最终产物相同,B错误;Na2O2具有强氧化性,将其加入含有酚酞的水中,溶液先变红后褪色,C错误;将少量Na投入CuSO4溶液中生成Cu(OH)2沉淀和H2,将少量Na2O2投入CuSO4溶液中生成Cu(OH)2沉淀和O2,D正确。
12.AC Na2O2与水反应生成NaOH和O2,所以反应后仍为NaOH的饱和溶液。因为水少了,所以溶液中的Na+减少,故A正确;因为所得溶液仍为NaOH的饱和溶液,所以氢氧根离子浓度不变,溶液的碱性不变,故B错误;因为所得溶液仍为NaOH的饱和溶液,所以溶质的质量分数不变,C正确;因为水少了,饱和溶液中的溶质也少了,溶液质量减小,故D错误。
13.C 金属钠和氧气反应可生成Na2O或Na2O2。若2.3 g钠全部反应生成Na2O,由反应4Na+O22Na2O可知,生成Na2O的质量为3.1 g;若2.3 g钠全部反应生成Na2O2,由反应2Na+O2Na2O2可知,生成Na2O2的质量为3.9 g。由于产物的质量为3.5 g,介于3.1 g和3.9 g之间,则应为Na2O和Na2O2的混合物。
14.AC 过氧化钠与水反应生成NaOH和氧气,则②中大量气泡的主要成分是氧气,A正确;酚酞溶液遇到碱显红色,③中溶液变红,说明有碱性物质生成,B错误;④中红色褪去,可能是由于溶液中的漂白性物质导致,C正确;⑤中加入MnO2产生较多气泡,说明溶液中存在H2O2,MnO2的主要作用是催化H2O2分解放出O2,D错误。
15.答案 (1)Ⅲ Ⅰ Ⅱ
(2)氢氧化钠溶液(合理即可) 除去空气中的二氧化碳
(3)防止空气中的水蒸气和二氧化碳进入装置Ⅰ
(4)先通一段时间的空气再加热装置Ⅰ
(5)2Na+O2Na2O2
解析 用金属钠和空气制备纯度较高的Na2O2,可使空气中的氧气和金属钠在加热条件下反应生成过氧化钠,反应前要将空气中的水蒸气和二氧化碳除去;把空气通过装置Ⅳ除去空气中的二氧化碳气体,再通过装置Ⅲ除去水蒸气,通过装置Ⅰ在加热条件下使钠和氧气反应,连接装置Ⅱ可防止空气中的二氧化碳和水蒸气进入装置Ⅰ而得不到纯净的过氧化钠。
(1)依据上述分析确定连接顺序,组合实验装置时各仪器的连接顺序为Ⅳ、Ⅲ、Ⅰ、Ⅱ。
(2)装置Ⅳ中可用NaOH溶液除去空气中的CO2。
(3)装置Ⅱ的作用是防止空气中的水蒸气、二氧化碳进入装置Ⅰ使产品不纯。
(4)实验时先通入足量空气后再进行加热,避免生成的过氧化钠和二氧化碳、水蒸气反应生成碳酸钠等杂质。
(5)加热装置Ⅰ时钠在氧气中反应生成过氧化钠,发生反应的化学方程式为2Na+O2Na2O2。
16.答案 (1)该反应是放热反应
(2)2Na2O2+2H2O4NaOH+O2↑
(3)①将带火星的木条靠近导管口p处,木条复燃
②将导管q放入水槽中,反应过程中有气泡冒出
(4)MnO2 有无色的气体放出,该气体能使带火星的木条复燃
解析 (1)用脱脂棉包住约0.2 g过氧化钠粉末,置于石棉网上,往脱脂棉上滴加几滴水,可观察到脱脂棉剧烈燃烧起来,说明Na2O2和H2O反应有O2生成且该反应是放热反应。
(3)由题图装置可知,p口处放出氧气,验证氧气的生成可在导管口p处放一根带火星的木条,木条复燃说明有氧气生成。如果该反应是放热反应,则试管的温度必然升高,使锥形瓶内的空气温度升高,压强增大,则空气被排出。所以应将导管q插入盛水的水槽中,再打开分液漏斗的开关,发现q处有气泡放出,即可证明该反应为放热反应。
(4)过氧化氢在二氧化锰的催化作用下分解放出氧气,所以加入二氧化锰检验是否有氧气生成即可。
高中化学鲁科版 (2019)必修 第一册第1章 认识化学科学第2节 研究物质性质的方法和程序习题课件ppt: 这是一份高中化学鲁科版 (2019)必修 第一册第1章 认识化学科学第2节 研究物质性质的方法和程序习题课件ppt,文件包含鲁科版高中化学必修第一册第1章认识化学科学第2节研究物质性质的方法和程序第2课时研究物质性质的基本程序课件ppt、鲁科版高中化学必修第一册第1章认识化学科学第2节研究物质性质的方法和程序第2课时研究物质性质的基本程序课后习题含答案doc等2份课件配套教学资源,其中PPT共40页, 欢迎下载使用。
鲁科版 (2019)必修 第一册第2节 研究物质性质的方法和程序课文配套课件ppt: 这是一份鲁科版 (2019)必修 第一册第2节 研究物质性质的方法和程序课文配套课件ppt,共60页。PPT课件主要包含了NO1,NO2,NO3等内容,欢迎下载使用。
高中化学鲁科版 (2019)必修 第一册第2节 研究物质性质的方法和程序教课内容课件ppt: 这是一份高中化学鲁科版 (2019)必修 第一册第2节 研究物质性质的方法和程序教课内容课件ppt,共52页。PPT课件主要包含了分点突破1,分点突破2,金属钠的性质,分点突破3,钠的氧化物等内容,欢迎下载使用。













