

北京市海淀区2022-2023学年高三化学上学期期中试题(Word版附答案)
展开海淀区2022-2023学年第一学期期中练习
高三化学
2022.11
本试卷共8页,100分,考试时长90分钟。考生务必将答案答在答题纸上,在试卷上作答无效。考试结束后,将本试卷和答题纸一并交回。
可能用到的相对原子质量:H 1 B 11 C 12 N 14 O 16 Na 23 Si 28 Fe 56
第一部分
本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。
1.下列关于有机化合物的说法不正确的是
A.木糖醇()是一种天然甜味剂,属于糖类化合物 | B.DNA的两条多聚核苷酸链间通过氢键形成双螺旋结构 | C.1965年中国科学家人工合成的结晶牛胰岛素是一种蛋白质 | D.烷基磺酸钠(表面活性剂)在水中聚集形成的胶束属于超分子 |
2.下列化学用语不正确的是
A.NaOH的电子式: B.基态Cl原子的价电子轨道表示式:
C.基态的价电子排布式: D.2-甲基-2-丁烯的结构简式:
3.下列说法不正确的是
A.同种原子的原子轨道能量:1s<2s<3s<4s
B.在电子云图中,用小黑点表示绕核做高速圆周运动的电子
C.原子中,电子从的状态跃迁到的状态时,将释放能量
D.和的VSEPR模型相同
4.很多含基(-SH)的有机化合物是重金属元素汞的解毒剂,如化合物Ⅰ、Ⅱ(结构如图)。下列说法正确的是
A.在两个化合物中S原子均采取杂化 B.在两个化合物中C-C-C键角均是180°
C.两个化合物均为共价化合物 D.化合物Ⅱ的水溶性不如化合物Ⅰ
5.“律动世界”国际化学元素周期表主题年活动报告中,提到了一种具有净水作用的物质,它由Q、W、X、Y、Z五种原子序数依次增大的元素组成。该五种元素的性质或结构信息如下表:
元素 | 信息 |
Q | 基态原子只有一种形状的轨道填有电子,并容易形成共价键 |
W | 基态原子有5个原子轨道填充有电子,有2个未成对电子 |
X | 最高价氧化物对应的水化物与Y、Z最高价氧化物对应的水化物都能反应 |
Y | 在元素周期表中位于第3周期、第ⅥA族 |
Z | 焰色反应为紫色 |
下列说法正确的是
A.电负性:Q<W<Y B.第一电离能:W<X<Z
C.简单离子半径:X<W<Z<Y D.这种物质只含离子键
6.工业上通常利用反应来获得单质铝,反应时还需要向(熔点2050℃)中添加以降低熔化温度。下列有关说法不正确的是
A.和熔化时会破坏离子键
B.制得的Al是金属晶体,由“自由电子”和之间强的相互作用而形成
C.的中心离子是,其配位数为6
D.可将该反应中的换成(熔点194℃)进行电解获得单质铝
7.常用的除甲醛试剂有:①活性炭;②;③。其中试剂②去除甲醛的第一步反应原理为:。下列说法不正确的是
A.常温、常压下,甲醛是一种有刺激性气味的无色气体,可以用试剂①吸附
B.依据电负性,试剂②中带部分负电荷的N与甲醛中带部分正电荷的C相结合
C.试剂③与试剂②去除甲醛的反应原理类似
D.甲醛使蛋白质失活,可能是醛基与蛋白质分子中的氨基发生了反应
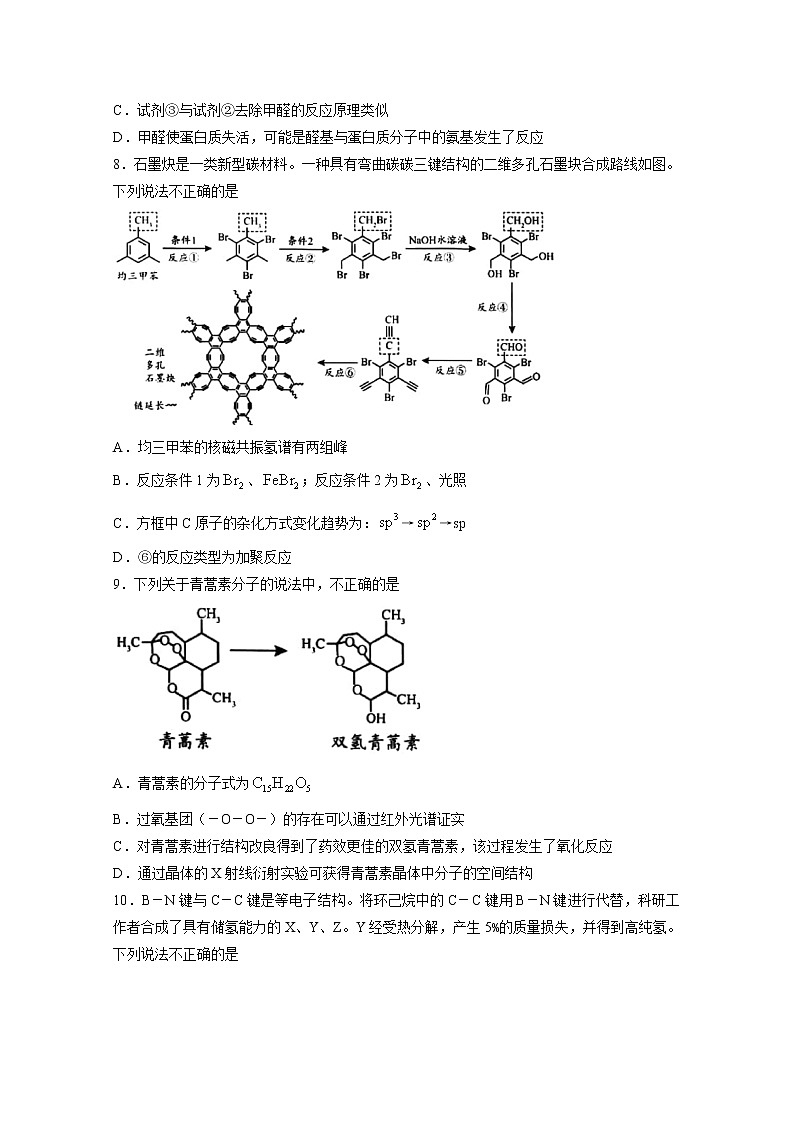
8.石墨炔是一类新型碳材料。一种具有弯曲碳碳三键结构的二维多孔石墨块合成路线如图。下列说法不正确的是
A.均三甲苯的核磁共振氢谱有两组峰
B.反应条件1为、;反应条件2为、光照
C.方框中C原子的杂化方式变化趋势为:→→sp
D.⑥的反应类型为加聚反应
9.下列关于青蒿素分子的说法中,不正确的是
A.青蒿素的分子式为
B.过氧基团(-O-O-)的存在可以通过红外光谱证实
C.对青蒿素进行结构改良得到了药效更佳的双氢青蒿素,该过程发生了氧化反应
D.通过晶体的X射线衍射实验可获得青蒿素晶体中分子的空间结构
10.B-N键与C-C键是等电子结构。将环己烷中的C-C键用B-N键进行代替,科研工作者合成了具有储氢能力的X、Y、Z。Y经受热分解,产生5%的质量损失,并得到高纯氢。
下列说法不正确的是
A.B-N是极性共价健 B.1mol分子Y受热分解得到6mol
C.分子Y与Z互为同分异构体环己烷 D.环己烷、X、Y、Z所含的电子数目一定相等
11.下列化学实验中的操作、现象及解释有正确对应关系的是
选项 | 操作 | 现象 | 解释 |
A | 向酸性溶液中加入甲苯 | 溶液褪色 | 苯环对甲基有影响 |
B | 将含有稀硫酸的蔗糖溶液水浴加热后,加入新制氢氧化铜悬浊液并加热 | 没有产生红色沉淀 | 蔗糖未水解 |
C | 用毛皮摩擦过的带电橡胶棒靠近液流 | 液流方向不改变 | 中不含非极性键 |
D | 向0.1 溶液里逐滴加入1氨水至过量 | 先形成蓝色沉淀,后溶解得到深蓝色溶液 | 沉淀溶解时主要反应: |
12.天然维生素E由多种生育酚组成,其中α-生育酚(化合物F)含量最高,生理活性也最高。下图是化合物F的一种合成路线。
下列说法正确的是
A.分子A中所有原子共平面 B.化合物A、M均可与溴水发生反应且反应类型相同
C.1mol B生成1mol D需消耗2mol D.化合物D、M生成F的同时还有水生成
13.将1-丁醇、溴化钠和70%的硫酸,经回流、蒸馏、萃取分液制得1-溴丁烷,部分装置如图所示。制备反应:。
下列说法正确的是
A.该制备反应利用了硫酸的氧化性和脱水性
B.装置Ⅰ中a的作用是冷凝回流,b的作用是吸收尾气
C.反应结束后的混合物用装置Ⅱ蒸馏时,c为进水口,d为出水口
D.若装置Ⅱ蒸出的粗产品含有,用萃取分液除去
14.依地酸铁钠是一种强化补铁剂。某实验小组采用如下实验探究该补铁剂中铁元素的化合价。(已知:依地酸根是常见的配体,邻二氮菲可依地酸铁钠与形成橙红色配合物)
下列说法正确的是
A.依据现象②和③推测,依地酸铁钠中不含Fe(Ⅲ)
B.依据现象②和⑤推测,依地酸铁钠中含Fe(Ⅱ)
C.依据现象①、②和③推测,与形成配合物的稳定性强于依地酸铁钠
D.依据现象①、④和⑤推测,与依地酸根相比,邻二氮菲与形成的配合物更稳定
第二部分
本部分共5题,共58分。
15.(10分)
水丰富而独特的性质与其结构密切相关。
(1)对于水分子中的共价键,依据原子轨道重叠的方式判断,属于 键;依据O与H的电负性判断,属于 共价键。
(2)水分子中,氧原子的价层电子对数为 ,杂化轨道类型为 。
(3)下列事实可用“水分子间存在氢键”解释的是 (填字母序号)。
a.常压下,4℃时水的密度最大
b.水的沸点比硫化氢的沸点高160℃
c.水的热稳定性比硫化氢强
(4)水是优良的溶剂,常温常压下极易溶于水,从微粒间相互作用的角度分析原因:
(写出两条)。
(5)酸溶于水可形成,的电子式为 ;由于成键电子对和孤电子对之间的斥力不同,会对微粒的空间结构产生影响,如中H-N-H的键角大于中H-O-H的键角,据此判断和的键角大小: (填“>”或“<”)。
16.(12分)
与溶液条件相比,晶体条件下发生的反应有产物选择性高、易于分离提纯等优点。
(1)氟元素在有机晶体化学领域的研究和应用中有重要价值。
①氟元素在元素周期表中的位置为 ,六氟苯中碳原子的杂化方式为 。
②苯环上的电子云密度:苯六氟苯 (填“>”或“<”),依据电负性解释其原因: 。
(2)分子间作用力影响晶体中分子的堆积方式,进而影响物质的性质和反应的选择性。
①已知:苯和六象菜的熔点分别为5.5℃和5.2℃,将二者混合后得到的“混晶”(二者比例为1:1),其熔点上升至23.7℃。
三种晶体中的分子间作用力最大的是 (填“苯”、“六氟苯”或“混晶”)。
②已知:紫外光下,两个碳碳双键可加成为四元环(环丁烷)的结构。紫外光下,分子X在溶液条件下反应得到2种互为同分异构体的加成产物,在晶体条件下只能生成1种加成产物Z,推测Z的结构简式为 (不考虑立体异构)。
(3)A与B经以下两种途径均可获得E。
①已知:与在铜盐催化条件下可发生加成反应得到含结构的分子。E的结构简式为 。
②将B更换为B',发现A与B'无法形成晶体,证实了晶体条件下发生反应时氟原子的必要性。B'的结构简式为 。
③猜测氟原子可能的作用:影响晶体中分子的堆积方式、增强了的活性和 。
17.(13分)
晶体具有周期性的微观结构,表现出许多独特的性质,用于制造各种材料。
(1)干冰常用作制冷剂、人工降雨材料等。
①1个分子周围等距且最近的分子有 个。
②铜金合金的晶胞结构与干冰相似,若顶点为Au、面心为Cu,则铜金合金晶体中Au与Cu原子数之比为是 。
③右图是冰的结构。下列事实能解释干冰的密度比冰大的是 (填字母序号)。
a.二氧化碳分子的质量大于水分子
b.干冰晶胞中二氧化碳分子堆积得更密集
c.水分子极性强,分子间作用力大
d.冰中氢键存在方向性,晶体有较大空隙,空间利用率低
(2)单晶硅等作为制造太阳能电池的材料已得到广泛应用。
①单晶硅中最小的环上有 个Si原子。
②1mol单晶硅中含有 mol Si-Si键。
(3)是一种碳的单质。
①1个晶胞中含有 个分子。
②世界上第一辆单分子“纳米小车”的四个轮子是,小车运行情况如右图所示,从a处化学键的特点说明其运动原因: 。
(4)NiO晶体与NaCl晶体结构相似。
晶体 | 离子间距/nm | 熔点/℃ |
NaCl | 801 | |
NiO | 1960 |
①NiO的熔点远高于NaCl,结合右表说明理由: 。
②设阿伏加德罗常数的值为,距离最近的两个间距为a pm(),NiO的摩尔质量为M ,则晶体的密度为 (列出计算式)。
③晶体普遍存在各种缺陷。某种NiO晶体中存在如右图所示的缺陷:当一个空缺,会有两个被两个所取代,但晶体仍呈电中性。经测定某氧化镍样品中与的离子数之比为6:91。若该晶体的化学式为,则 。
18.(12分)
我国科研人员发现,中药成分黄芩素能明显抑制新冠病毒的活性。黄芩素的一种合成路线如下:
已知:催化剂
①00
②
③(R、R'、R”为烃基或H)
回答下列问题:
(1)A中所含的官能团为 ,A→B的反应类型为 。
(2)B→D中反应i的化学方程式为 。
(3)E与F反应生成G的化学方程式为 。
(4)H分子中有三个六元环状结构,其结构简式为 。
(5)下列关于黄芩素的说法中,正确的是 (填字母序号)。
a.分子中有3种含氧官能团,所有碳原子均为杂化
b.能与溶液反应,能与发生取代反应和加成反应
c.存在含苯环、碳碳三键和羧基的同分异构体
d.“H→黄岑素”反应中通入的目的可能是防止黄岑素被氧化
(6)有文献指出,C的另外一种合成方法如下:
Ⅰ与溶液反应产生气体,其结构简式为___(不考虑立体异构)。
19.(11分)
实验表明,当乙醛加入到溴水中,溴水会褪色。针对此现象,某小组同学依据乙醛结构进行探究。
【实验假设】
(1)假设Ⅰ:醛基含有不饱和键,可与发生 反应(填反应类型)。
假设Ⅱ:乙醛具有α-H,可与溴水发生取代反应。一元取代反应如下:
无论是几元取代,参加反应的与生成的HBr物质的量之比为 。
假设Ⅲ:乙醛具有较强的还原性,可被溴水氧化为乙酸,补全下面反应方程式。
【实验过程】
(2)针对以上假设,该小组同学设计了两组方案。
方案Ⅰ:通过对比反应现象判断反应类型。
序号 | 操作 | 现象 |
试管1 | 1mL溴水+1mL乙醛,充分振荡后静置 | 褪色 |
试管2 | 1mL溴的溶液+1mL乙醛,充分振荡后静置 |
|
结论:假设Ⅰ不成立。试管2中的实验现象为___。
方案Ⅱ:通过测定反应后混合液的pH判断反应类型。
序号 | 操作 | pH |
试管1 | 加入20mL溴水,再加入10mL苯酚溶液,待完全反应后(苯酚过量),测定混合液pH | 1.85 [] |
试管2 | 加入20mL相同浓度的溴水,再加入10mL 20%的乙醛溶液(乙醛过量),3min后完全褪色,测定混合液pH |
|
注:苯酚和乙酸的电离及温度变化对混合液pH的影响可忽略。
①写出苯酚与溴水反应的化学方程式: 。
②若烧杯2中反应后混合液的pH=1.85,则证明乙醛与溴水的反应类型为 反应;若pH接近 ,则证明为氧化反应();若pH介于两者之间,则证明两种反应类型皆有。
【实验结论与反思】
(3)根据实验数据得出结论:乙醛与溴水发生氧化反应。查阅资料,乙醛并非直接与发生反应,而是与次溴酸(HBrO)反应,从平衡移动的角度解释乙醛使溴水褪色的原因: 。
(4)已知柠檬醛的结构如右图,结合上述实验,检验柠檬醛分子中存在碳碳双健的合理方法为 (填字母序号)。
a.向酸性高锰酸钾溶液中加适量柠檬醛,观察其是否褪色
b.向溴水中加适量柠檬醛,观察其是否褪色
c.向溴的溶液中加适量柠檬醛,观察其是否褪色
d.向新制氢氧化铜悬浊液中加适量柠檬醛,加热,冷却后取上层清液再加溴水,观察其是否褪色
海淀区2022—2023学年第一学期期中练习
高三化学参考答案 2022.11
第一部分
本部分共14题,每题3分,共42分。
1 | 2 | 3 | 4 | 5 | 6 | 7 |
A | C | B | A | C | D | C |
8 | 9 | 10 | 11 | 12 | 13 | 14 |
D | C | B | A | D | B | D |
第二部分
本部分共 5 题,共 58 分。
15.(10分)
(1)σ 极性 (各1分,共2分)
(2)4 sp3 (各1分,共2分)
(3)ab (2分)
(4) 第1条:NH3为极性分子,H2O也为极性分子,相似相溶
第2条:NH3与H2O间可以形成氢键
第3条:NH3极易与H2O发生反应 (2分)
(5) > (各1分,共2分)
16. (12分)
(1) ①第二周期、ⅦA sp2 (各1分,共2分)
② > (1分)
电负性F>C>H,氟原子对苯环有吸电子作用 (2分)
(2) ①混晶 (1分)
② (2分)
(3) ①或(2分)
② (1分)
③增强了-COOH的酸性 (1分)
17.(13分)
(1) ① 12 (1分)
② 1:3 (1分)
③ a b d (2分)
(2) ①6 (1分)
②2 (1分)
(3) ①4 (1分)
②a处通过σ单键相连,可以绕键轴旋转 (1分)
(4) ① NiO和NaCl晶体类型相同;Ni2+和O2-都是二价离子,Na+和Cl-都是一价离子;Ni2+和O2-间距比Na+和Cl-间距更小,NiO晶体中作用力更强 (2分)
② (2分)
③ 0.97 (1分)
18.(12分)
(1)-OH或(酚)羟基 取代反应 (各1分,共2分)
(2) (2分)
(3)(2分)
(4) (2分)
(5)abcd (2分)
(6) (2分)
19.(11分)
(1)加成 1:1 (各1分,共2分)
1 CH3CHO + 1 Br2 + 1 H2O → 1 CH3COOH + 2 HBr (1分)
(2)不褪色(无明显变化) (1分)
① (2分)
②取代 1.55 (各1分,共2分)
(3)溴水中存在平衡Br2 + H2O HBr+HBrO,CH3CHO与HBrO反应(CH3CHO + HBrO = CH3COOH + HBr),使得HBrO浓度减小,平衡正向移动,Br2浓度减小,溶液褪色
(2分)
(4)c (1分)
北京市海淀区2022-2023学年高三化学下学期查缺补漏试题(Word版附答案): 这是一份北京市海淀区2022-2023学年高三化学下学期查缺补漏试题(Word版附答案),共10页。试卷主要包含了05,1×10-10,Ksp=5等内容,欢迎下载使用。
北京市海淀区2023届高三化学二模试题(Word版附答案): 这是一份北京市海淀区2023届高三化学二模试题(Word版附答案),共14页。试卷主要包含了05,5 Ti 48 Fe 56,2%,5%,50,14等内容,欢迎下载使用。
北京市海淀区2022-2023高三上学期期末考试化学试题及答案: 这是一份北京市海淀区2022-2023高三上学期期末考试化学试题及答案,共12页。












