






化学必修 第一册第三单元 防治二氧化硫对环境的污染第1课时随堂练习题
展开自主预习·新知导学
一、硫1.硫元素的存在。(1)游离态:常存在于火山喷口的岩层中。(2)化合态:主要存在于硫化物和硫酸盐中。2.物理性质。单质硫俗称硫黄,通常是黄色或淡黄色的固体,质脆,易研成粉末,难溶于水,易溶于CS2。3.化学性质。硫单质在氧气中剧烈燃烧,发出明亮的蓝紫色火焰,反应的化学方程式为S+O2 SO2。
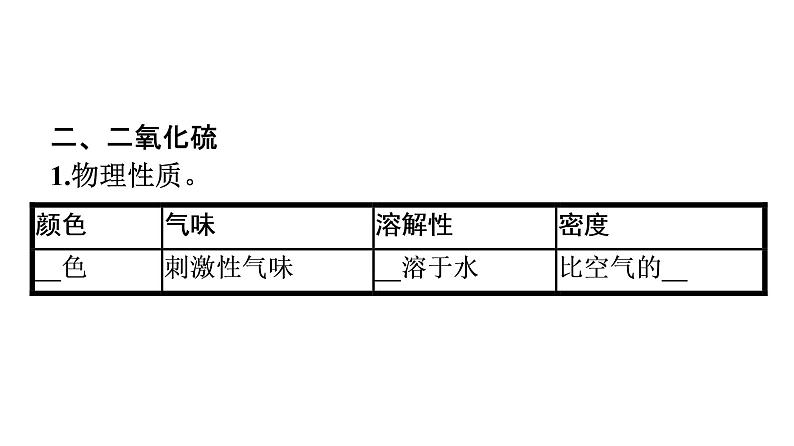
二、二氧化硫1.物理性质。
2.化学性质。(1)酸性氧化物。
(2)具有漂白性。SO2通入品红溶液中能使其褪色。由于二氧化硫能与某些有色物质发生化合反应,生成不稳定的无色物质,所以加热后红色会恢复。(3)具有还原性。将SO2通入溴水中使其褪色,反应的离子方程式为
3.用途。(1)漂白纸浆和草编织物等;(2)作为食品添加剂。SO2虽有毒,但在严格控制用量的情况下,SO2被添加到食品中作为漂白剂、防腐剂和抗氧化剂。
4.SO2气体的实验室制法及性质探究。原理:Na2SO3+H2SO4(浓)══Na2SO4+SO2↑+H2OB装置作用:验证SO2具有漂白性;C中的实验现象是紫红色褪色,说明SO2具有还原性;
【自主思考1】 我国炼丹术史料中记载“丹砂烧之成水银,积变又还成丹砂”,丹砂是指什么?该过程是化学变化吗?提示:丹砂即硫化汞(HgS),加热时分解得到汞;汞与硫黄化合生成硫化汞,该过程是化学变化。【自主思考2】 SO2溶于水生成亚硫酸,亚硫酸具有哪些性质呢?提示:亚硫酸是二元弱酸,具有酸的通性;亚硫酸具有还原性,与O2或H2O2等氧化剂发生反应,使硫元素从+4价变为+6价。
【效果自测】 1.判断正误,正确的画“√”,错误的画“×”。(1)硫元素在自然界中不仅有游离态存在,还有化合态存在。( )(2)试管壁上附着的硫黄用酒精洗涤即可。( )(3)硫在空气中燃烧生成SO2,在纯氧中燃烧生成SO3。( )
2.下列关于SO2和CO2的叙述不正确的是( )。A.通常条件下,都是无色气体,都易溶于水B.都是酸性氧化物,其水溶液都是弱酸C.都可使品红溶液褪色,加热时红色又能再现D.都能与碱溶液反应答案:C解析:SO2能使品红溶液褪色,加热时红色复现,而CO2则不能,C项错误。
3.如下图所示是实验室制取SO2并验证SO2某些性质的装置图。试回答下列问题:
(1)⑥中发生反应的化学方程式为 。 (2)①中的实验现象为 ,此实验证明SO2是 氧化物。 (3)②中的品红溶液 ,证明SO2有 性。 (4)③中的实验现象是 ,证明SO2有 性。(5)④中的实验现象是 ,证明SO2有 性。 (6)⑤的作用是 ,反应的化学方程式为 。
答案:(1)Na2SO3+H2SO4(浓)══Na2SO4+SO2↑+H2O(2)石蕊溶液变红 酸性(3)褪色 漂白(4)出现黄色浑浊 氧化(5)褪色 还原(6)吸收多余的SO2,防止污染空气 SO2+2NaOH══Na2SO3+H2O解析:根据SO2的化学性质及实验室制备SO2的反应原理回答问题。
合作探究·释疑解惑
探究任务 SO2的性质探析
问题引领1.能使澄清石灰水变浑浊的气体,一定是CO2气体吗?提示:不一定。SO2也是酸性氧化物,能与Ca(OH)2反应生成亚硫酸钙沉淀。2.SO2具有漂白性,能否使紫色石蕊溶液褪色?提示:不能。
归纳提升探析SO2的性质1.SO2和CO2的鉴别方法。SO2和CO2都能使澄清石灰水变浑浊,若通入的气体过量,则沉淀都会消失,故不能用澄清石灰水[或Ba(OH)2溶液]鉴别SO2和CO2。通常用以下方法鉴别。
2.检验CO2、SO2同时存在的实验设计流程。
3.二氧化硫与氯水漂白性的比较。(1)原理比较。
(1)SO2的漂白原理与氯水不同,其原理是SO2与有色物质结合生成不稳定的无色物质,加热后,无色物质分解为原来的物质和SO2。(2)SO2能漂白品红、鲜花等有机色素,不能漂白酸碱指示剂,如石蕊等。
典型例题【例题1】 下列溶液中能够区别SO2和CO2的是( )。①石灰水 ②H2S溶液 ③KMnO4溶液 ④氯水 ⑤品红溶液A.①③B.②③④C.②③④⑤D.①②③④⑤答案:C
解析:SO2和CO2都属于酸性氧化物,二者都能与石灰水反应生成不溶性的盐,出现白色沉淀;气体过量时沉淀都会溶解,转化成酸式盐,所以不能用石灰水来区别。 SO2能将H2S氧化成硫单质,能看到黄色沉淀生成;而CO2不能与H2S溶液反应,所以能用H2S溶液来区别。SO2能被KMnO4溶液和氯水氧化,从而使溶液褪色;SO2具有漂白性,能使品红溶液褪色,而CO2没有这些性质。所以可用②③④⑤来区别SO2和CO2。
【例题2】 如下图,利用培养皿探究SO2的性质。实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面皿扣在上面。下表中对实验现象的描述或所做的解释不正确的是( )。
答案:A解析:在Na2SO3固体上滴几滴浓硫酸,发生复分解反应产生SO2。A项,SO2与BaCl2溶液假如可以发生反应:BaCl2+SO2+H2O══BaSO3↓+2HCl,由于酸性HCl>H2SO3,反应产生的BaSO3溶解转化为BaCl2、SO2和H2O,即不会发生上述变化,错误;B项,SO2具有氧化性,可以与Na2S溶液反应生成单质,溶液变浑浊,正确;C项,KMnO4溶液有氧化性,SO2具有还原性,二者会发生氧化还原反应而使KMnO4溶液褪色,正确;D项,SO2具有漂白性,可以使品红溶液褪色,正确。
【变式训练1】 下列实验能证明SO2存在的是( )。①能使澄清石灰水变浑浊 ②能使湿润的蓝色石蕊试纸变红 ③能使品红溶液褪色 ④通入足量的NaOH溶液中,再滴加BaCl2溶液有白色沉淀生成,该沉淀溶于稀盐酸 ⑤通入溴水中能使溴水褪色,再滴加Ba(NO3)2溶液有白色沉淀生成A.①②③④⑤B.⑤C.③④⑤D.无答案:B解析:CO2也能出现①②④中现象;Cl2也能出现③中现象。
【变式训练2】 下列五种有色溶液与SO2作用,均能褪色,其实质相同的是( )。①品红溶液 ②酸性KMnO4溶液 ③溴水 ④滴有酚酞溶液的NaOH溶液 ⑤淀粉碘溶液A.①④B.①②③C.②③⑤D.②③④答案:C
解析:SO2使品红溶液褪色,利用其漂白性;SO2使含酚酞溶液的NaOH溶液褪色,利用其酸性氧化物的性质;SO2使酸性KMnO4溶液、溴水、淀粉碘溶液褪色,利用其还原性,实质相同。
【变式训练3】 下列有关SO2的说法错误的是( )。A.可用石蕊溶液鉴别SO2和CO2B.SO2能使品红溶液褪色是因为它具有漂白性C.将已被SO2漂白的品红溶液用酒精灯加热,可恢复原来的红色D.S与O2点燃,在O2充足的条件下,不能生成SO3答案:A
解析:A项,SO2和CO2都可使石蕊溶液变红,错误;B项,SO2使品红溶液褪色,体现了SO2的漂白性,正确;C项,SO2的漂白原理是SO2与某些有色物质化合生成不稳定的无色物质,加热后又恢复原来的颜色,正确;D项,S与O2反应生成SO2,不能生成SO3,正确。
高中化学苏教版 (2019)必修 第一册第一单元 含硫化合物的性质第1课时测试题: 这是一份高中化学苏教版 (2019)必修 第一册第一单元 含硫化合物的性质第1课时测试题,共8页。试卷主要包含了下列说法正确的是,下列物质都具有漂白性等内容,欢迎下载使用。
苏教版 (2019)必修 第一册第一单元 含硫化合物的性质练习题: 这是一份苏教版 (2019)必修 第一册第一单元 含硫化合物的性质练习题,共8页。试卷主要包含了下列说法不正确的是等内容,欢迎下载使用。
高中化学苏教版 (2019)必修 第一册第一单元 含硫化合物的性质第1课时课后练习题: 这是一份高中化学苏教版 (2019)必修 第一册第一单元 含硫化合物的性质第1课时课后练习题,共4页。













