





高中鲁科版 (2019)第3节 元素周期表的应用课堂教学ppt课件
展开基础落实•必备知识全过关
重难探究•能力素养全提升
学以致用•随堂检测全达标
1.以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系,学会运用证据推理与模型认知的思维解决实际问题。2.能设计实验探究同周期元素的非金属性及金属性强弱,培养科学探究与创新意识。
[知识铺垫]1.同周期元素自左向右元素原子的 相同, 逐渐增大,原子核对外层电子的吸引力逐渐 ,原子 能力逐渐增强, 能力逐渐减弱。2.可以通过单质与水(或酸)反应的剧烈程度判断元素原子 的能力。3.元素原子得失电子的能力与原子的 、 和 都有关系。
[必备知识]一、比较钠、镁、铝三种金属元素失电子的能力1.钠、镁与水反应的实验探究见第1节第3课时,必备知识一、(1)。
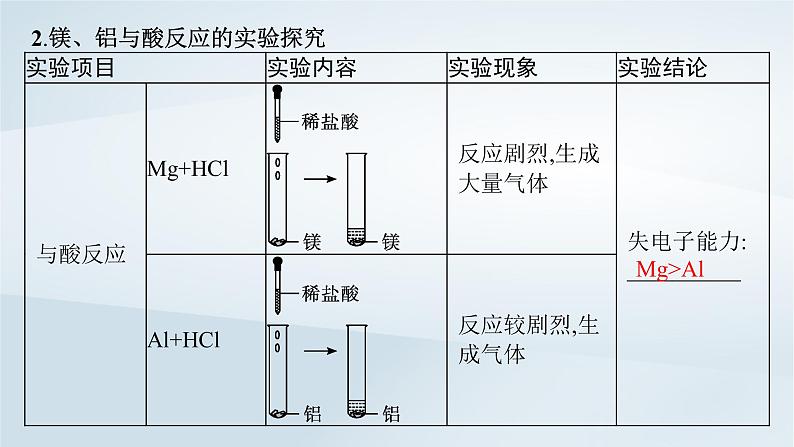
2.镁、铝与酸反应的实验探究
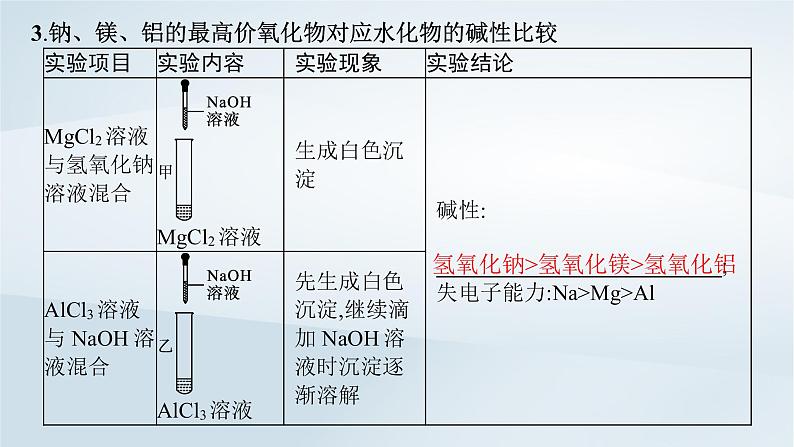
3.钠、镁、铝的最高价氧化物对应水化物的碱性比较
氢氧化钠>氢氧化镁>氢氧化铝
二、硅、磷、硫、氯四种非金属元素原子得电子能力的比较
三、同周期元素原子得失电子能力的变化规律(稀有气体除外)1.规律同周期从左到右,主族元素的原子得电子能力 ,失电子能力 。2.理论解释同周期主族元素原子从左到右,电子层数 ,核电荷数 ,原子半径 ,原子核对最外层电子的吸引力依次 ,元素原子失电子能力依次 ,得电子能力依次 。
【微思考1】工业上在850 ℃时用钠还原熔融态氯化钾的方法制备金属钾:Na(l)+KCl(l) K(g)+NaCl(l)。该过程能否说明金属钠比金属钾的失电子能力强? 【微思考2】同一周期中,非金属元素对应的所有含氧酸的酸性都随原子序数的增大而增强吗?
提示 不能。用金属钠与氯化钾反应制取钾,是利用钾的沸点比钠低,易变成气体从反应体系中脱离出来,从而促使反应进行。
提示 不一定。同一周期随着原子序数的递增,非金属元素最高价氧化物对应水化物(即最高价含氧酸)的酸性逐渐增强,但低价含氧酸不符合此规律,如酸性:HClO
回答下列问题。(1)为说明同周期中元素金属性的递变规律,试从上表(Ⅰ)中选择实验方法,从(Ⅱ)中选择相应的实验现象,上下对应地填写符合要求的序号和字母在空格中(有几个填几个,不一定把空格填满)。
(2)从上表中的现象可以得到什么结论?
提示 金属性:Na>Mg>Al。
(3)上表中同周期的几种金属元素的原子半径由大到小如何排列?相应的离子半径由大到小如何排列? (4)上表中同周期的几种金属元素的主要化合价分别是多少?由此可以看出同一周期的元素的最高化合价有什么递变规律?
提示 原子半径:Na>Mg>Al。离子半径:Na+>Mg2+>Al3+。
提示 Na、Mg、Al的主要化合价分别为+1价、+2价、+3价。同一周期从左往右元素的最高化合价逐渐增大。
[深化拓展] 同周期主族元素从左到右性质的变化规律
[应用体验]【例1】X、Y为同一周期的主族元素,如果X的原子半径大于Y的原子半径,则下列说法不正确的是( )A.若X、Y均为金属元素,则X的失电子能力强于YB.若X、Y均为金属元素,则X的阳离子的氧化性比Y的阳离子的氧化性弱C.若X、Y均为非金属元素,则Y的气态氢化物比X的气态氢化物稳定D.若X、Y均为非金属元素,则Y的最高价含氧酸的酸性弱于X的
答案 D解析 X、Y为同周期的主族元素,原子半径X>Y,则原子序数X
变式训练1下列关于元素周期律和元素周期表的说法错误的是( )A.Li、Na、K元素的原子核外电子层数随着核电荷数的增大而增大B.第2周期元素从Li到F,元素原子半径逐渐减小C.因为Na比K容易失去电子,所以Na的还原性强D.C、N2、O2、F2与H2化合越来越容易
答案 C解析 Na与K相比,K更易失电子,K的还原性更强,C项错误。
[问题探究]为了探究元素非金属性的强弱,某同学设计了右图所示的装置,可比较HNO3、H2CO3、H2SiO3的酸性强弱,进而比较氮、碳、硅三种元素的非金属性强弱。供选择的试剂:稀硝酸、稀硫酸、碳酸钙固体、硅酸钠溶液、澄清石灰水、饱和碳酸氢钠溶液。
(1)锥形瓶中装有某难溶性正盐,分液漏斗中盛放何种试剂?
提示 锥形瓶中盛放碳酸钙固体,分液漏斗内装稀硝酸,两者反应生成二氧化碳气体。
(2)装置B盛放何种试剂?其作用是什么? (3)装置C盛放何种试剂?写出发生反应的离子方程式。 (4)通过实验证明碳、氮、硅的非金属性由强到弱的顺序是怎样的?
提示 因为硝酸具有挥发性,所以应通过装置B除去HNO3蒸气,否则无法确定后面的H2SiO3沉淀是由CO2与Na2SiO3反应生成的,还是HNO3与Na2SiO3反应生成的。所以B中盛放饱和碳酸氢钠溶液,吸收混合气体中的硝酸蒸气。
提示 N>C>Si。
[深化拓展]元素金属性、非金属性强弱的比较方法(1)比较元素非金属性强弱的依据。
(2)比较元素金属性强弱的依据。
[应用体验]【例2】下列事实不能作为实验判断依据的是( )A.钠和镁分别与冷水反应,判断金属活动性强弱B.铁投入CuSO4溶液中能置换出铜,钠投入CuSO4溶液中不能置换出铜,由此判断钠与铁的金属活动性强弱C.酸性H2CO3
规律方法 (1)元素的非金属性越强,其最高价含氧酸的酸性越强;元素的金属性越强,其最高价氧化物对应水化物的碱性越强。(2)同周期主族元素从左向右非金属性逐渐增强,金属性逐渐减弱;同主族元素从上到下非金属性逐渐减弱,金属性逐渐增强。
变式训练2-1(2021北京延庆高一期中)下列元素中,非金属性最强的是( )A.硅(Si)B.磷(P)C.硫(S)D.氯(Cl)
答案 D解析 硅(Si)、磷(P)、硫(S)、氯(Cl)为元素周期表中第3周期的相邻元素。同周期元素从左到右,原子半径依次减小,原子核对外层电子的吸引力依次增强,非金属性依次增强,所以氯(Cl)的非金属性最强,故选D。
变式训练2-2下表是分别含元素X、Y的物质性质的比较及得出的结论,其中结论不正确的是( )
答案 C解析 金属元素最高价氧化物对应水化物的碱性越强,该元素的金属性越强,A项正确;非金属元素气态氢化物的热稳定性越强,该元素的非金属性越强,B项正确;元素的金属性与元素最高化合价的高低无关,C项错误;两种不同的金属单质分别与盐酸、水反应,由于反应的环境不同,因此反应的剧烈程度不能说明X与Y的金属性强弱,D项正确。
学以致用•随堂检测全达标
1.下列不能作为判断元素非金属性强弱依据的是( )A.元素的最高价氧化物对应水化物的酸性强弱B.元素的单质跟氢气反应生成气态氢化物的难易程度C.非金属元素对应的气态氢化物的稳定性D.非金属元素单质的熔点和沸点的高低
答案 D解析 判断元素非金属性强弱的一般依据有:最高价氧化物对应水化物的酸性强弱、单质跟氢气化合的难易程度以及气态氢化物的稳定性。单质的熔点和沸点不能作为判断元素非金属性强弱的依据。
2.四种短周期元素在元素周期表中的位置如图所示。T的最高价氧化物对应的水化物是酸性最强的无机含氧酸。下列推断正确的是( )A.原子半径:X
3.下列事实不能说明元素的金属性或非金属性相对强弱的是( )
答案 C解析 Na、Mg位于同周期,金属性Na>Mg,则与冷水反应Na比Mg剧烈,故A正确;Ca、Mg位于同主族,金属性Ca>Mg,最高价氧化物对应水化物的碱性为Ca(OH)2>Mg(OH)2,故B正确;含氧酸的氧化性强弱与相应元素的非金属性强弱无关,故C错误;气态氢化物越稳定,相应元素的非金属性越强,故D正确。
4.(2022重庆模拟预测)短周期主族元素X、Y、Z、W的原子序数依次增大,X的内层电子总数与最外层电子数相差3个,Z的最外层电子数等于周期数,Y与W同主族,W最高正价与最低负价的代数和为4。下列说法正确的是( )A.简单氢化物的还原性:Y>XB.简单离子半径:Z
高中化学鲁科版 (2019)必修 第二册第3节 元素周期表的应用优质ppt课件: 这是一份高中化学鲁科版 (2019)必修 第二册第3节 元素周期表的应用优质ppt课件,共34页。PPT课件主要包含了较剧烈,金属元素的性质,非金属元素的性质,半导体等内容,欢迎下载使用。
化学必修 第二册第3节 元素周期表的应用图片课件ppt: 这是一份化学必修 第二册第3节 元素周期表的应用图片课件ppt,共56页。PPT课件主要包含了NO1,NO2,NO3等内容,欢迎下载使用。
高中化学鲁科版 (2019)必修 第二册第3节 元素周期表的应用说课课件ppt: 这是一份高中化学鲁科版 (2019)必修 第二册第3节 元素周期表的应用说课课件ppt,共51页。PPT课件主要包含了内容索引,素养目标,HXO4,实验内容等内容,欢迎下载使用。













