
难溶电解质的溶解平衡(复习梳理)
展开这是一份难溶电解质的溶解平衡(复习梳理),共12页。PPT课件主要包含了难溶电解质的溶解,平衡移动因素,沉淀溶解常数,∆H0,加水稀释,加相同离子,加反应离子,平衡逆移,平衡正移,表达式等内容,欢迎下载使用。
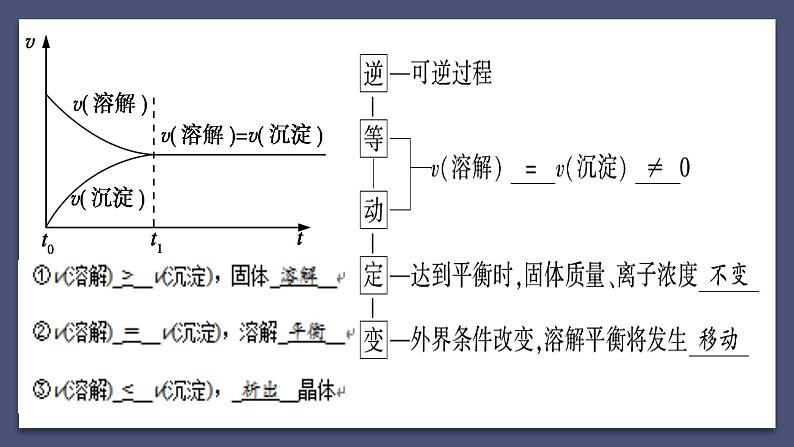
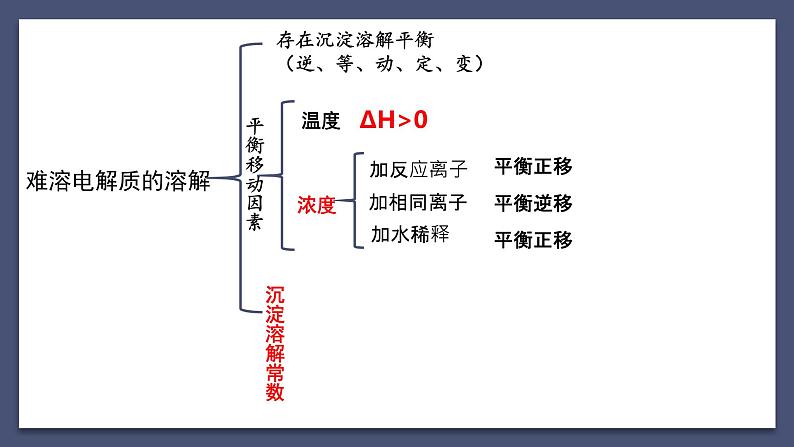
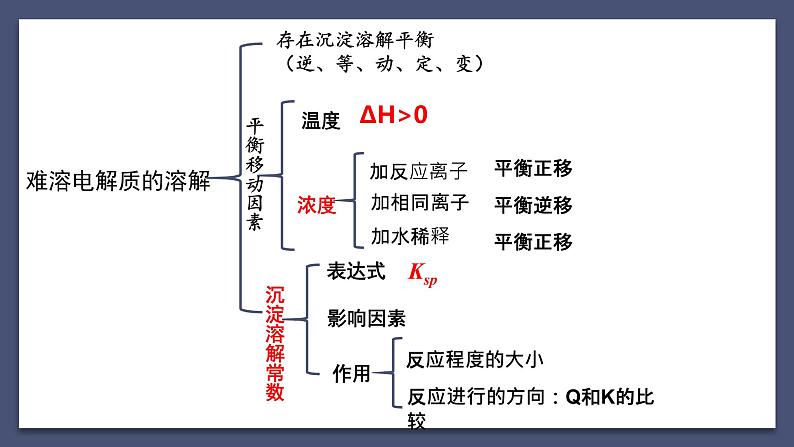
存在沉淀溶解平衡(逆、等、动、定、变)
反应进行的方向:Q和K的比较
(2)某温度下,已知Ksp(AgCl)=1.80×10-10,将2.2×10-3 ml·L-1的NaCl溶液和2.0×10-3 ml·L-1 AgNO3溶液等体积混合是否有沉淀生成?请计算反应后溶液中Ag+的浓度。
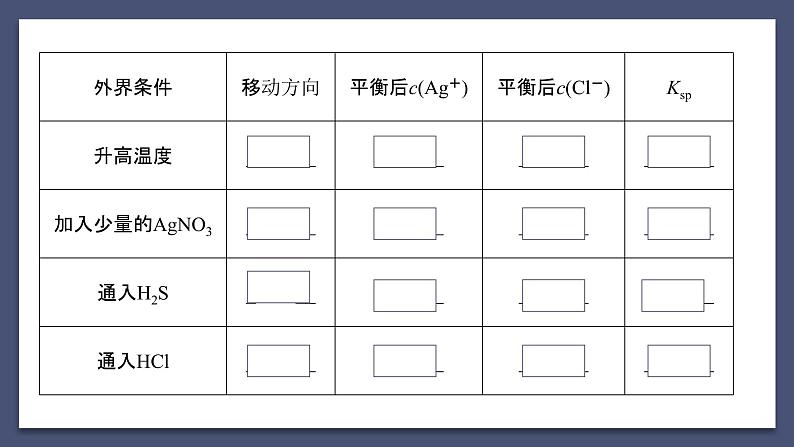
第二课时 沉淀溶解平衡的应用
④络合溶解法:如AgCl溶于氨水化学方程式为:AgCl+2NH3·H2O===Ag(NH3)2Cl+2H2O
①已知Ba2+有毒,为什么医疗上能用BaSO4做钡餐透视,而不能用BaCO3做钡餐?
2.沉淀的转化-——难溶物转化为更难溶的物质
a.锅炉除垢:将CaSO4转化为CaCO3,离子方程式为:
b.矿物转化:CuSO4溶液遇PbS转化为 CuS,离子方程式为:
利用沉淀法除去杂质离子
1.如何除去溶液中的Hg2+ :
2.如除去CuCl2溶液中的杂质FeCl3,可以向溶液中加入CuO,调节溶液的pH,使Fe3+形成Fe(OH)3沉淀而除去。离子方程式为_CuO+2H+===Cu2++H2O Fe3++3H2O===Fe(OH)3↓+3H+__。 调节PH值使离子沉淀除去
4.在工艺流程中的应用
相关课件
这是一份2024年高考化学一轮复习难溶电解质的溶解平衡与应用课件,共52页。PPT课件主要包含了复习目标,网络构建,知识梳理题型归纳,真题感悟,内容索引,考情分析,PARTONE等内容,欢迎下载使用。
这是一份2023届高三化学一轮复习课件:专题22 难溶电解质的溶解平衡,共25页。PPT课件主要包含了沉淀溶解平衡,溶度积规则,溶解平衡的应用,沉淀的生成,2应用,0×10-5,0×10-3,Fe3+,沉淀的溶解,沉淀的转化等内容,欢迎下载使用。
这是一份人教版高考化学一轮复习8.4难溶电解质的溶解平衡课件












