

十年(2013-2022)高考化学真题分项汇编(全国通用)专题29 反应热计算——盖斯定律(学生版)
展开
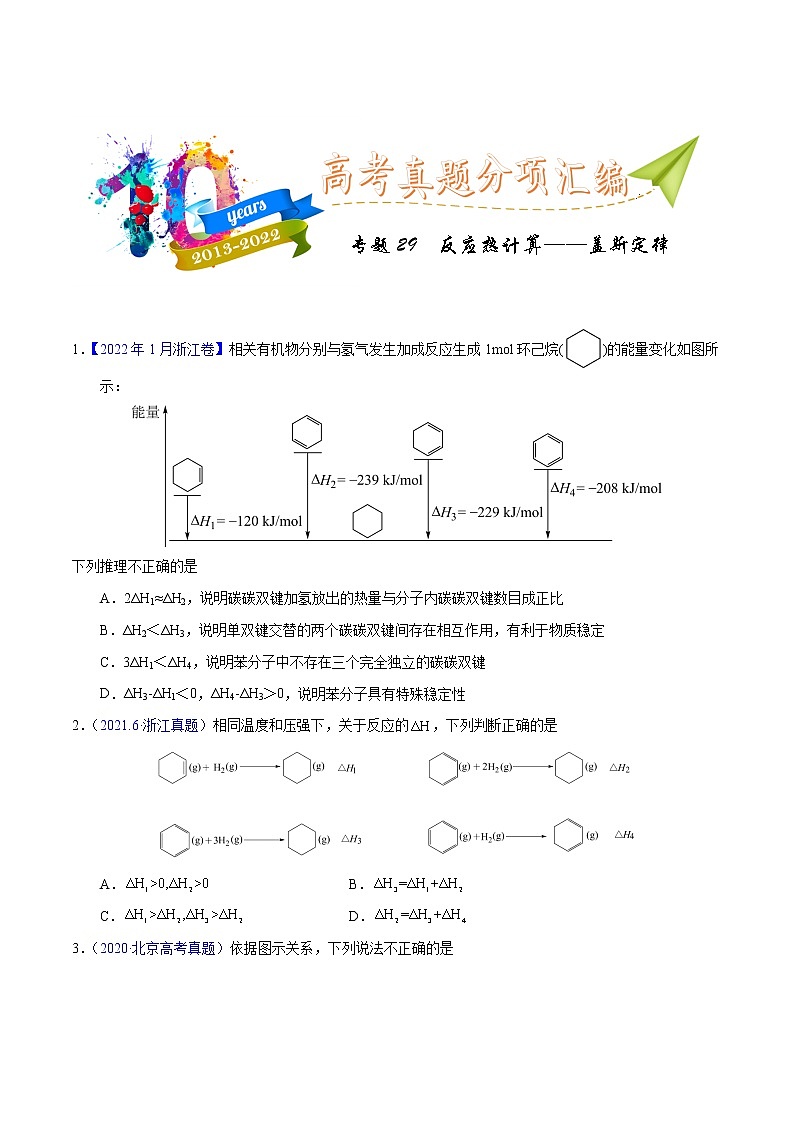
1.【2022年1月浙江卷】相关有机物分别与氢气发生加成反应生成1mol环己烷()的能量变化如图所示:
下列推理不正确的是
A.2ΔH1≈ΔH2,说明碳碳双键加氢放出的热量与分子内碳碳双键数目成正比
B.ΔH2<ΔH3,说明单双键交替的两个碳碳双键间存在相互作用,有利于物质稳定
C.3ΔH1<ΔH4,说明苯分子中不存在三个完全独立的碳碳双键
D.ΔH3-ΔH1<0,ΔH4-ΔH3>0,说明苯分子具有特殊稳定性
2.(2021.6·浙江真题)相同温度和压强下,关于反应的,下列判断正确的是
A. B.
C. D.
3.(2020·北京高考真题)依据图示关系,下列说法不正确的是
A.石墨燃烧是放热反应
B.1molC(石墨)和1molCO分别在足量O2中燃烧,全部转化为CO2,前者放热多
C.C(石墨)+CO2(g)=2CO(g) ΔH=ΔH1-ΔH2
D.化学反应的ΔH,只与反应体系的始态和终态有关,与反应途径无关
4.(2018·浙江高考真题)氢卤酸的能量关系如图所示下列说法正确的是
A.已知HF气体溶于水放热,则HF的△H1<0
B.相同条件下,HCl的△H2比HBr的小
C.相同条件下,HCl的△H3+△H4比HI的大
D.一定条件下,气态原子生成1molH-X键放出akJ能量,则该条件下△H2=+akJ/mol
5.(2020·浙江高考真题)关于下列的判断正确的是( )
A. B. C. D.
6.(2015·重庆高考真题)黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g) ΔH=x kJ·mol-1
已知碳的燃烧热ΔH1=a kJ·mol-1
S(s)+2K(s)=K2S(s) ΔH2=b kJ·mol-1
2K(s)+N2(g)+3O2(g)=2KNO3(s) ΔH3=c kJ·mol-1
则x为
A.3a+b-c B.c+3a-b C.a+b-c D.c+a-b
7.(2017·浙江高考真题)根据体系的能量循环图:
下列说法正确的是:
A.>0 B.
C. D.
8.(2014·江苏高考真题)已知:C(s)+O2(g)=CO2(g) △H1
CO2(g)+C(s)=2CO(g) △H2
2CO(g)+O2(g)=2CO2(g) △H3
4Fe(s)+3O3(g)=2Fe2O3(s) △H4
3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A.△H1>0,△H3<0
B.△H2>0,△H4>0
C.△H1=△H2+△H3
D.△H3=△H4+△H5
9.(2008·宁夏高考真题)已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A.-44.2kJ·mol-1 B.+44.2kJ·mlo-1
C.-330kJ·mol-1 D.+330kJ·mlo-1
10.(2013·全国高考真题)在1200℃时,天然气脱硫工艺中会发生下列反应
①H2S(g)+O2(g)=SO2(g)+H2O(g) △H1
②2H2S(g)+SO2(g)=S2(g)+2H2O(g) △H2
③H2S(g)+O2(g)=S(g)+H2O(g) △H3
④2S(g) =S2(g) △H4
则△H4的正确表达式为( )
A.△H4=2/3(△H1+△H2-3△H3)
B.△H4=2/3(3△H3-△H1-△H2)
C.△H4=3/2(△H1+△H2-3△H3)
D.△H4=3/2(△H1-△H2-3△H3)
11.(2014·全国高考真题)室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s)CuSO4(s)+5H2O(l),热效应为△H3。则下列判断正确的是
A.△H2>△H3 B.△H1<△H3
C.△H1+△H3=△H2 D.△H1+△H2>△H3
12.(2013·海南高考真题)已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l);ΔH1
2 H2(g)+ O2(g)= 2H2O(g);ΔH2
C(s)+ O2(g)=CO2(g);ΔH3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的ΔH为
A.12ΔH3+5ΔH2-2ΔH1 B.2ΔH1-5ΔH2-12ΔH3
C.12ΔH3-5ΔH2-2ΔH1 D.ΔH1-5ΔH2-12ΔH3
13.(2018·浙江高考真题)已知:
下列说法正确的是
A.∆H1<0,∆H2<0,∆H3<∆H4 B.6∆H1+∆H2+∆H3-∆H4=0
C.-6∆H1+∆H2+∆H3-∆H4=0 D.-6∆H1+∆H2-∆H3+∆H4=0
14.(2019·浙江高考真题)MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):
M2+(g)+CO32-(g) M2+(g)+O2−(g)+CO2(g)
已知:离子电荷相同时,半径越小,离子键越强。下列说法不正确的是
A.ΔH1(MgCO3)>ΔH1(CaCO3)>0
B.ΔH2(MgCO3)=ΔH2(CaCO3)>0
C.ΔH1(CaCO3)-ΔH1(MgCO3)=ΔH3(CaO)-ΔH3(MgO)
D.对于MgCO3和CaCO3,ΔH1+ΔH2>ΔH3
15.【2022年全国乙卷】油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,需要回收处理并加以利用。回答下列问题:
(1)已知下列反应的热化学方程式:
①
②
③
计算热分解反应④的________。
16.【2022年湖北卷】自发热材料在生活中的应用日益广泛。某实验小组为探究“”体系的发热原理,在隔热装置中进行了下表中的五组实验,测得相应实验体系的温度升高值()随时间(t)的变化曲线,如图所示。
回答下列问题:
(1)已知:
①
②
③
则的___________。
17.【2022年全国甲卷】金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途,目前生产钛的方法之一是将金红石转化为,再进一步还原得到钛。回答下列问题:
(1)转化为有直接氯化法和碳氯化法。在时反应的热化学方程式及其平衡常数如下:
(ⅰ)直接氯化:
(ⅱ)碳氯化:
①反应的为_______,_______Pa。
18.(2012·江苏高考真题)铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原-氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g) △H=a kJ·mol-1
3AlCl(g)=2Al(l)+AlCl3(g) △H=b kJ·mol-1
①反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=________kJ·mol-1(用含a、b 的代数式表示)。
②Al4C3是反应过程中的中间产物。Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为____________________________________________。
19.(2020·山东高考真题)探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.
Ⅱ.
Ⅲ.
回答下列问题:
(1)_________。
20.(2017·全国高考真题)[2017·新课标Ⅲ]砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(3)已知:As(s)+H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+O2(g)=H2O(l) ΔH2
2As(s)+O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_________。
21.(2009·山东高考真题)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(2)O2(g)= O+2(g)+e- H1=1175.7kJ·mol-1
PtF6(g)+ e-1PtF6-(g)H2= -771.1 kJ·mol-1
O2+PtF6-(s)=O2+(g)+PtF6- H3=482.2 kJ·mol-1
则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的H=_____________ kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________
22.(2016·全国高考真题)联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(3)①2O2(g)+N2(g)=N2O4(l) △H1
②N2(g)+2H2(g)=N2H4(l) △H2
③O2(g)+2H2(g)=2H2O(g) △H3
④2N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) △H4=-1048.9kJ/mol
上述反应热效应之间的关系式为△H4=________________,联氨和N2O4可作为火箭推进剂的主要原因为_________________________________________________。
23.(2018·江苏高考真题)NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。
(1)用水吸收NOx的相关热化学方程式如下:
2NO2(g)+H2O(l)HNO3(aq)+HNO2(aq) ΔH=−116.1 kJ·mol−1
3HNO2(aq)HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol−1
反应3NO2(g)+H2O(l)2HNO3(aq)+NO(g)的ΔH=___________kJ·mol−1。
24.(2013·江苏高考真题)磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)= 6CaO(s)+P4(s)+10CO(g) △H1="+3359.26" kJ·mol-1
CaO(s)+SiO2(s)= CaSiO3(s) △H2=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)= 6CaSiO3(s)+P4(s)+10CO(g) △H3
则△H3= kJ·mol-1。
十年(23-22)高考化学真题分项汇编专题29 反应热计算 盖斯定律(2份打包,原卷版+教师版): 这是一份十年(23-22)高考化学真题分项汇编专题29 反应热计算 盖斯定律(2份打包,原卷版+教师版),文件包含十年23-22高考化学真题分项汇编专题29反应热计算盖斯定律原卷版doc、十年23-22高考化学真题分项汇编专题29反应热计算盖斯定律教师版doc等2份试卷配套教学资源,其中试卷共23页, 欢迎下载使用。
十年(2013-2022)高考化学真题分项汇编(全国通用)专题29 反应热计算——盖斯定律(教师版): 这是一份十年(2013-2022)高考化学真题分项汇编(全国通用)专题29 反应热计算——盖斯定律(教师版),共14页。试卷主要包含了关于下列ΔH的判断正确的是, ΔH=x kJ·ml-1,根据体系的能量循环图,已知等内容,欢迎下载使用。
十年(2013-2022)高考化学真题分项汇编(全国通用)专题28 反应热计算——键能(学生版): 这是一份十年(2013-2022)高考化学真题分项汇编(全国通用)专题28 反应热计算——键能(学生版),共7页。试卷主要包含了己知,在体内代谢时可发生如下反应,白磷与氧可发生如下反应等内容,欢迎下载使用。












