
高考化学一轮复习课后限时集训32化学实验方案的设计与评价含答案
展开这是一份高考化学一轮复习课后限时集训32化学实验方案的设计与评价含答案,共11页。
课后限时集训(三十二)
(建议用时:40分钟)
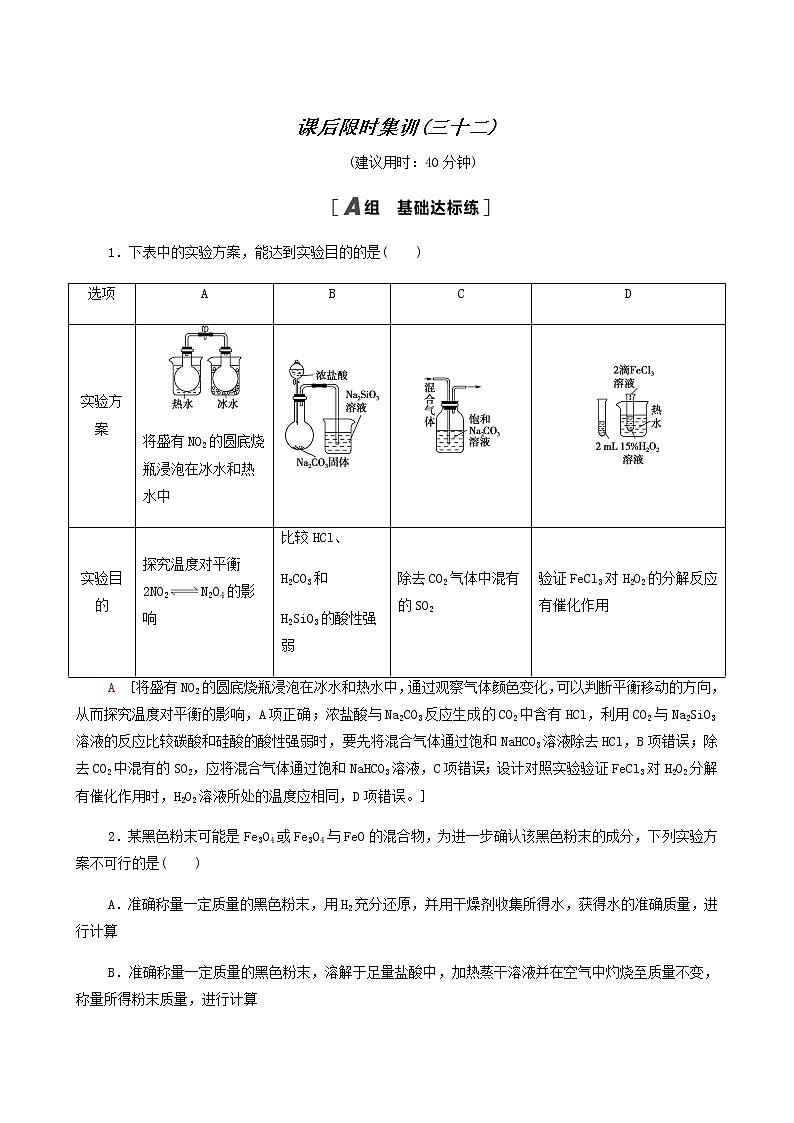
1.下表中的实验方案,能达到实验目的的是( )
选项 | A | B | C | D |
实验方案 | 将盛有NO2的圆底烧瓶浸泡在冰水和热水中 | |||
实验目的 | 探究温度对平衡2NO2N2O4的影响 | 比较HCl、 H2CO3和 H2SiO3的酸性强弱 | 除去CO2气体中混有的SO2 | 验证FeCl3对H2O2的分解反应有催化作用 |
A [将盛有NO2的圆底烧瓶浸泡在冰水和热水中,通过观察气体颜色变化,可以判断平衡移动的方向,从而探究温度对平衡的影响,A项正确;浓盐酸与Na2CO3反应生成的CO2中含有HCl,利用CO2与Na2SiO3溶液的反应比较碳酸和硅酸的酸性强弱时,要先将混合气体通过饱和NaHCO3溶液除去HCl,B项错误;除去CO2中混有的SO2,应将混合气体通过饱和NaHCO3溶液,C项错误;设计对照实验验证FeCl3对H2O2分解有催化作用时,H2O2溶液所处的温度应相同,D项错误。]
2.某黑色粉末可能是Fe3O4或Fe3O4与FeO的混合物,为进一步确认该黑色粉末的成分,下列实验方案不可行的是( )
A.准确称量一定质量的黑色粉末,用H2充分还原,并用干燥剂收集所得水,获得水的准确质量,进行计算
B.准确称量一定质量的黑色粉末,溶解于足量盐酸中,加热蒸干溶液并在空气中灼烧至质量不变,称量所得粉末质量,进行计算
C.准确称量一定质量的黑色粉末,用CO充分还原,在CO气流中冷却后准确称量剩余固体的质量,进行计算
D.准确称量一定质量的黑色粉末,与一定量铝粉混合后点燃,充分反应后冷却,准确称量剩余固体质量,进行计算
D [反应物与生成物均为固体,反应前后质量守恒,质量没有改变,无法确定黑色粉末的成分,D不可行。]
3.(2020·广东模拟)MnSO4·H2O是一种易溶于水的微红色斜方晶体,某同学设计下列装置制备硫酸锰:
下列说法错误的是( )
A.装置Ⅰ烧瓶中放入的药品X为铜屑
B.装置Ⅱ中用“多孔球泡”可增大SO2的吸收速率
C.装置Ⅲ用于吸收未反应的SO2
D.用装置Ⅱ反应后的溶液制备MnSO4·H2O需经历蒸发、结晶、过滤、洗涤及干燥的过程
A [由实验装置可知,X为亚硫酸钠,与浓硫酸反应生成二氧化硫,而Cu与浓硫酸常温下不反应,Ⅱ中“多孔球泡”可增大SO2的吸收速率,二氧化硫与二氧化锰反应生成MnSO4,蒸发浓缩、冷却结晶可得到晶体,Ⅲ中NaOH溶液可吸收尾气。]
[教师用书备选]
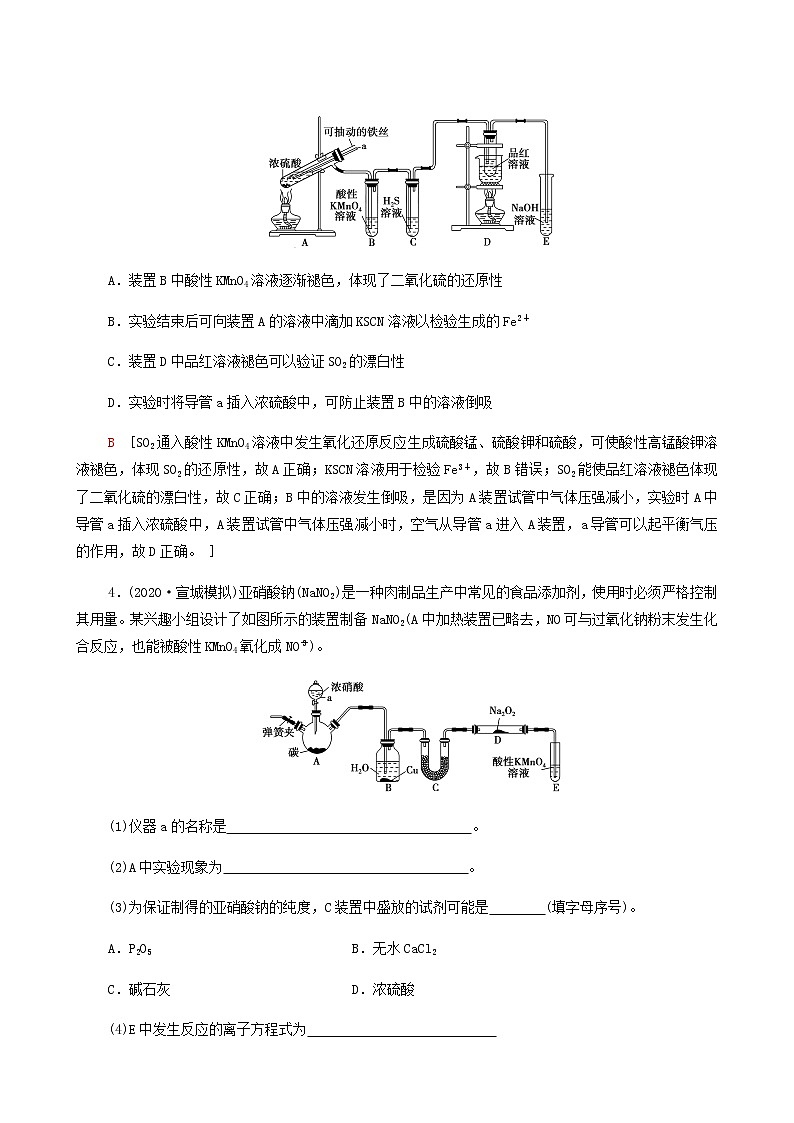
(2020·济南二中高三线上检测)实验室为探究铁与浓硫酸(足量)的反应,并验证SO2的性质,设计如图所示装置进行实验,下列说法不正确的是( )
A.装置B中酸性KMnO4溶液逐渐褪色,体现了二氧化硫的还原性
B.实验结束后可向装置A的溶液中滴加KSCN溶液以检验生成的Fe2+
C.装置D中品红溶液褪色可以验证SO2的漂白性
D.实验时将导管a插入浓硫酸中,可防止装置B中的溶液倒吸
B [SO2通入酸性KMnO4溶液中发生氧化还原反应生成硫酸锰、硫酸钾和硫酸,可使酸性高锰酸钾溶液褪色,体现SO2的还原性,故A正确;KSCN溶液用于检验Fe3+,故B错误;SO2能使品红溶液褪色体现了二氧化硫的漂白性,故C正确;B中的溶液发生倒吸,是因为A装置试管中气体压强减小,实验时A中导管a插入浓硫酸中,A装置试管中气体压强减小时,空气从导管a进入A装置,a导管可以起平衡气压的作用,故D正确。 ]
4.(2020·宣城模拟)亚硝酸钠(NaNO2)是一种肉制品生产中常见的食品添加剂,使用时必须严格控制其用量。某兴趣小组设计了如图所示的装置制备NaNO2(A中加热装置已略去,NO可与过氧化钠粉末发生化合反应,也能被酸性KMnO4氧化成NO)。
(1)仪器a的名称是 。
(2)A中实验现象为 。
(3)为保证制得的亚硝酸钠的纯度,C装置中盛放的试剂可能是 (填字母序号)。
A.P2O5 B.无水CaCl2
C.碱石灰 D.浓硫酸
(4)E中发生反应的离子方程式为
。
(5)从提高氮原子利用率的角度出发,其中B装置设计存在一定缺陷,如何改进?
。
[解析] 由实验装置可知,A中发生C+4HNO3(浓)CO2↑+4NO2↑+2H2O,B中稀释挥发的硝酸和将生成的二氧化氮与水反应转化为NO,C中固体干燥剂干燥NO,并除去可能混有的酸雾,D中发生2NO+Na2O2===2NaNO2,E中酸性高锰酸钾吸收尾气NO,结合氮及其化合物的性质分析解答。
(5)浓硝酸易挥发,A中生成的二氧化氮中一定有少量硝酸蒸气逸出,二氧化氮与水反应也会生成硝酸,B中铜与硝酸反应仍有硝酸根离子剩余,从提高氮原子利用率的角度出发,可以在B装置中加入一定的稀硫酸,使NO2全部转化为NO。
[答案] (1)分液漏斗 (2)剧烈反应,产生大量红棕色气体 (3)C (4)3MnO+4H++5NO===3Mn2++5NO+2H2O (5)在B装置中加入一定的稀硫酸,使NO2全部转化为NO
5.某研究性学习小组用如图实验装置探究CO和Fe2O3的实验(加热及夹持仪器省略)。
A B C D F
(1)向草酸(H2C2O4)中滴入浓硫酸,草酸分解为3种常见氧化物,写出装置A中反应的化学方程式:
。
(2)当 时,表明装置E中一定发生了化学反应。该套装置有一处明显的不当之处,请指出: ;
如何改进?
。
(3)为确定反应后装置E中得到的固体中是否只有Fe,该小组的同学提出了如下两种方案。
①取适量装置E中剩余固体溶于稀硫酸,然后加入几滴KSCN溶液,根据所得溶液是否显红色判断。判断能否达到目的并给出相应的理由:
。
②称量剩余固体的质量,当其质量等于 g时,表明反应后得到的固体只有Fe。
(4)若装置E中反应不充分,共得到固体12.16 g,则Fe2O3的转化率为 。
[解析] (1)由向草酸中滴加浓硫酸时,草酸分解为3种常见氧化物,可知草酸分解生成CO、CO2和H2O。(2)装置E中红棕色固体变成黑色或装置C中澄清石灰水不变浑浊而装置F中澄清石灰水变浑浊,均能表明装置E中一定发生了化学反应。CO是有毒气体,需进行尾气处理,故该实验装置中缺少尾气处理装置。为了处理未反应完全的CO,可在G处导管末端连接气球,用气球收集CO气体。(3)①若装置E中所得固体中混有少量的Fe2O3,Fe2O3溶于稀硫酸后转化成Fe3+,Fe3+能和Fe反应生成Fe2+,导致无法检测到Fe3+,故题中方案不能达到目的。②根据Fe2O3~2Fe可求出16.0 g Fe2O3完全被CO还原后所得固体的质量为11.2 g,即当剩余固体质量等于11.2 g时,表明装置E中所得固体只有Fe。(4)设转化的Fe2O3的质量为m(Fe2O3),生成铁的质量为m(Fe),根据差量法有如下关系:
Fe2O3 ~ 2Fe Δm
160 g 112 g 48 g
m(Fe2O3) m(Fe) (16.0-12.16)g
由=解得m(Fe2O3)=12.8 g,即Fe2O3的转化率为×100%=80%。
[答案] (1)H2C2O4H2O+CO↑+CO2↑
(2)装置E中的红棕色固体变成黑色(或装置C中澄清石灰水不变浑浊而装置F中澄清石灰水变浑浊) 缺少尾气处理装置 将G处的气体用气球收集(合理即可)
(3)①无法达到目的,因为固体中若含有少量Fe2O3,溶于稀硫酸后,Fe3+可被Fe还原为Fe2+,导致无法检测到Fe3+ ②11.2 (4)80%
6.为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验Ⅰ:一组同学按如图所示装置(固定装置已略去)进行实验。
A B C D E F
(1)A装置中反应的化学方程式为
。
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是 。
(3)为探究浓硫酸中的水是否影响B装置中现象的判断,还需进行一次实验。实验方案为
。
实验Ⅱ:另一组同学对铜与浓硫酸反应产生的黑色沉淀的成分进行探究,实验步骤如下:
ⅰ.将光亮铜丝插入浓硫酸中,加热;
ⅱ.待产生黑色沉淀和气体时,抽出铜丝,停止加热;
ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用。
查阅文献:检验Cu2+的方法是向试液中滴加K4[Fe(CN)6]溶液,若产生红棕色沉淀,证明试液中含有Cu2+。
(4)该组同学假设黑色沉淀是CuO。检验过程如下:
①将CuO放入稀硫酸中,一段时间后,再滴加K4[Fe(CN)6]溶液,产生红棕色沉淀。
②将黑色沉淀放入稀硫酸中,一段时间后,再滴加K4[Fe(CN)6]溶液,未见红棕色沉淀。由该检验过程所得结论是 。
(5)该组同学再次假设黑色沉淀是铜的硫化物。实验如下:
实验装置 | 现象 |
A B | a.A装置中试管内黑色沉淀逐渐溶解; b.A装置中试管内上方出现红棕色气体; c.B装置中试管内出现白色沉淀 |
①现象b说明黑色沉淀具有 性。
②能确认黑色沉淀中含有硫元素的现象是 (填“a”“b”或“c”),相应的离子方程式是
。
③为确认黑色沉淀是铜的硫化物,还需进行的实验操作是
。
[解析] 实验Ⅰ:(1)A装置中的反应是浓硫酸和铜加热反应生成硫酸铜、二氧化硫和水,反应的化学方程式为Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O。(2)证明浓硫酸中硫元素的氧化性强于氢元素,利用元素化合价变化生成的产物分析判断,若生成氢气,D装置中黑色固体变为红色,若生成二氧化硫,E装置中溶液会褪色,所以证明浓硫酸中硫元素的氧化性强于氢元素的实验现象是D装置中黑色固体不变化,E装置中溶液褪色。(3)利用装置中铜不与浓硫酸接触反应,即不放入铜丝进行实验,观察B装置中固体是否变蓝,若不变蓝说明浓硫酸中的水不影响实验,若变蓝,说明浓硫酸中的水会影响实验。
实验Ⅱ:(4)向试液中滴加K4[Fe(CN)6]溶液,若产生红棕色沉淀,证明试液中含有Cu2+,根据②将黑色沉淀放入稀硫酸中,一段时间后,滴加K4[Fe(CN)6]溶液,未见红棕色沉淀可知,黑色沉淀中一定不含CuO。(5)①A装置中试管内上方出现红棕色气体,说明反应中有一氧化氮生成,证明了黑色沉淀具有还原性,在反应中被氧化。②根据B装置中试管中出现白色沉淀可知,白色沉淀为硫酸钡,说明黑色沉淀中含有硫元素;发生反应的离子方程式为2NO+3SO2+3Ba2++2H2O===3BaSO4↓+2NO+4H+(或NO2+SO2+Ba2++H2O===BaSO4↓+NO+2H+)。③为确认黑色沉淀是铜的硫化物,还需检验黑色沉淀中含有铜离子,方法为取少量冷却后A装置试管中的溶液,滴加K4[Fe(CN)6]溶液,若产生红棕色沉淀,证明溶液中含有Cu2+,说明黑色沉淀是铜的硫化物。
[答案] (1)Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
(2)D装置中黑色固体颜色无变化,E装置中溶液褪色
(3)使用题述装置,不放入铜丝进行实验,观察B装置中固体是否变蓝
(4)黑色沉淀中不含有CuO
(5)①还原 ②c 2NO+3SO2+3Ba2++2H2O===3BaSO4↓+2NO+4H+(或NO2+SO2+Ba2++H2O===BaSO4↓+NO+2H+) ③取少量冷却后A装置试管中的溶液,滴加K4[Fe(CN)6]溶液,若产生红棕色沉淀,证明溶液中含有Cu2+,说明黑色沉淀是铜的硫化物
[教师用书备选]
(2018·全国卷Ⅱ,节选)K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为2K3[Fe(C2O4)3]2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为
。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按如图所示装置进行实验。
①通入氮气的目的是 。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有 、 。
③为防止倒吸,停止实验时应进行的操作是
。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是
。
[解析] (1)发生的显色反应是溶液中Fe2+与K3[Fe(CN)6]生成Fe3[Fe(CN)6]2,其化学方程式为3FeC2O4+2K3[Fe(CN)6]===Fe3[Fe(CN)6]2+3K2C2O4。(2)①实验时通入N2,不仅能隔绝空气,排除空气的干扰,还能使反应产生的气体全部进入后续装置。②实验中装置B中澄清石灰水变浑浊,说明三草酸合铁酸钾的热分解产物中含有CO2,经NaOH溶液可除去CO2,气体经浓硫酸干燥后,与灼热的CuO反应,得到单质Cu,且由装置F中现象可知装置E中又生成CO2,由此可判断热分解产物中还含有CO。③为防止倒吸,实验结束后,应先熄灭装置A、E两处的酒精灯,冷却后停止通入氮气。④要检验A中残留固体中含有Fe2O3,可取少量A中残留固体,加入足量稀硫酸或稀盐酸溶解,再滴入少许KSCN溶液,溶液中出现红色,即可确定残留固体中含有Fe2O3。
[答案] (1)3FeC2O4+2K3[Fe(CN)6]===Fe3[Fe(CN)6]2+3K2C2O4
(2)①隔绝空气、使反应产生的气体全部进入后续装置
②CO2 CO
③先熄灭装置A、E的酒精灯,冷却后停止通入氮气
④取少许固体粉末于试管中,加稀硫酸溶解,滴入1~2滴KSCN溶液,溶液变红色,证明含有Fe2O3
7.高纯度单晶硅是典型的无机非金属材料,是制备半导体的重要材料。高纯硅通常用以下方法制备:用碳在高温下还原二氧化硅制得粗硅(含Fe、Al、B、P等杂质),粗硅与氯气反应生成四氯化硅(反应温度为450~500 ℃),四氯化硅经提纯后用氢气还原可得高纯硅。实验室制备四氯化硅的装置如图所示。
A B C D Ⅰ Ⅱ
相关信息:a.四氯化硅遇水极易水解;b.硼、铝、铁、磷在高温下均能与氯气直接化合生成相应的氯化物;c.有关物质的相关物理常数如表所示。
物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | 12.8 | - | 315 | - |
熔点/℃ | -70.0 | -107.2 | - | - | - |
升华温度/℃ | - | - | 180 | 300 | 162 |
请回答下列问题:
(1)仪器e的名称为 ,装置A中f管的作用是 ,
装置A中发生反应的离子方程式为
。
(2)装置B中的试剂是 。
(3)某化学学习小组同学设计了以下两种实验方案,方案甲:g端接装置Ⅰ;方案乙:g端接装置Ⅱ。但是甲、乙两个方案中虚线内装置均有不足之处,请你评价后填写下表。
方案 | 不足之处 |
甲 |
|
乙 |
|
(4)在上述(3)的评价基础上,请设计一个合理方案:
。
(5)通过上述合理的装置制取并收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外还可能含有的杂质是 (填元素符号)。
[解析] (1)根据仪器的结构可知,仪器e是蒸馏烧瓶。f管将分液漏斗与蒸馏烧瓶相连,则它们中的压强相等,这样便于分液漏斗中的浓盐酸顺利滴下;实验室用浓盐酸与二氧化锰在加热的条件下制备氯气,因此该反应的离子方程式为MnO2+4H++2Cl-Mn2++2H2O+Cl2↑。(2)由于浓盐酸易挥发,生成的氯气中含有氯化氢,对后续的实验造成干扰,需要除去氯化氢,因此装置B中的试剂是饱和食盐水。(3)四氯化硅的沸点只有57.7 ℃,而反应的温度达几百摄氏度,故需要冷凝收集,又因为四氯化硅极易水解,而甲方案中g端接装置Ⅰ,i端与空气直接相连,则空气中的水蒸气进入产品收集装置,使产品水解;另外氯气有毒,需要处理尾气,而甲方案中没有尾气处理装置,氯气会污染空气;在乙方案中g端接装置Ⅱ,由于四氯化硅冷凝后变为固体,易堵塞导管口,另外没有冷凝装置,产品易损失。(4)由于四氯化硅极易水解,因此需要有干燥装置,所以在甲方案的基础上,在装置Ⅰ的i端连接干燥管j即可。(5)由题给表格信息知,AlCl3、FeCl3和PCl5均易升华,故精馏后的残留物中,除铁元素外还可能含有的杂质是Al、P、Cl。
[答案] (1)蒸馏烧瓶 平衡压强,使液体从分液漏斗中顺利滴下 MnO2+4H++2Cl-Mn2++2H2O+Cl2↑ (2)饱和食盐水
(3)
方案 | 不足之处 |
甲 | ①空气中的水蒸气进入产品收集装置,使产品水解; ②没有尾气处理装置,氯气会污染空气 |
乙 | ①收集产品的导管太细,易堵塞; ②没有冷凝装置,产品易损失 |
(4)在装置Ⅰ的i端连接干燥管j (5)Al、P、Cl
相关试卷
这是一份人教版高考化学一轮总复习课时质量评价39化学实验方案的设计与评价含答案,共8页。试卷主要包含了选择题,不定项选择题,非选择题等内容,欢迎下载使用。
这是一份高考化学一轮复习课后限时集训2物质的量在化学实验中的应用含答案,共8页。
这是一份人教版高考化学一轮复习限时集训36化学实验方案的设计与评价含答案,共11页。












