














2023版创新设计高考化学(新教材鲁科版)总复习一轮课件第4章 化学与社会发展
展开【课标要求】 1.以海水的开发利用为例,了解物质性质及变化,了解综合利用资源和能源的方法。2.了解卤族元素性质及递变规律。
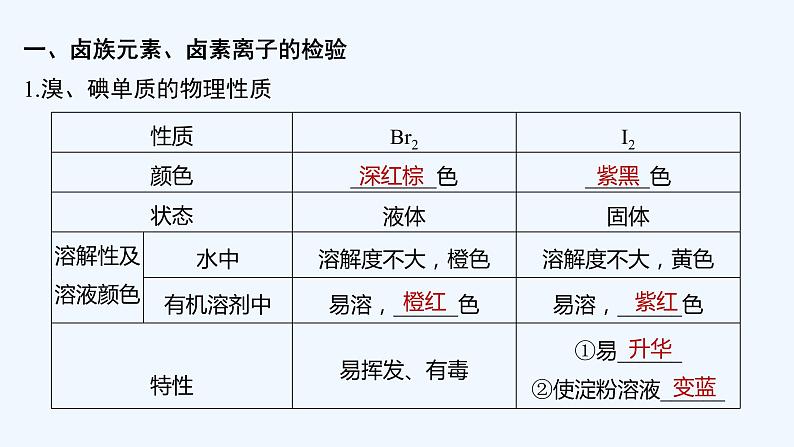
一、卤族元素、卤素离子的检验1.溴、碘单质的物理性质
2.卤素单质化学性质的相似性
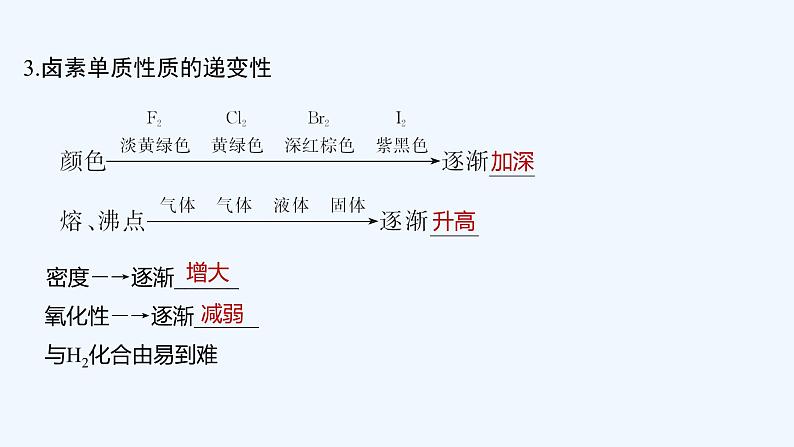
3.卤素单质性质的递变性 密度―→逐渐______ 氧化性―→逐渐______ 与H2化合由易到难
(1)F无正价,F2与H2反应在暗处即爆炸,F2与水剧烈反应,化学方程式:_________________________。(2)Br2是常温下唯一呈液态的非金属单质;液溴通常用水封保存,不能用橡胶塞。(3)CaX2中只有CaF2难溶于水,其他均易溶于水,AgX中只有AgF易溶于水,其他均难溶于水。
2F2+2H2O===4HF+O2
5.卤素离子的检验 (1)AgNO3溶液——沉淀法
【诊断1】 判断下列叙述的正误(正确的划“√”,错误的划“×”)。(1)加碘盐能使淀粉变蓝( )(2)向无色溶液中滴加氯水和CCl4,振荡,静置,下层溶液显紫色说明原溶液中有I-( )(3)卤素气态氢化物的水溶液都是强酸( )(4)类比Fe与Cl2的反应判断Fe与I2反应时生成FeI3( )
二、碘、溴和镁的提取1.海带提碘 (1)基本步骤 实验室里,从海带灰中提取碘单质包括浸取、过滤、氧化、萃取四个步骤。 (2)工艺流程
(3)两种原理①主要的化学原理:2I-+Cl2===2Cl-+I2。②主要的物理原理:单质碘用苯或CCl4萃取、分液后用蒸馏法将碘与有机溶剂分开。(4)反萃取法提取碘碘与NaOH浓溶液发生反应:____________________________________。
3I2+6NaOH===5NaI+NaIO3+3H2O
(1)基本步骤从海水中提取溴,一般要经历浓缩、氧化和提取三个步骤。(2)工艺流程
(3)主要过程及反应原理
Cl2+2Br-===Br2+2Cl-
2HBr+Cl2===2HCl+Br2
3.从海水中提取镁 (1)工艺流程
(2)基本步骤及主要反应
由MgCl2·6H2O到无水MgCl2,必须在HCl的气流中加热,以抑制MgCl2水解。
考点二 从海水中提取化学物质
考点一 卤族元素、卤素离子的检验
【题组训练】1.下列有关卤素的说法错误的是 ( )
A.从HF、HCl、HBr、HI酸性递增的事实,可推出F、Cl、Br、I的非金属性递增的规律B.HF、HCl、HBr、HI的热稳定性依次减弱,还原性依次增强C.淀粉碘化钾溶液在空气中变蓝,4I-+O2+2H2O===2I2+4OH-D.碘在碘化钾溶液中的溶解度大于在纯水中的溶解度
2.(双选)下列叙述中正确的是( )
A.能使湿润的淀粉-KI试纸变成蓝色的物质一定是Cl2B.用硝酸酸化的硝酸银溶液能一次鉴别NaCl、NaBr、KI三种失去标签的溶液C.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-D.某浅黄色的溴水,加入CCl4振荡静置后,下层显橙红色解析 还有很多氧化剂(如HNO3、O3等)能将I-氧化为I2,A项错误;碘单质的CCl4溶液显紫红色,C项错误;CCl4的密度比水大,下层显橙红色,D项正确。
【题组训练】1.为了从海带浸取液中提取碘,某同学设计了如图实验方案,下列说法正确的是( )
A.①中反应的离子方程式:2I-+H2O2===I2+2OH-B.②中分液时含I2的CCl4溶液从分液漏斗上口倒出C.③中得到的上层溶液中含有I-D.操作Z的名称是加热解析 反应为酸性环境,①中反应的离子方程式:2I-+2H++H2O2===I2+2H2O,故A错误;四氯化碳比水的密度大,在下层,②中分液时含I2的CCl4溶液从分液漏斗下口放出,故B错误;操作Z的名称是过滤,故D错误。
2.从淡化海水中提取溴的流程如下:
下列有关说法不正确的是( )A.X试剂可用Na2SO3饱和溶液B.步骤Ⅲ的离子方程式:2Br-+Cl2===2Cl-+Br2C.工业上每获得1 ml Br2,需要消耗Cl2 44.8 LD.步骤Ⅳ包含萃取、分液和蒸馏
解析 Na2SO3+Br2+H2O===Na2SO4+2HBr,A正确;步骤Ⅲ利用氯的非金属性比溴的强,利用置换反应制取Br2,B正确;反应Ⅰ和反应Ⅲ均使用到Cl2,故制取1 ml Br2消耗2 ml 氯气,但未标明氯气所处的温度和压强,C错误;从浓溴水中提取溴,可利用有机溶剂(如苯)萃取溴,然后分液得到溴的有机溶液,再经蒸馏可得纯净的溴,D正确。
1.(双选)(高考题组合)下列说法正确的是( )
A.(2021·浙江6月选考)工业上可用离子交换法提高海带中碘的提取率B.(2021·浙江1月选考)通常以海水提取粗食盐后的母液为原料制取溴C.(2021·广东卷)将溴水滴入KI溶液中,加入乙醇并振荡萃取溶液中生成的碘D.(2021·河北卷)加热NaI与浓H3PO4混合物可制备HI,说明H3PO4比HI酸性强
解析 离子交换法可以很大程度地提取海水中的I-,还可以起到富集低浓度I-的作用,可以提高海水中碘的提取率,A正确;海水提取粗食盐后的母液属于浓缩的海水,其中溴化物的浓度较高,因此,通常以海水提取粗食盐后的母液为原料制取溴,B说法正确;乙醇与水互溶,不能作碘单质的萃取剂,C错误;HI的沸点低,易挥发加热NaI与浓H3PO4混合物发生反应生成HI利用的是高沸点酸制备低沸点酸的原理,D错误。
2.(2021·湖南卷)一种工业制备无水氯化镁的工艺流程如下:
3.(2021·全国甲卷)碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题: (1)I2的一种制备方法如下图所示:
①加入Fe粉进行转化反应的离子方程式为________________________,生成 的沉淀与硝酸反应,生成________后可循环使用。②通入Cl2的过程中,若氧化产物只有一种,反应的化学方程式为________________________;若反应物用量比n(Cl2)/n(FeI2)=1.5时,氧化产物为________;当n(Cl2)/n(FeI2)>1.5后,单质碘的收率会降低,原因是_____________________________________________________________。答案 (1)①2AgI+Fe===2Ag+Fe2++2I- AgNO3 ②FeI2+Cl2===I2+FeCl2 I2、FeCl3 I2被进一步氧化
1.下列关于卤素的叙述正确的是( )
①卤素的钾盐中,最易被氧化的是氟化钾②溴中溶有少量氯气,可以用加入溴化钠再用汽油萃取的方法提纯③溴化银具有感光性,碘化银不具有感光性④某溶液与淀粉-KI溶液反应出现蓝色,则证明该溶液是氯水或溴水⑤氟气跟氯化钠水溶液反应,一定有氟化氢和氧气生成⑥氯气跟水反应时,水既不是氧化剂也不是还原剂A.①③⑤ B.②③⑥C.②⑤⑥ D.①③④
解析 易被氧化的物质应具有较强的还原性,卤素离子中,I-的还原性最强,故卤素的钾盐中,最易被氧化的是KI,①错误;卤化银中除AgF外均有感光性,③错误;能与淀粉-KI溶液反应出现蓝色现象的,除氯水或溴水外,还可以是碘水等,④错误。
2.下列叙述中正确的是( )
A.氯水久置过程中,氯水的氧化性增强,酸性减弱B.用硝酸酸化的AgNO3溶液能一次鉴别NaCl、NaBr、KI三种失去标签的溶液C.向某溶液中加入CCl4,振荡、静置后,CCl4层显紫红色,证明原溶液中存在I-D.某浅黄色的溴水,加CCl4振荡、静置后,上层显橙红色
3.鉴别NaCl溶液、NaBr溶液、NaI溶液可以选用的试剂是( ) ①碘水、淀粉溶液 ②氯水、CCl4 ③溴水、苯 ④硝酸、AgNO3溶液 ⑤氯水、苯 ⑥CCl4、淀粉溶液 A.①②④B.②③⑥ C.②④⑤D.④⑤⑥ 解析 ①无法鉴别三种溶液,③无法鉴别NaCl和NaBr溶液,⑥无法鉴别三种溶液。
4.某化学小组用如图所示装置验证卤素单质氧化性的相对强弱。下列说法不正确的是( )
A.E处棉花球变成黄色,说明Cl2的氧化性比Br2强B.F处棉花球变成蓝色,说明Br2的氧化性比I2强C.E处发生反应的离子方程式为Cl2+2Br-===2Cl-+Br2D.G装置中NaOH溶液与Cl2反应的离子方程式为2OH-+Cl2===ClO-+Cl-+H2O
解析 在F处,可能是未反应完的Cl2与KI发生反应置换出I2,使淀粉变蓝色,不能说明Br2的氧化性比I2强。
5.(2021·昆明模拟)下列从海带中提取碘的实验操作或现象错误的是( )
A.用甲装置灼烧酒精润湿的海带碎片至灰烬B.将海带灰在烧杯中加水煮沸后用乙装置过滤C.滤液滴加稀硫酸及双氧水后,用CCl4按丙装置萃取,上层溶液呈紫红色D.用丁装置进行减压蒸馏,分离CCl4与碘单质
解析 A.灼烧在坩埚中进行,则甲装置可灼烧酒精润湿的海带碎片至灰烬,故A正确;B.过滤可分离出含碘离子的溶液,则用乙装置过滤,故B正确; C.四氯化碳的密度比水的密度大,则丙装置萃取,下层溶液呈紫红色,故C错误;D.减压蒸馏可降低沸点,则丁装置进行减压蒸馏可分离CCl4与碘单质,故D正确。
6.工业海水提溴时,下列操作步骤与目的均正确的是( )
解析 A.浓缩海水提高c(Br-),n(Br-)不变,故A错误;B.通入氯气发生Cl2+2Br-===Br2+2Cl-,氧化溴离子,故B错误;C.溴易挥发,热空气可吹出溴,故C正确;D.CCl4萃取可分离溴与水溶液,故D错误。
7.(2021·徐州模拟)一种从卤水中提取碘的实验流程如图,下列说法错误的是( )
A.①~④是为了富集碘B.③、④、⑥工艺过程主要发生物理变化C.⑤的反应中,氧化剂与还原剂物质的量之 比为1∶6D.⑥可用如图所示装置进行
8.海水开发利用的部分过程如图所示。下列说法错误的是( )
A.向苦卤中通入Cl2是为了提取溴B.粗盐可采用除杂和重结晶等过程提纯C.工业生产中常选用NaOH作为沉淀剂D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
解析 A项,向苦卤中通入Cl2时发生反应Cl2+2Br-===2Cl-+Br2,故其目的是为了提取溴,正确;B项,可将粗盐溶解、过滤除去难溶性杂质,然后向滤液中加入沉淀剂,过滤后调节滤液pH以除去可溶性杂质,最后重结晶可得精盐,正确;C项,工业生产中常选用廉价的Ca(OH)2作为沉淀剂,错误;D项,由于通入Cl2后所得溶液中Br2的浓度很小,因此利用Br2的挥发性,可先用热空气和水蒸气吹出Br2,再用SO2将其还原为HBr进行富集,正确。
9.(2021·丰台模拟)“空气吹出法”海水提溴的工艺流程如图。下列说法不正确的是( )
A.向浓缩海水中通入Cl2时,溴元素的化合价升高被氧化B.空气吹出法利用了溴单质的挥发性C.在吸收塔中Br2与SO2发生反应以达到富集目的D.从蒸馏塔中出来后的操作为萃取
解析 A.浓缩酸化后的海水中含溴离子,通入氯气发生2Br-+Cl2===2Cl-+Br2,溴元素的化合价升高被氧化,故A正确;B.溴单质易挥发,可利用空气吹出,故B正确;C.海水中溴离子浓度较低,经过吸收塔后Br2与SO2发生反应,溴元素得到富集,故C正确;D.在蒸馏塔中氯气与HBr反应生成溴,然后蒸馏分离出溴,故D错误。
10.向溶质为FeBr2、FeI2的溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,结果溶液变为红色,则下列叙述不正确的是( )
A.原溶液中的Br-不一定被氧化B.通入氯气之后原溶液中的Fe2+一定被氧化C.不能确定通入氯气之后的溶液中是否存在Fe2+D.若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3溶液,能产生淡黄色沉淀
解析 还原性:I- >Fe2+>Br-,向反应后的溶液中滴加KSCN溶液,结果溶液变为红色,说明Fe2+部分或全部被氧化,Br-可能被氧化,A、B正确;通入氯气之后原溶液中的Fe2+部分或全部被氧化,所以不能确定通入氯气之后的溶液中是否存在Fe2+,C正确;若Br-全部被氧化生成Br2,则萃取后加入硝酸银,没有淡黄色沉淀生成,D错误。
11.海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料。如图是海水综合利用的部分流程图,据图回答问题:
(4)也有工艺是在吹出Br2后用碳酸钠溶液吸收,生成溴化钠和溴酸钠,同时有CO2放出,该反应的离子方程式是_______________________;最后再用H2SO4处理得到Br2,之后加入CCl4进行Br2的萃取,最终用________方法得到单质Br2。
12.为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验过程:Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。Ⅳ.……
(1)A中产生黄绿色气体,其电子式是____________。(2)验证氯气的氧化性强于碘的实验现象是________________________。(3)B中溶液发生反应的离子方程式是__________________________________。(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是____________________。(5)过程Ⅲ实验的目的是______________________________________________。
解析 A中滴加浓盐酸后,发生反应:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,生成黄绿色气体Cl2,在A、B、C中分别发生反应:Cl2+2KI===2KCl+I2、Cl2+2NaBr===2NaCl+Br2、Cl2+2NaBr===2NaCl+Br2,由于B、C中生成了Br2而使溶液变为黄色,打开活塞b,C中生成的Br2在D中发生反应:Br2+2KI===2KBr+I2。实验过程Ⅲ,当B中黄色溶液继续通入过量Cl2时,溶液变为红棕色,以此为对照,说明C中黄色溶液无Cl2,从而排除Cl2对溴置换碘实验的干扰。
13.(双选)(2021·龙岩模拟)海洋中有丰富的资源,如图为海水利用的部分过程。下列有关说法不正确的是( )
A.欲获得淡化海水,离子交换膜a、b分别选择阴、阳离子交换膜B.通电时,阴极区附近溶液的pH增C.电解NaCl溶液可制备金属钠D.海水中的重水(含HDO 0.03%)与H2O化学性质不同
14.(2021·襄阳模拟)海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )
解析 A.左侧阳极上氢氧根离子失去电子,钠离子向浓缩室移动;右侧阴极上氢离子得到电子,氯离子向浓缩室移动,则离子交换膜a、b分别选择阳、阴离子交换膜,故A错误;B.阴极上氢离子得到电子,氢氧根离子增多,则阴极区附近溶液的pH增大,故B正确;C.电解氯化钠溶液生成NaOH、氢气、氯气,应电解熔融氯化钠生成Na,故C错误;D.HDO与H2O均为水,H、D互为同位素,化学性质相似,故D错误。
15.(2021·梅州模拟)某研究性学习小组同学取V L浓缩的海水,用如图1所示装置模拟工业法提溴。回答下列问题:
(1)装置A可用于实验室制备氯气,装置B是SO2贮气瓶,则Q中的溶液为________。(2)溴的富集过程:①通入氯气与通入热空气的顺序是先通________________,通入氯气时K1、K2、K3的关、开方式是________________。②装置D的作用是_________________________________________,通入SO2时装置E中发生反应的化学方程式为_______________________________。答案 (1)饱和NaHSO3溶液 (2)①Cl2或氯气 关闭K1、K3,打开K2 ②吸收尾气,防止其污染空气 SO2+Br2+2H2O===2HBr+H2SO4
答案 (4)KOH 蒸发 取样于试管中,加少量水充分溶解,滴加硝酸酸化的AgNO3溶液,产生白色沉淀
2023版创新设计高考化学(新教材鲁科版)总复习一轮课件第10章 有机化学基础: 这是一份2023版创新设计高考化学(新教材鲁科版)总复习一轮课件第10章 有机化学基础,文件包含2023版创新设计高考化学新教材鲁科版总复习一轮讲义第2讲烃化石燃料pptx、2023版创新设计高考化学新教材鲁科版总复习一轮讲义第1讲认识有机化学pptx、2023版创新设计高考化学新教材鲁科版总复习一轮讲义第3讲烃的衍生物pptx、2023版创新设计高考化学新教材鲁科版总复习一轮讲义第4讲有机合成及其应用合成高分子化合物pptx、2023版创新设计高考化学新教材鲁科版总复习一轮讲义本章必备重要有机转化关系及反应方程式书写强化练pptx等5份课件配套教学资源,其中PPT共258页, 欢迎下载使用。
2023版创新设计高考化学(新教材鲁科版)总复习一轮课件第9章 化学实验: 这是一份2023版创新设计高考化学(新教材鲁科版)总复习一轮课件第9章 化学实验,文件包含2023版创新设计高考化学新教材鲁科版总复习一轮讲义第1讲化学实验常用仪器和基本操作pptx、2023版创新设计高考化学新教材鲁科版总复习一轮讲义第2讲物质的分离与提纯pptx、2023版创新设计高考化学新教材鲁科版总复习一轮讲义第3讲高考化学综合实验题探究pptx等3份课件配套教学资源,其中PPT共180页, 欢迎下载使用。
2023版创新设计高考化学(新教材鲁科版)总复习一轮课件第8章 物质在水溶液中的行为: 这是一份2023版创新设计高考化学(新教材鲁科版)总复习一轮课件第8章 物质在水溶液中的行为,文件包含2023版创新设计高考化学新教材鲁科版总复习一轮讲义第2讲弱电解质的电离pptx、2023版创新设计高考化学新教材鲁科版总复习一轮讲义第1讲水和水溶液pptx、2023版创新设计高考化学新教材鲁科版总复习一轮讲义第3讲盐类的水解pptx、2023版创新设计高考化学新教材鲁科版总复习一轮讲义第4讲沉淀溶解平衡pptx、2023版创新设计高考化学新教材鲁科版总复习一轮讲义本章简答题答题语言规范强化练pptx等5份课件配套教学资源,其中PPT共253页, 欢迎下载使用。












