
安徽省凤阳县2023届高三(上)摸底检测化学试题(word版,含答案)
展开安徽省凤阳县2023届高三(上)摸底检测
理科综合(化学试题)
注意事项:
1.答题前,考生务必将自己的学校、姓名、班级、准考证号填写在答题卡上相应的位置。
2.全部答案在答题卡上完成,答在本试卷上无效。
3.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案用0.5毫米及以上黑色笔迹签字笔写在答题卡上。
4.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Al-27 S-32 Cl-35.5 Ti-48 Zn-65
第Ⅰ卷(选择题 共42分)
一、选择题(本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项符合题目要求.)
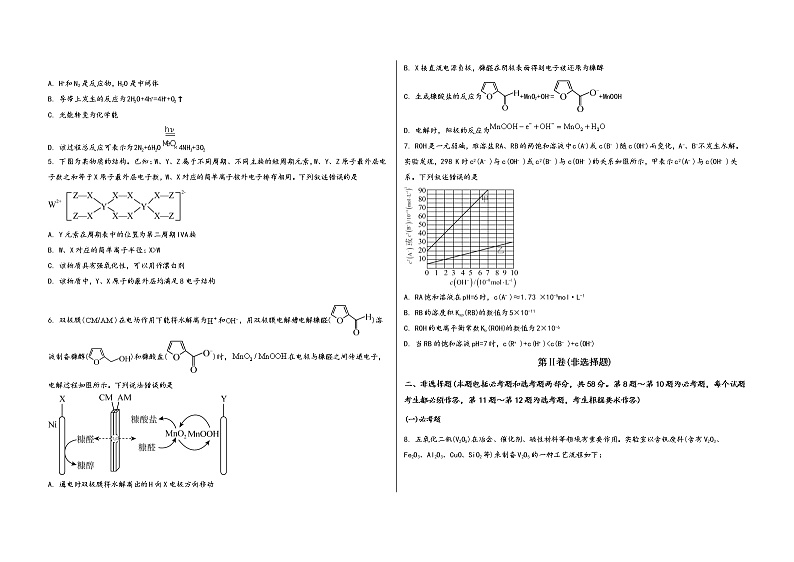
1. 下列说法 正确的是
A. 冬奥会使用的二氧化碳跨临界制冰技术,与传统制冷剂氟利昂相比更加环保
B. 冬奥火炬“飞扬”采用碳纤维复合材料打造,碳纤维是一种高分子材料
C. 颁奖礼仪服采用第二代石墨烯发热材料,石墨烯属于烯烃
D. “同心”奖牌挂带采用桑蚕丝织造工艺,蚕丝属于化学纤维
2. 普黄酮是一种抗骨质疏松的药物,其结构简式如下,下列有关说法不正确的是
A. 该化合物的分子式为C18H16O3
B. 该化合物能发生加成反应、水解反应、氧化反应
C. 该化合物分子中所有碳原子不可能共面
D. 该化合物一氯代物有9种(不考虑空间异构)
3. 碘仿(CHI3)是一种外用消毒剂。某实验小组通过电解KI和丙酮(CH3COCH3)来制备碘仿。制得的粗碘仿中含少量石墨粉,分离提纯碘仿的操作中,下列仪器没有用到的是
已知几种物质的部分性质如表所示:
物质 | 熔点/℃ | 沸点/℃ | 溶解性 |
丙酮 | -95 | 56 | 与水、乙醇互溶 |
碘仿 | 123 | 218 | 不溶于水,溶于热乙醇 |
A. B.
C. D.
4. 一种基于光催化剂MeOx(某金属氧化物)催化氮还原制取氨的反应过程如图所示(图中h+表示空穴),下列说法错误的是
A. H+和N2是反应物,H2O是中间体
B. 导带上发生的反应为2H2O+4h+=4H++O2↑
C. 光能转变为化学能
D. 该过程总反应可表示为2N2+6H2O4NH3+3O2
5. 下图为某物质的结构。已知:W、Y、Z属于不同周期、不同主族的短周期元素,W、Y、Z原子最外层电子数之和等于X原子最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述错误的是
A. Y元素在周期表中的位置为第二周期IVA族
B. W、X对应的简单离子半径:X>W
C. 该物质具有强氧化性,可以用作漂白剂
D. 该物质中,Y、X原子的最外层均满足8电子结构
6. 双极膜()在电场作用下能将水解离为和,用双极膜电解槽电解糠醛()溶液制备糠醇()和糠酸盐()时,在电极与糠醛之间传递电子,电解过程如图所示。下列说法错误的是
A. 通电时双极膜将水解离出的H向X电极方向移动
B. X接直流电源负极,糠醛在阴极表面得到电子被还原为糠醇
C. 生成糠酸盐的反应为+MnO2+OH-=+MnOOH
D. 电解时,阳极的反应为
7. ROH是一元弱碱,难溶盐RA、RB的两饱和溶液中c(A-)或c(B- )随c(OH-)而变化,A-、B-不发生水解。实验发现,298 K时c2(A- )与c(OH- )或c2(B- )与c(OH- )的关系如图所示,甲表示c2(A- )与c(OH- )关系。下列叙述错误的是
A. RA饱和溶液在pH=6时,c(A- )≈1.73 ×10-5mol·L-1
B. RB的溶度积Ksp(RB)的数值为5×10-11
C. ROH的电离平衡常数Kb(ROH)的数值为2×10-6
D. 当RB的饱和溶液pH=7时,c(R+ )+c(H+ )<c(B- )+c(OH-)
第Ⅱ卷(非选择题)
二、非选择题(本题包括必考题和选考题两部分,共58分。第8题~第10题为必考题,每个试题考生都必须作答,第11题~第12题为选考题,考生根据要求作答)
(一)必考题
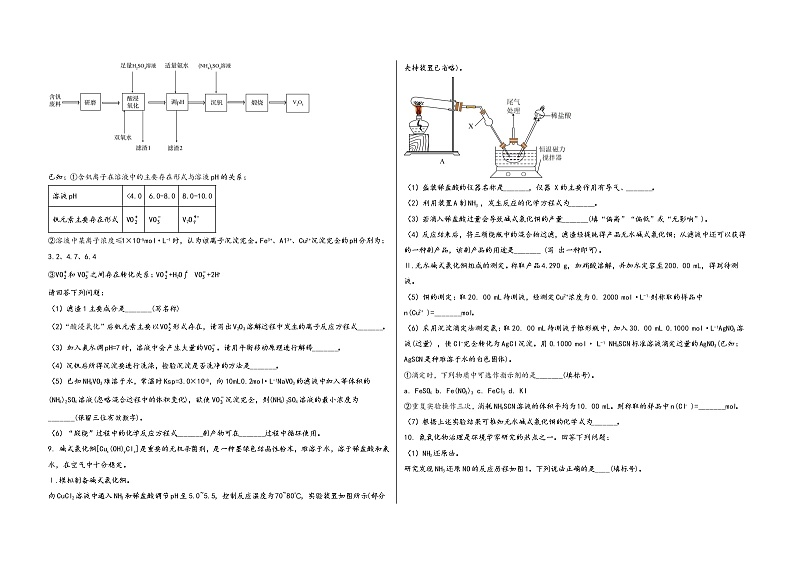
8. 五氧化二钒(V2O5)在冶金、催化剂、磁性材料等领域有重要作用。实验室以含钒废料(含有V2O3、Fe2O3、Al2O3、CuO、SiO2等)来制备V2O5的一种工艺流程如下:
已知:①含钒离子在溶液中的主要存在形式与溶液pH的关系:
溶液pH | <4.0 | 6.0-8.0 | 8.0-10.0 |
钒元素主要存在形式 | VO | VO | V2O |
②溶液中某离子浓度≤1×10-5mol·L-1时,认为该离子沉淀完全。Fe3+、A13+、Cu2+沉淀完全的pH分别为:3.2、4.7、6.4
③VO和VO之间存在转化关系:VO+H2OVO+2H+
请回答下列问题:
(1)滤渣1主要成分是_______(写名称)
(2)“酸浸氧化”后钒元素主要以VO形式存在,请写出V2O3溶解过程中发生的离子反应方程式_______。
(3)加入氨水调pH=7时,溶液中会产生大量的VO。请用平衡移动原理进行解释_______。
(4)沉钒后所得沉淀要进行洗涤,检验沉淀是否洗净的方法是_______。
(5)已知NH4VO3难溶于水,常温时Ksp=3.0×10-8,向10mL0.2mol·L-1NaVO3的滤液中加入等体积的(NH4)2SO4溶液(忽略混合过程中的体积变化),欲使VO沉淀完全,则(NH4)2SO4溶液的最小浓度为_______(保留三位有效数字)。
(6)“煅烧”过程中的化学反应方程式_______副产物可在_______过程中循环使用。
9. 碱式氯化铜[Cux(OH)yClz]是重要的无机杀菌剂,是一种墨绿色结晶性粉末,难溶于水,溶于稀盐酸和氨水,在空气中十分稳定。
Ⅰ.模拟制备碱式氯化铜。
向CuCl2溶液中通入NH3和稀盐酸调节pH至5.0~5.5,控制反应温度为70~80℃,实验装置如图所示(部分夹持装置已省略)。
(1)盛装稀盐酸的仪器名称是_______,仪器 X的主要作用有导气、_______。
(2)利用装置A制NH3 ,发生反应的化学方程式为_______。
(3)若滴入稀盐酸过量会导致碱式氯化铜的产量_______(填“偏高”“偏低”或“无影响”)。
(4)反应结束后,将三颈烧瓶中的混合物过滤,滤渣经提纯得产品无水碱式氯化铜;从滤液中还可以获得的一种副产品,该副产品的用途是_______ (写 出一种即可)。
Ⅱ.无水碱式氯化铜组成的测定。称取产品4.290 g,加硝酸溶解,并加水定容至200. 00 mL,得到待测液。
(5)铜的测定:取20. 00 mL待测液,经测定Cu2+浓度为0. 2000 mol·L-1.则称取的样品中n(Cu2+ )=_______mol。
(6)采用沉淀滴定法测定氯:取20. 00 mL待测液于锥形瓶中,加入30. 00 mL 0.1000 mol·L-1AgNO3溶液(过量) ,使Cl-完全转化为AgCl沉淀。用0.1000 mol· L-1 NH4SCN标准溶液滴定过量的AgNO3(已知:AgSCN是种难溶于水的白色固体)。
①滴定时,下列物质中可选作指示剂的是_______(填标号)。
a. FeSO4 b. Fe(NO3)3 c. FeCl3 d. KI
②重复实验操作三次,消耗NH4SCN溶液的体积平均为10. 00 mL。则称取的样品中n(Cl- )=_______mol。
(7)根据上述实验结果可推知无水碱式氯化铜的化学式为_______。
10. 氮氧化物治理是环境学家研究的热点之一。回答下列问题:
(1)NH3还原法。
研究发现NH3还原NO的反应历程如图1。下列说法正确的是____(填标号)。
A.Fe3+能降低总反应的活化能,提高反应速率
B.总反应为6NO+4NH3=5N2+6H2O
C.该反应历程中形成了非极性键和极性键
(2)已知有关反应如下:
①C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1
②CO2(g)+C(s)=2CO(g) ΔH2=+172.5kJ·mol-1
③NO和CO反应的能量变化如图2所示。
2NO(g)=N2(g)+O2(g) ΔH=____kJ·mol-1。
(3)H2还原法。
已知催化剂Rh表面H2催化还原NO的反应机理如表所示,其他条件一定时,决定H2的催化还原NO反应速率的基元反应为____(填序号)。
序号 | 基元反应 | 活化能Ea/(kJ·mol-1) |
① | H2(g)+Rh(s)+Rh(s)=H(s)+H(s) | 12.6 |
② | 2NO(g)+Rh(s)=2NO(s) | 0.0 |
③ | NO(s)+Rh(s)=N(s)+O(s) | 97.5 |
④ | H(s)+O(s)=OH(s)+Rh(s) | 83.7 |
⑤ | HO(s)+H(s)=H2O(s)+Rh(s) | 33.5 |
⑥ | H2O(s)=H2O(g)+Rh(s) | 45.0 |
⑦ | N(s)+N(s)=N2(s)+Rh(s)+Rh(s) | 120.9 |
注明:N2(s)表示N2被吸附在Rh表面上。
(4)CO还原法。
一定温度下,在刚性密闭容器中充入1molNO(g)和1molCO(g)发生反应:2NO(g)+2CO(g)N2(g)+2CO2(g)。达到平衡后,再充入amolNO(g)和amolCO(g),NO的平衡转化率____(“增大”、“减小”或“不变”,下同),气体总压强____。
(5)甲烷还原法。
一定温度下,在2.0L刚性密闭容器中充入1molCH4和2molNO2,发生反应:CH4(g)+2NO2(g)CO2(g)+N2(g)+2H2O(g)。测得反应时间(t)与容器内气体总压强(p)的变化如表所示。
反应时间(t)/min | 0 | 2 | 4 | 6 | 8 | 10 |
p/(100kPa) | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
达到平衡时,NO2的转化率为____。若起始时加入3molCH4和2molNO2,则在该温度下的压强平衡常数Kp=____(以分压表示的平衡常数为Kp,分压=总压×物质的量分数)kPa。
(6)电解氧化吸收法。电解0.1mol·L-1的NaCl溶液时,溶液中相关成分的质量浓度与电流强度的变化关系如图3。当电流强度为4A时,吸收NO的主要反应的离子方程式为____(NO最终转化为NO)
(二)选考题(.请考生从给出的2道题任选一题作答,并用2B铅笔在答题卡上把所选题目题号后的方框涂黑。注意所做题目的题号必修与所涂题目的题号一致,并且在解答过程中写清每问的小题号,在答题卡指定位置答题。如果多做,则每学科按所做的第一题计分。
【化学--选修3:物质结构与性质】
11. 目前已经确认了16种元素是植物生长所必需的,其中硼、铁、铜、钼等7种元素为必需的微量元素。回答下列问题:
(1)钼位于第5周期与Cr同族,试写出钼的基态价电子排布式_______,钼位于周期表第_______纵行。
(2)铁元素能与多种分子或离子形成配位键,如[FeCl2(H2O)4]+、Fe(CO)5。
①[FeCl2(H2O)4]+中每个H2O的O周围σ键电子对有_______对,游离态的水中H-O-H的键角比该配离子中H-O-H的键角小,其原因是_______。
②CO分子中C原子和O原子,上均存在孤电子对,在Fe(CO)5中_______(填元素符号)更容易Fe提供孤电子对。
(3)硼氢化钠(NaBH4)具有很强的还原性,常用于有机合成,的VSEPR模型为_______与其互为等电子体的阳离子有_______(写一种)。
(4)一种铜的溴化物立方晶胞如图所示。
该化合物的化学式为_______,在晶体中与Br紧邻的Br有_______个,若Cu原子与最近的Br原子的核间距为apm,则该晶体的密度计算表达式为_______g·cm-3(用NA表示阿伏加德罗常数的值)。
【化学--选修5:有机化学基础】
12. 从猫薄荷植物中分离出来的荆芥内酯,可用来制取具有驱虫效能的二氢荆芥内酯。为研究二氢荆芥内酯的合成和性质,进行了如下反应。
(1)物质B的名称是_______。
(2)C中官能团的结构式为_______。
(3)D中有3个甲基,则D的结构简式为_______。
(4)试剂1为 _______。
(5)A、F互为同分异构体,则E→F的化学方程式为_______。
(6)H是E的同系物,且比E少两个碳原子。满足下列条件的H的同分异构体有_______种(不考虑立体异构);其中被氧化后核磁共振氢谱有三组峰,面积比为1:1:4的有机物的结构简式为_______。
①有两个取代基的六元碳环;②1mol该同分异构体分别与足量的Na和NaHCO3反应生成气体物质的量相同。
(7)F→G的反应类型是_______。该反应在非水溶剂中进行的原因是_______。
参考答案
一.选择题
1. A 2. B 3. B 4. D 5. A 6. C 7. C
二. 非选择题
8. (1)二氧化硅
(2)V2O3+2H2O2+2H+=2VO+3H2O
(3)加入氨水,消耗H+,c(H+)减小,使得可逆反应VO+H2OVO+2H+平衡正向移动,故溶液中会产生大量的VO
(4)取最后一次洗涤液少量于试管中,滴加BaCl2溶液,若无白色沉淀产生,则说明沉淀已洗净
(5)0.103mol·L-1
(6)①. 2NH4VO32NH3↑+V2O5+H2O ②. 调pH
9. (1)①. 分液漏斗 ②. 防止倒吸
(2)2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
(3)偏低
(4)作肥料
(5)0.04 (6) ①. b ②. 0.02
(7)Cu2(OH)3Cl
10. (1)AC
(2)-180.5
(3)⑦
(4)①. 增大 ②. 增大
(5) ①. 75% ②. 3240
(6)2NO+3ClO-+2OH-=2NO+3Cl-+H2O
11. (1)①. 4d55s1 ②. 6
(2)①. 3 ②. 游离态的水分子中O原子孤电子对对σ键的斥力比该配离子水分子中O原子的σ键之间的斥力大,造成H—O—H键角减小 ③. C
(3)①. 正四面体 ②.
(4)①. CuBr ②. 12 ③.
12. (1)甲醇
(2)、
(3)
(4)NaOH水溶液
(5)
(6) ①. 8种 ②.
(7) ①. 还原反应 ②. LiAlH4中的H为-1价,易和H2O发生反应生成H2
安徽省颍上县2023届高三(上)摸底检测化学试题(word版,含答案): 这是一份安徽省颍上县2023届高三(上)摸底检测化学试题(word版,含答案),共6页。试卷主要包含了5 Ti-48 Zn-65等内容,欢迎下载使用。
安徽省黟县2023届高三(上)摸底检测化学试题(word版,含答案): 这是一份安徽省黟县2023届高三(上)摸底检测化学试题(word版,含答案),共6页。试卷主要包含了5 Ti-48 Zn-65等内容,欢迎下载使用。
安徽省歙县2023届高三(上)摸底检测化学试题(word版,含答案): 这是一份安徽省歙县2023届高三(上)摸底检测化学试题(word版,含答案),共6页。试卷主要包含了5 Ti-48 Zn-65等内容,欢迎下载使用。












