



第09讲 勒夏特列原理-【暑假自学课】2022年新高二化学暑假精品课(人教版选修4)
展开
课前导入
一、化学平衡的移动杨sir化学,侵权必究
1.定义:在一定条件下,当可逆反应达到平衡状态后,如果改变反应条件,平衡状态被破坏,平衡体系的物质组成也会随着改变,直到达到新的平衡状态。这种由原有的平衡状态达到新的平衡状态的过程叫做化学平衡的移动。
2.化学平衡移动的方向:
(1)若外界条件改变,引起v正>v逆时,正反应占优势,化学平衡向正反应方向移动;
(2)若外界条件改变,引起v正<v逆时,逆反应占优势,化学平衡向逆反应方向移动;杨sir化学,侵权必究
(3)若外界条件改变,引起v正和v逆都发生变化,如果v正和v逆仍保持相等,化学平衡就没有发生移动。
二、浓度对化学平衡的影响
实验探究——浓度对化学平衡的影响
原理 | 在K2Cr2O7溶液中,存在如下平衡:Cr2 + H2O + 2H+ (橙色) (黄色) |
步骤 | |
现象 | ①试管中溶液_________,②试管中溶液_________ |
解释 | (1)加入少量浓硫酸后,c(H+)增大,平衡向____反应方向移动,溶液橙色加深。 (2)加入少量 NaOH 溶液后,c(H+)减小,平衡向____反应方向移动,溶液变为黄色。 |
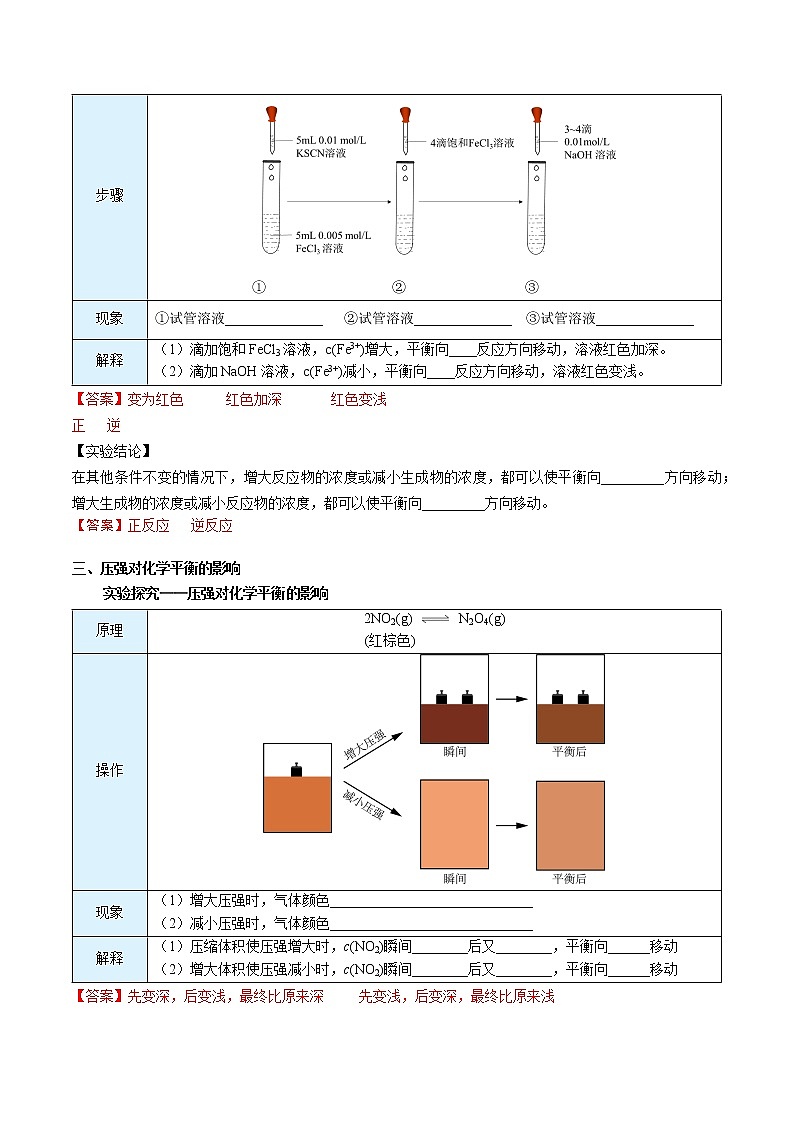
原理 | Fe3+ + 3SCN- Fe(SCN)3 |
步骤 | ① ② ③ |
现象 | ①试管溶液______________ ②试管溶液______________ ③试管溶液______________ |
解释 | (1)滴加饱和FeCl3溶液,c(Fe3+)增大,平衡向____反应方向移动,溶液红色加深。 (2)滴加NaOH溶液,c(Fe3+)减小,平衡向____反应方向移动,溶液红色变浅。杨sir化学,侵权必究 |
【实验结论】
在其他条件不变的情况下,增大反应物的浓度或减小生成物的浓度,都可以使平衡向_________方向移动;增大生成物的浓度或减小反应物的浓度,都可以使平衡向_________方向移动。杨sir化学,侵权必究
三、压强对化学平衡的影响
实验探究——压强对化学平衡的影响
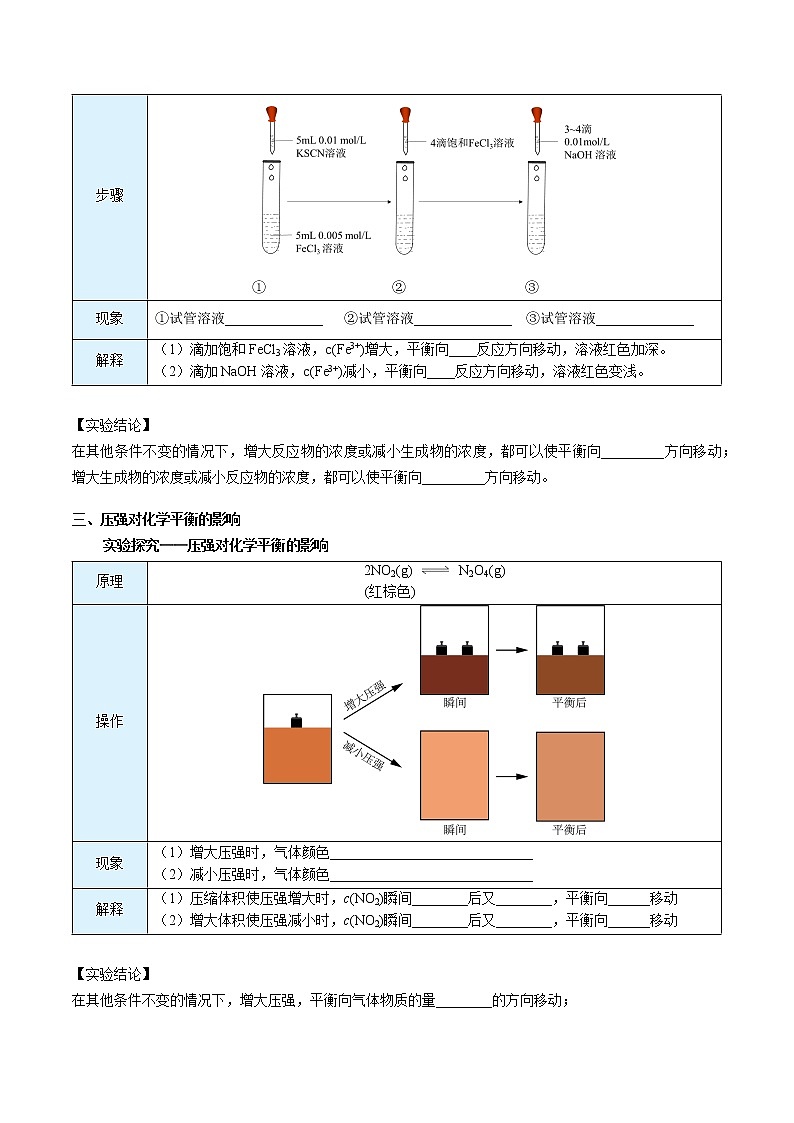
原理 | 2NO2(g) N2O4(g) (红棕色) |
操作 | |
现象 | (1)增大压强时,气体颜色_____________________________ (2)减小压强时,气体颜色_____________________________ |
解释 | (1)压缩体积使压强增大时,c(NO2)瞬间________后又________,平衡向______移动 (2)增大体积使压强减小时,c(NO2)瞬间________后又________,平衡向______移动 |
【实验结论】
在其他条件不变的情况下,增大压强,平衡向气体物质的量________的方向移动;
减小压强,平衡向气体物质的量________的方向移动。
注意:压强改变只影响有气体参加或生成的可逆反应,对于只涉及固体或液体的反应,压强的影响不予考虑。
四、温度对化学平衡的影响
实验探究——温度对化学平衡的影响
原理 | 2NO2(g)N2O4(g) ΔH=-56.9 kJ·mol-1 红棕色 无色 |
步骤 | |
现象 | 热水中混合气体颜色________;冰水中混合气体颜色________ |
结论 | 混合气体受热颜色________,说明NO2浓度________,即平衡向________方向移动;杨sir化学,侵权必究 混合气体受冷颜色________,说明NO2浓度________,即平衡向________方向移动。 |
【实验结论】
在其他条件不变的情况下,升高温度,平衡向____________的方向移动;
降低温度,平衡向____________的方向移动。杨sir化学,侵权必究
五、催化剂对化学平衡的影响
使用正催化剂,正、逆反应速率同时__________,且增大的倍数__________,化学平衡__________。
六、勒夏特列原理
如果改变影响平衡的一个条件(如温度、压强及参加反应的物质的浓度),平衡就向着能够减弱这种改变的方向移动,该结论就是勒夏特列原理。
命题点一:浓度对化学平衡的影响
【例1】将5mL0.005mol·L-1FeCl3溶液和5mL0.015mol·L-1KSCN溶液混合,达到平衡后混合液呈红色。再将混合液分为5等份,分别进行如下实验:杨sir化学,侵权必究
实验①:滴加4滴水,振荡 | |
实验②:滴加4滴饱和FeCl3溶液,振荡 | |
实验③:滴加4滴1mol·L-1KCl溶液,振荡 | |
实验④:滴加4滴1mol·L-1KSCN溶液,振荡 | |
实验⑤:滴加4滴6mol·L-1NaOH溶液,振荡 |
下列说法不正确的是
A.实验②中溶液颜色比实验①中深
B.对比实验①和③,可证明增加反应物中某些离子的浓度,平衡发生逆向移动
C.对比实验①和④,可证明增加反应物浓度,平衡发生正向移动
D.对比实验①和⑤,可证明减少反应物浓度,平衡发生逆向移动
【变1-1】在恒温恒容条件下,能使A(g)+B(g) C(g)+D(g)逆反应速率增大且平衡向右移动的措施是
A.减小C的浓度 B.增大D的浓度 C.减小B的浓度 D.增大A的浓度
【变1-2】已知溶液中存在+H2O2+2H+的平衡,其中呈橙色,呈黄色,向该平衡体系中滴加饱和NaOH溶液时,颜色的变化情况是
A.黄色加深 B.橙色加深 C.颜色不变 D.颜色褪去
命题点二:压强对化学平衡的影响
【例2】在下列可逆反应中,增大压强或降低温度,均可使平衡正向移动的是
A.2SO2(g)+O2(g)2SO3(g) ΔH<0
B.4NH3(g)+5O2(g)4NO(g)+6H2O(g)ΔH<0
C.2NH3(g)N2(g)+3H2(g) ΔH>0杨sir化学,侵权必究
D.SO2(g)+NO2(g)SO3(g)+NO(g) ΔH<0
【变2-1】在注射器中充入,平衡后在恒温下进行压缩,若体积减小,则( )
A.体系颜色比原来深 B.体系颜色比原来浅
C.体系颜色不变 D.注射器内压强不变
【例3】在一密闭容器中,反应aX(g)bY(g)达平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,Y的浓度是原来的60%,则
A.平衡向正反应方向移动了 B.物质X的转化率减小了
C.物质Y的质量分数降低了 D.a>b
【变3】在一密闭容器中,反应 aA(g)⇌bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度是原来的60% 则下列说法正确的是
A.平衡向正反应方向移动了杨sir化学,侵权必究
B.物质A的转化率减少了
C.物质B的物质的量分数增加了
D.a<b
命题点三:温度对化学平衡的影响
【例4】反应:A(g)+3B(g)⇌2C(g)[ΔH<0]达平衡后,将气体混合物的温度降低,下列叙述中正确的是
A.正反应速率加大,逆反应速率变小,平衡向正反应方向移动
B.正反应速率变小,逆反应速率加大,平衡向逆反应方向移动
C.正反应速率和逆反应速率都变小,平衡向正反应方向移动
D.正反应速率和逆反应速率都变小,平衡向逆反应方向移动
命题点四:勒夏特列原理杨sir化学,侵权必究
【例5】可逆反应N2+3H2⇌2NH3(正反应为放热反应)达到平衡后,下列方法能使平衡向正反应方向移动的是
A.升高温度 B.增大压强 C.增加氨气 D.使用催化剂
【变5】反应NH4HS(s)NH3(g)+H2S(g)在某温度下达到平衡,下列各种情況下,不会使平衡发生移动的是
A.温度、容积不变时,通入SO2气体
B.将NH4HS固体全部移走
C.保持温度和容器体积不变,充入氮气
D.保持温度和压强不变,充入氮气
【例6】已知反应: ,当反应达到平衡时,下列能提高COCl2转化率的措施的是
A.恒容通入惰性气体 B.增加CO浓度杨sir化学,侵权必究
C.加催化剂 D.恒压通入惰性气体
【变6】等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达平衡:X(g)+2Y(g)3Z(g) △H<0,当改变某个条件并达到新平衡后,下列叙述正确的是
A.升高温度,X的体积分数减小
B.增大压强,Z的浓度不变
C.保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
D.保持容器体积不变,充入一定量的Z,X的体积分数增大
命题点五:勒夏特列原理综合大题杨sir化学,侵权必究
【例7】合成氨对化学。工业和国防工业具有重要意义。
(1)向合成塔中按物质的量之比1:4充入、进行氨的合成,图A为时平衡混合物中氨的体积分数与压强(p)的关系图。
①图A中氨的体积分数为15%时,的转化率为_______。
②图B中,则温度为时对应的曲线是_______(填“a”或“b”)。
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的化学方程式为。一定温度下,在体积的恒容容器中发生上述反应,各物质的物质的量变化如表所示:杨sir化学,侵权必究
时间/min | ||||
0 | 0 | 0 | ||
5 | ||||
7 | ||||
10 |
①分析表中数据,判断时反应是否处于平衡状态?________(填“是”或“否”),前平均反应速率_________。
②反应在内,CO的物质的量减少的原因可能是________(填序号)。
a.减少的物质的量 b.降低温度 c.升高温度 d.充入
【练1】在水溶液中,CrO呈黄色,Cr2O呈橙色,重铬酸钾(K2Cr2O7)在水溶液中存在以下平衡:Cr2O+H2O2CrO+2H+,下列说法正确的是
A.向该溶液中加入过量浓NaOH溶液后,溶液呈橙色
B.该反应是氧化还原反应
C.向该溶液中滴加适量的浓硫酸,平衡向逆反应方向移动,再次达到平衡后,氢离子浓度比原溶液大
D.向体系中加入少量水,平衡逆向移动
【练2】已知反应:,把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用弹簧夹夹住橡皮管,把烧瓶A放入热水中,把烧瓶B放入冰水中,如图所示。与常温时烧瓶C内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅。下列说法错误的是(A、B、C中初始充入NO2、N2O4的量相等)( )杨sir化学,侵权必究
A.上述过程中,A烧瓶内正、逆反应速率均加快
B.上述过程中,B烧瓶内c(NO2)减小,c(N2O4)增大
C.上述过程中,A、B烧瓶内气体密度均保持不变
D.反应的逆反应为放热反应
【练3】对已经达到化学平衡的下列反应2X(g)+Y(g)⇌Z(g)减小压强时,对反应产生的影响是
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
【练4】在密闭容器中,一定条件下,进行如下反应:2NO(g)+2CO(g)N2(g)+2CO2(g);ΔH=-746.4kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施有
①加催化剂同时升温
②加催化剂同时缩小容器体积杨sir化学,侵权必究
③升温同时充入N2
④升温同时充入NO
A.1个 B.2个 C.3个 D.4个
【练5】在一密闭容器中,反应 3A(g)+B(s) 2C(g)+D(g)达到平衡后,改变以下条件,下列说法正确的是
A.增加A的浓度,平衡向正反应方向移动,平衡常数增大
B.升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
C.恒温恒容充入Ne,容器内压强增大,V(正)、V(逆)均增大
D.增加B的用量,正、逆反应速率不变,平衡不移动
【练6】在密闭容器中发生如下反应;达到平衡后,改变下列条件,判断平衡移动的方向(向正反应方向、向逆反应方向、不移动)
(1)升高温度,平衡_______移动;
(2)增大压强,平衡_______移动:
(3)增大H2(g)浓度,平衡_______移动:加入C,平衡_______移动;
(4)加入催化剂,平衡_______移动。
【练7】反应达到平衡,若升高温度,反应再次达到平衡时B的转化率变大;若减小压强,反应再次达到平衡时混合体系中C的体积分数减小。试推测:
(1)逆反应是______________(填“放”或“吸”)热反应。杨sir化学,侵权必究
(2)缩小体积而加压后,再次达到平衡时,与原平衡相比A的浓度_______________(填“变大”“变小”或“不变”)。
(3)若B是有色物质,A、C是无色物质,则减小压强(增大体积),再次达到平衡时,与原平衡相比混合物的颜色_______________(填“变深”“变浅”或“不变”)。
【练8】汽车尾气是城市主要空气污染物,利用反应2NO(g) +2CO(g) ⇌N2+2CO2(g)可实现汽车尾气的无害化处理。向甲、乙两个体积都为2.0 L的恒容密闭容器中分别充入2mol CO和2 mol NO,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(CO2)随时间(t)变化情况见下表:
时间/s | 0 | 2 | 4 | 6 | 8 | 10 |
甲容器(T1)n(CO2)/mol | 0 | 0.72 | 1.20 | 1.60 | 1.60 | 1.60 |
乙容器(T2)n(CO2)/mol | 0 | 0.60 | 1.00 | 1.40 | 1.70 | 1.70 |
(1)T1___________T2(填“>”、“<”或“=”下同),该反应ΔH___________0。
(2)乙容器中,2~4s内N2的平均反应速率υ(N2)=___________。
(3)甲容器中NO平衡转化率为___________,T1温度下该反应的平衡常数为___________。
(4)该反应达到平衡后,为提高反应速率同时提高NO的转化率,可采取的措施有___________(填字母序号)。
a.增大NO浓度 b.压缩容器体积 c.移去部分N2 d.改用高效催化剂
第18讲 暑假小测03-【暑假自学课】2022年新高二化学暑假精品课(人教版选修4): 这是一份第18讲 暑假小测03-【暑假自学课】2022年新高二化学暑假精品课(人教版选修4),文件包含第18讲暑假小测03教师版-暑假自学课2022年新高二化学暑假精品课人教版选修4docx、第18讲暑假小测03学生版-暑假自学课2022年新高二化学暑假精品课人教版选修4docx等2份学案配套教学资源,其中学案共18页, 欢迎下载使用。
第16讲 水的电离-【暑假自学课】2022年新高二化学暑假精品课(人教版选修4): 这是一份第16讲 水的电离-【暑假自学课】2022年新高二化学暑假精品课(人教版选修4),文件包含第16讲水的电离教师版-暑假自学课2022年新高二化学暑假精品课人教版选修4docx、第16讲水的电离学生版-暑假自学课2022年新高二化学暑假精品课人教版选修4docx等2份学案配套教学资源,其中学案共22页, 欢迎下载使用。
第12讲 化学反应的调控-【暑假自学课】2022年新高二化学暑假精品课(人教版选修4): 这是一份第12讲 化学反应的调控-【暑假自学课】2022年新高二化学暑假精品课(人教版选修4),文件包含第12讲化学反应的调控教师版-暑假自学课2022年新高二化学暑假精品课人教版选修4docx、第12讲化学反应的调控学生版-暑假自学课2022年新高二化学暑假精品课人教版选修4docx等2份学案配套教学资源,其中学案共18页, 欢迎下载使用。












