



第07讲 影响化学反应速率的因素-【暑假自学课】2022年新高二化学暑假精品课(人教版选修4)
展开
课前引入
实验探究——浓度对化学反应速率的影响
原理 | 2KMnO4 + 5H2C2O4 + 3H2SO4 === K2SO4 + 2MnSO4 + 10CO2↑+ 8H2O | |
操作 | ||
现象 | KMnO4溶液_______,加_____mol/L H2C2O4溶液的试管褪色更快 | |
结论 | H2C2O4浓度越大,KMnO4溶液褪色越_____,反应速率也越_____; 反之,H2C2O4浓度越小,反应速率越_____。杨sir化学,侵权必究 | |
实验探究——温度对化学反应速率的影响
原理 | Na2S2O3 + H2SO4 === Na2SO4 + SO2 + S↓+ H2O |
操作 | 一段时间后,分别混合并搅拌杨sir化学,侵权必究 |
现象 | 两组实验均____________,但______的一组实验更快 |
结论 | 升高温度,反应速率____________ |
实验探究——催化剂对化学反应速率的影响
操作 |
|
现象 | 两支试管均_________,且_____试管褪色更快杨sir化学,侵权必究 |
结论 | MnSO4起催化作用,加入催化剂,反应速率_________ |
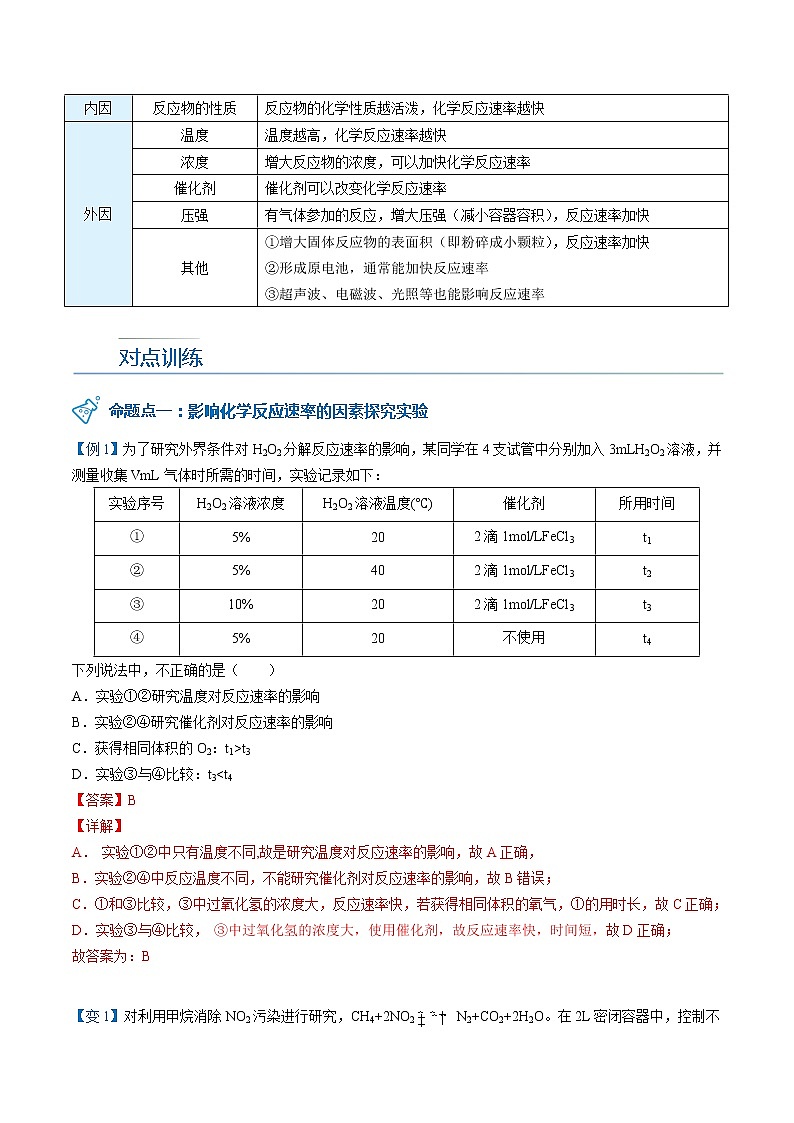
归纳总结——影响化学反应速率的因素杨sir化学,侵权必究
内因 | 反应物的性质 | 反应物的化学性质越活泼,化学反应速率越快 |
外因 | 温度 | 温度越高,化学反应速率越快 |
浓度 | 增大反应物的浓度,可以加快化学反应速率 | |
催化剂 | 催化剂可以改变化学反应速率杨sir化学,侵权必究 | |
压强 | 有气体参加的反应,增大压强(减小容器容积),反应速率加快 | |
其他 | ①增大固体反应物的表面积(即粉碎成小颗粒),反应速率加快 ②形成原电池,通常能加快反应速率杨sir化学,侵权必究 ③超声波、电磁波、光照等也能影响反应速率 |
命题点一:影响化学反应速率的因素探究实验
【例1】为了研究外界条件对H2O2分解反应速率的影响,某同学在4支试管中分别加入3mLH2O2溶液,并测量收集VmL气体时所需的时间,实验记录如下:
实验序号 | H2O2溶液浓度 | H2O2溶液温度(℃) | 催化剂 | 所用时间 |
① | 5% | 20 | 2滴1mol/LFeCl3 | t1 |
② | 5% | 40 | 2滴1mol/LFeCl3 | t2 |
③ | 10% | 20 | 2滴1mol/LFeCl3 | t3 |
④ | 5% | 20 | 不使用 | t4 |
下列说法中,不正确的是( )
A.实验①②研究温度对反应速率的影响
B.实验②④研究催化剂对反应速率的影响
C.获得相同体积的O2:t1>t3
D.实验③与④比较:t3<t4
【变1】对利用甲烷消除NO2污染进行研究,CH4+2NO2N2+CO2+2H2O。在2L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2nolNO2,测得n(CH4)随时间变化的有关实验数据见表。
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
下列说法不正确的是
A.组别①中,0~10min内,CO2的生成速率为0.0075mol·L-1·min-1
B.0~20min内,NO2的降解速率①>②
C.40min时,表格中T2对应的数据为0.15
D.由实验数据可知实验控制的温度T1<T2
【例2】为探究催化剂对过氧化氢分解反应速率的影响,某兴趣小组设计如图装置。实验时,通过胶头滴管向容器中各滴入5滴溶液后,每隔10 s观测注射器中气体体积并进行比较。
请回答:
(1)仪器A的名称是_______。
(2)实验前,检验该装置气密性的方法是_______。
(3)若甲装置在相同时间内收集到气体体积大于乙装置,能否推测Fe3+对H2O2分解的催化效果比Cu2+的好?_______(填“能”或“不能”),请说明理由_______。
【变2-1】某同学在实验室研究化学反应快慢的影响因素。
(1)研究催化剂对化学反应快慢的影响,实验步骤如下:
I.向3支大小相同的试管a、b、c中各加入2mL5%H2O2溶液;
II.向试管a中加入少量MnO2粉末,向试管b中滴加1~2滴1mol•L-1FeCl3溶液。实验后,得出结论:MnO2与FeCl3均能加快H2O2的分解,且前者的催化效率更高。
①步骤I中分别向3支试管中加入相同体积的溶液的目的是___。
②设计试管c的目的是___。
③若继续用上述实验药品研究温度对H2O2分解快慢的影响,为了便于观察,选择的催化剂是___;原因是___。
(2)现提供下列实验用品,研究化学反应快慢的影响因素。实验仪器:试管、烧杯、量筒、天平、秒表、酒精灯实验药品:铝片、铝粉、0.5mol·L-1盐酸、5mol·L-1盐酸、蒸馏水。
①利用所提供实验用品,可研究的化学反应快慢的影响因素有温度、___(写两个),通过___(实验现象)判断反应的快慢。
②设计实验探究温度对化学反应快慢的影响,写出实验步骤(实验仪器和药品任选):___。
【变2-2】在生活中,需要对化学反应的速率和化学反应的限度进行研究,以便控制化学反应。
Ⅰ.某实验小组以H2O2分解为例,研究浓度、催化剂、温度对反应速率的影响。按照如下方案完成实验。
项目 | 反应物 | 催化剂 | 温度 |
① | 10mL10%H2O2溶液 | 无 | 25℃ |
② | 10mL20%H2O2溶液 | 无 | 25℃ |
③ | 10mL20%H2O2溶液 | 无 | 40℃ |
④ | 10mL20%H2O2溶液 | 1~2滴0.1mol•L-1FeCl3溶液 | 40℃ |
通过实验得到氧气的体积与时间的关系如图甲所示,回答下列问题:
(1)代表实验①的曲线是__。
(2)对比实验③和④的目的是_。
(3)通过上面对比实验,所得的实验结论是__。
Ⅱ.一定温度下,在体积为2L的恒容密闭容器中充入1molN2和3molH2,一定条件下发生反应N2(g)+3H2(g)2NH3(g),测得其中N2的物质的量随时间变化如图乙所示。回答下列问题:
(4)从开始反应到t2时刻,氨的平均反应速率为___________。
命题点二:化学反应速率的影响因素
【例3】在某一密闭容器中,充入一定物质的量的N2和H2,发生反应,反应达到平衡后,下列条件的改变一定可以加快正反应速率的是
A.充入少量稀有气体 B.升高温度
C.及时移除产物 D.增大容器体积
【变3-1】一定量的铁粉和水蒸气在一个容积可变的密闭容器中进行反应:。下列条件不能使该反应的化学反应速率增大的是
A.增加铁粉的质量 B.保持容器容积不变,充入H2O(g)
C.将容器的体积缩小一半 D.升温
【变3-2】下列有关化学反应速率的说法正确的是
A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B.100mL2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C.对于反应H2(g)+I2(g)2HI(g),增大压强,反应速率加快
D.SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢
【例4】100mL6mol/LH2SO4跟过量的锌粉反应,在一定温度下,为了减缓反应速率,但又不影响生成氢气的总量。可向反应物中加入适量的杨sir化学,侵权必究
A.碳酸钠(固体) B.水 C.硫酸铜溶液 D.硫酸铵(固体)
【变4】等质量的两份锌粉a、b中分别加入过量的稀硫酸,同时向a中加入少量的CuSO4溶液,下列各图表示的是产生H2的体积V与时间t的关系,其中正确的是( )
A | B | C | D |
【例5】在一密闭容器中充入1 mol H2和1 mol I2,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)=2HI(g)
(1)保持容器容积不变,向其中充入1 mol H2,反应速率_________。
(2)升高温度,反应速率________。
(3)扩大容器体积,反应速率______。
(4)保持容器内气体压强不变,向其中充入1 mol H2(g)和1 mol I2(g),反应速率________。
(5)保持容器体积不变,向其中充入1 mol N2,反应速率________。
(6)保持容器内气体压强不变,向其中充入1 mol N2,反应速率________。
【例6】将一块质量为5.0 g的铝片投入盛有500 mL 0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图所示的曲线来表示,回答下列问题:
杨sir化学,侵权必究
(1)曲线O→a段不产生氢气的原因是_______。
(2)曲线a→b段产生氢气的速率较慢的原因是_______。
(3)曲线b→c段产生氢气的速率增加较快的主要原因是反应放出的热量使溶液的温度升高而加快反应速率。曲线c点以后产生氢气的速率逐渐下降的主要原因是_______。
【练1】下列有关化学反应速率的说法正确的是( )
A.的硫酸与铁片反应时,加入氯化钾溶液,反应速率不变
B.增加反应物的质量,反应速率一定加快杨sir化学,侵权必究
C.合成氨是一个放热反应,升高温度,正反应速率减慢
D.盐酸和分别与大小相同的大理石反应的速率相同
【练2】反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,下列条件的改变能使反应速率加快的是杨sir化学,侵权必究
①增加铁的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持体积不变,充入水蒸气使体系压强增大
A.①④ B.②③ C.③④ D.②④
【练3】一定温度下,将1 mol A和2 mol B放入5 L的密闭容器中发生如下反应:A(s)+2B(g)C(g) + 2 D(g) △H<0,经5 min后,测得容器内B的浓度减少了0.2 mol/L。下列叙述正确的是
A.加入少量A,反应速率加快
B.在5 min内该反应用C的浓度改变量表示的反应速率为 0.02mol/(L·min)
C.保持体积不变,向容器充入一定量氦气,压强增大,反应速率加快
D.升高温度,正反应速率减小,逆反应速率加快
【练4】用足量的铁片与一定量的稀硫酸反应制氢气,下列措施既能使氢气的生成速率加快,又不影响氢气的产量的是
A.滴入适量Na2SO4溶液 B.不用稀硫酸,改用98%的浓硫酸
C.加入少量碳酸钠固体 D.不用铁片,改用等质量的铁粉
【练5】废电池中的锌皮常用于实验室制氢气,废锌皮和纯锌粒分别与同浓度的稀硫酸反应,产生氢气速率较大的是___________,若用过量的纯锌粒与一定量的稀硫酸反应,为了加快反应速率又不影响产生氢气的量,下列措施可行的是___________(填序号)。
A.微热B.加入适量氧化铜C.加入少量硫酸铜溶液D.加水E.加入少量氢氧化钡溶液
【练6】在一密闭容器中充入1 mol I2和1 mol H2,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)⇌2HI(g) ΔH<0。保持容器容积不变,向其中充入1 mol CO2(不参加反应),反应速率_______(填“增大”、“减小”或“不变”),理由是_______。
【练7】某小组利用H2C2O4溶液和酸性KMnO4溶液(H2SO4酸化)反应来探究“外界条件对化学反应速率的影响”。该小组欲通过测定单位时间内生成CO2的体积来判断反应的快慢。设计实验方案如下:
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度℃ | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
① | 0.10 | 20 | 0.10 | 30 | 25 |
② | 0.20 | 20 | 0.10 | 30 | 25 |
③ | 0.20 | 20 | 0.10 | 30 | 50 |
(1)已知反应后H2C2O4转化为CO2逸出,转化为Mn2+,写出该反应的离子方程式______________;每消耗1 molH2C2O4,则反应中转移________________mol电子。
(2)探究浓度对化学反应速率影响的实验编号是_________,实验②、③探究_________对化学反应速率影响。本实验还可通过测定____________来比较化学反应速率。
(3)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:a、该反应放热,使体系温度升高;b、____________。
(4)若实验①在5 min末收集49.0 mLCO2气体,则在5 min末,c()=_______mol•L-1。(已知25℃时,气体摩尔体积Vm=24.5 L• mol-1)
第18讲 暑假小测03-【暑假自学课】2022年新高二化学暑假精品课(人教版选修4): 这是一份第18讲 暑假小测03-【暑假自学课】2022年新高二化学暑假精品课(人教版选修4),文件包含第18讲暑假小测03教师版-暑假自学课2022年新高二化学暑假精品课人教版选修4docx、第18讲暑假小测03学生版-暑假自学课2022年新高二化学暑假精品课人教版选修4docx等2份学案配套教学资源,其中学案共18页, 欢迎下载使用。
第16讲 水的电离-【暑假自学课】2022年新高二化学暑假精品课(人教版选修4): 这是一份第16讲 水的电离-【暑假自学课】2022年新高二化学暑假精品课(人教版选修4),文件包含第16讲水的电离教师版-暑假自学课2022年新高二化学暑假精品课人教版选修4docx、第16讲水的电离学生版-暑假自学课2022年新高二化学暑假精品课人教版选修4docx等2份学案配套教学资源,其中学案共22页, 欢迎下载使用。
第12讲 化学反应的调控-【暑假自学课】2022年新高二化学暑假精品课(人教版选修4): 这是一份第12讲 化学反应的调控-【暑假自学课】2022年新高二化学暑假精品课(人教版选修4),文件包含第12讲化学反应的调控教师版-暑假自学课2022年新高二化学暑假精品课人教版选修4docx、第12讲化学反应的调控学生版-暑假自学课2022年新高二化学暑假精品课人教版选修4docx等2份学案配套教学资源,其中学案共18页, 欢迎下载使用。












