




第01讲 焓变 反应热-【暑假自学课】2022年新高二化学暑假精品课(人教版选修4)
展开
课前导入
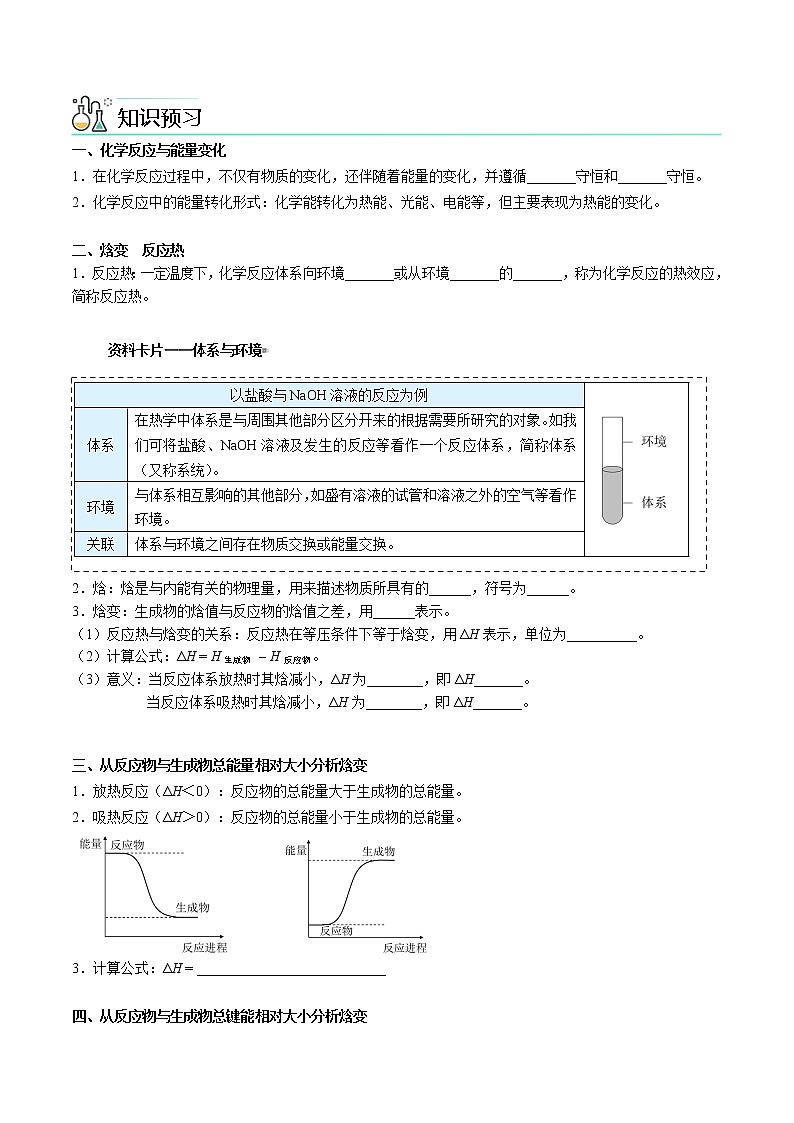
一、化学反应与能量变化
1.在化学反应过程中,不仅有物质的变化,还伴随着能量的变化,并遵循_______守恒和_______守恒。
2.化学反应中的能量转化形式:化学能转化为热能、光能、电能等,但主要表现为热能的变化。
二、焓变 反应热
1.反应热:一定温度下,化学反应体系向环境_______或从环境_______的_______,称为化学反应的热效应,简称反应热。杨sir化学,侵权必究
资料卡片——体系与环境
2.焓:焓是与内能有关的物理量,用来描述物质所具有的______,符号为______。
3.焓变:生成物的焓值与反应物的焓值之差,用______表示。
(1)反应热与焓变的关系:反应热在等压条件下等于焓变,用ΔH表示,单位为__________。
(2)计算公式:ΔH = H生成物 – H反应物。
(3)意义:当反应体系放热时其焓减小,ΔH为________,即ΔH_______。
当反应体系吸热时其焓减小,ΔH为________,即ΔH_______。
三、从反应物与生成物总能量相对大小分析焓变
1.放热反应(ΔH<0):反应物的总能量大于生成物的总能量。
2.吸热反应(ΔH>0):反应物的总能量小于生成物的总能量。
3.计算公式:ΔH = ___________________________
四、从反应物与生成物总键能相对大小分析焓变
1.化学反应的本质是 。
2.断键需要 能量,成键需要 能量。
3.键能:断开(形成)1 mol某键所吸收(放出)的能量叫键能。单位:kJ/mol。
例如,H-H键的键能是436.0 kJ/mol,那么断开(形成)1 mol H-H键吸收(放出)的能量为436.0 kJ。
4.实例分析
由图可知,1 mol H2与1 mol Cl2反应生成2 mol HCl分子的过程中, 了 kJ的能量。杨sir化学,侵权必究
5.计算公式:ΔH = ___________________________
6.吸热反应、放热反应能量变化图与键能的关系
放热反应 吸热反应
E吸 是断开反应物中所有化学键需要吸收的总能量,即反应物的总键能;
E放 是形成生成物中所有化学键需要放出的总能量,即生成物的总键能。
五、常见的放热反应与吸热反应
放热反应 | 吸热反应 |
①所有燃烧反应; ②大多数化合反应; ③酸碱中和反应; ④金属与酸或水的置换反应; ⑤物质的缓慢氧化; ⑥铝热反应。 | ①大多数分解反应; ②Ba(OH)2·8H2O与NH4Cl反应;杨sir化学,侵权必究 ③高温条件下C、H2、CO作还原剂的反应。 |
命题点一:化学反应中的能量变化
【例1】下列有关能量的说法不正确的是( )
A.化学能可转变为电能 B.化学反应伴随能量变化是化学反应基本特征之一
C.化学反应能量转换遵守能量守恒定律 D.化学变化时断裂化学键需放出能量
【变1】氢氧燃料电池可作为汽车动力能源。一种制H2的方法如图所示,该过程中( )
A.太阳能转化为电能 B.不存在键的断裂与生成
C.化学能转化为太阳能 D.太阳能转化为化学能
命题点二:常见的吸热反应与放热反应
【例2】下列变化属于吸热反应的是( )
A.氨气液化 B.生石灰溶于水
C.镁与稀盐酸反应 D.Ba(OH)2·8H2O与NH4Cl的反应
【变2】下列过程既属于氧化还原反应又属于放热反应的是( )
A.液氨汽化 B.硫酸稀释 C.以灼热的碳与CO2反应 D.酒精燃烧
命题点三:吸热反应与放热反应的探究实验
【例3】为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:
(1)上述3个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是______。
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量
氢氧化钡溶液与稀硫酸,U形管中可观察到的现象是___________________________________________,
说明该反应属于_________(选填“吸热”或“放热”)反应。
(3)为探究固体M溶于水的热效应,选择装置Ⅱ进行实验(反应在甲中进行)。
①若M为钠,则实验过程中烧杯中可观察到的现象是_____________________________________________;
②若观察到烧杯里产生气泡,则说明M溶于水____________(选填 “一定是放热反应”“一定是吸热反应”或“可能是放热反应”);
③若观察到烧杯里的玻璃管内迅速形成一段水柱,则M可能是___________(填物质名称)。
(4)至少有两种实验方法能证明超氧化钾与水的反应(4KO2 + 2H2O === 4KOH + 3O2↑)是放热反应还是吸热反应。方法①:选择上述装置__________(选填“Ⅰ”“Ⅱ”或“Ⅲ ”)进行实验;方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到棉花燃烧,则说明该反应是________反应。
命题点四:从反应物与生成物总能量相对大小分析焓变
【例4】属于氧化还原反应且能量变化与如图一致的是( )
A.NH4ClNH3↑ + HCl↑
B.HCl + NaOH = NaOH + H2O
C.2NH4Cl + Ba(OH)2·8H2O = 2NH3↑ + BaCl2 + 10H2O
D.CO2 + C2CO
【变4-1】下列化学反应中,反应物总能量一定比生成物总能量低的是( )
A.燃烧反应 B.中和反应
C.生石灰与水反应 D.石灰石分解
【变4-2】下列化学反应过程中的能量变化符合图示的是( )
①酸碱中和反应②液态水变成水蒸气③生石灰与水反应④铝热反应⑤石灰石分解⑥Ba(OH)2·8H2O与NH4Cl的反应
A.①④⑤⑥ B.②⑤⑥ C.②③⑤ D.⑤⑥
【变4-3】反应 A + B → C(ΔH<0)分两步进行:①A + B → X(ΔH>0),②X → C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是( )
命题点五:键能的计算
【例5】已知H2(g)+O2(g)=H2O(g) ΔH=-242kJ·mol-1,断开1molO=O键和1mol H—O键所吸收的能量分别为496kJ和463kJ,则断开1molH—H键所吸收的能量为( )杨sir化学,侵权必究
A.920kJ B.557kJ C.436kJ D.188kJ
【变5】已知:N2(g) +3H2(g)2NH3(g) △H=-92.4 kJ/mo1.若断裂1 mol H-H、1 molN≡N需要吸收的能量分别为akJ、b kJ。则生成1 mol N-H放出能量的数值为
A. B.
C. D.
命题点六:从反应物与生成物总键能相对大小分析焓变
【例6】如图所示N2(g)和O2(g)反应生成NO(g)过程中能量变化,判断下列说法错误的是( )
A.直观看,该反应中反应物断键吸收的总能量高于生成物形成键放出的总能量
B.2mol气态氧原子结合生成O2(g)时,能放出498kJ能量
C.断裂1mol NO分子中的化学键,需要吸收632kJ能量
D.1molN2和1molO2的反应热ΔH=-180kJ·mol-1
【变6】已知 2O(g)=O2(g) ∆H = - 496 kJ ∙mol -1,结合能量变化示意图。下列说法正确的是( )
A.拆开 1 mol H2(g) 中的化学键需要吸收 932 kJ能量
B.拆开 1 mol H2O(g) 中所有化学键需要吸收 926 kJ能量
C.1 mol H2O(l) 转变为 1mol H2O(g)需要吸收 88 kJ能量
D.2 mol H2(g) 和 1mol O2(g) 反应生成 2 mol H2O(l),共放热 1940 kJ
【练1】下列变化过程,属于放热反应的是( )
①金属钠与水
②NH4Cl晶体与Ba(OH)2·8H2O混合搅拌
③H2在Cl2中燃烧
④水蒸气变成液态水杨sir化学,侵权必究
⑤中和反应
⑥碳酸钙热分解
A.①②⑤ B.①③⑤ C.③④⑤ D.②④⑥
【练2】在压强为2.20×101 kPa、温度达到374 ℃时,水成为“超临界状态”,此时水可将CO2等含碳化合物转化为有机物,这就是“水热反应”,生物质在地下高温高压条件下通过水热反应可生成石油、煤等矿物能源。下列说法不正确的是( )
A.二氧化碳与超临界水作用生成汽油的反应,属于吸热反应
B.“水热反应”过程中只有化学变化,没有物理变化
C.火力发电厂有望利用废热,将二氧化碳转变为能源物质
D.随着科技的进步,“水热反应”制取能源有望实现地球上碳资源的和谐循环
【练3】下列反应过程中的能量变化情况符合如图的是
A.酒精的燃烧 B.氢氧化钡晶体与氯化铵固体反应
C.镁和稀硫酸的反应 D.酸和碱的中和反应
【练4】已知H2(g)+Br2(g)=2HBr(g) ΔH =-102kJ·mol-1,1molHBr分子中的化学键断裂时需要吸收369kJ的能量,1molBr2分子中的化学键断裂时需要吸收的能量为200kJ,则1molH2分子中的化学键断裂时需要吸收的能量为( )
A.436kJ B.218 kJ C.169kJ D.569kJ
【练5】下列说法正确的是( )
A.需要加热才能进行的反应一定是吸热反应,放热反应不需要加热
B.化学反应只能将化学能转化成光能或热能
C.化学键的断裂和形成是物质在化学反应中发生能量变化的主要原因
D.根据能量守恒定律,反应物的总能量等于生成物的总能量
【练6】下图为碳酸钙的热分解示意图,有关该反应的下列说法中错误的是( )
A.1 mol CO2(g)和1 mol CaO(s)的总能量大于1 mol CaCO3(s)的总能量
B.该反应的ΔH>0
C.该反应中有离子键断裂也有共价键断裂,化学键断裂吸收能量,化学键形成放出能量
D.由该反应可推出凡是需要加热才发生的反应均为吸热反应
【练7】下列说法正确的是 ( )
A.化学键的断裂与形成与反应放热和吸热无关
B.放热反应的发生无需任何条件
C.所有化学变化一定遵循质量守恒和能量守恒
D.化学变化一定有化学键的断裂和生成,有化学键断裂或生成一定发生了化学变化
【练8】化学反应A2 + B2 === 2AB的能量变化如图所示:
则下列说法正确的是( )
A.该反应是吸热反应
B.断裂1 mol A—A键和1mol B—B键可放出x kJ能量
C.断裂2 mol A—B键需要吸收y kJ能量
D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
第16讲 水的电离-【暑假自学课】2022年新高二化学暑假精品课(人教版选修4): 这是一份第16讲 水的电离-【暑假自学课】2022年新高二化学暑假精品课(人教版选修4),文件包含第16讲水的电离教师版-暑假自学课2022年新高二化学暑假精品课人教版选修4docx、第16讲水的电离学生版-暑假自学课2022年新高二化学暑假精品课人教版选修4docx等2份学案配套教学资源,其中学案共22页, 欢迎下载使用。
第15讲 电离平衡常数-【暑假自学课】2022年新高二化学暑假精品课(人教版选修4): 这是一份第15讲 电离平衡常数-【暑假自学课】2022年新高二化学暑假精品课(人教版选修4),文件包含第15讲电离平衡常数教师版-暑假自学课2022年新高二化学暑假精品课人教版选修4docx、第15讲电离平衡常数学生版-暑假自学课2022年新高二化学暑假精品课人教版选修4docx等2份学案配套教学资源,其中学案共19页, 欢迎下载使用。
第12讲 化学反应的调控-【暑假自学课】2022年新高二化学暑假精品课(人教版选修4): 这是一份第12讲 化学反应的调控-【暑假自学课】2022年新高二化学暑假精品课(人教版选修4),文件包含第12讲化学反应的调控教师版-暑假自学课2022年新高二化学暑假精品课人教版选修4docx、第12讲化学反应的调控学生版-暑假自学课2022年新高二化学暑假精品课人教版选修4docx等2份学案配套教学资源,其中学案共18页, 欢迎下载使用。












