


第05讲 氧化还原反应——氧化剂与还原剂 氧化还原反应规律-【暑假自学课】2022年高一化学暑假精品课(人教版)
展开第05讲 氧化剂与还原剂 氧化还原反应规律
【学习目标】
1.知道常见的氧化剂、还原剂及其反应后的生成物。
2.了解氧化还原反应规律——价态律、强弱律、优先律、守恒律。
3.能初步配平氧化还原反应方程式。
【基础知识】
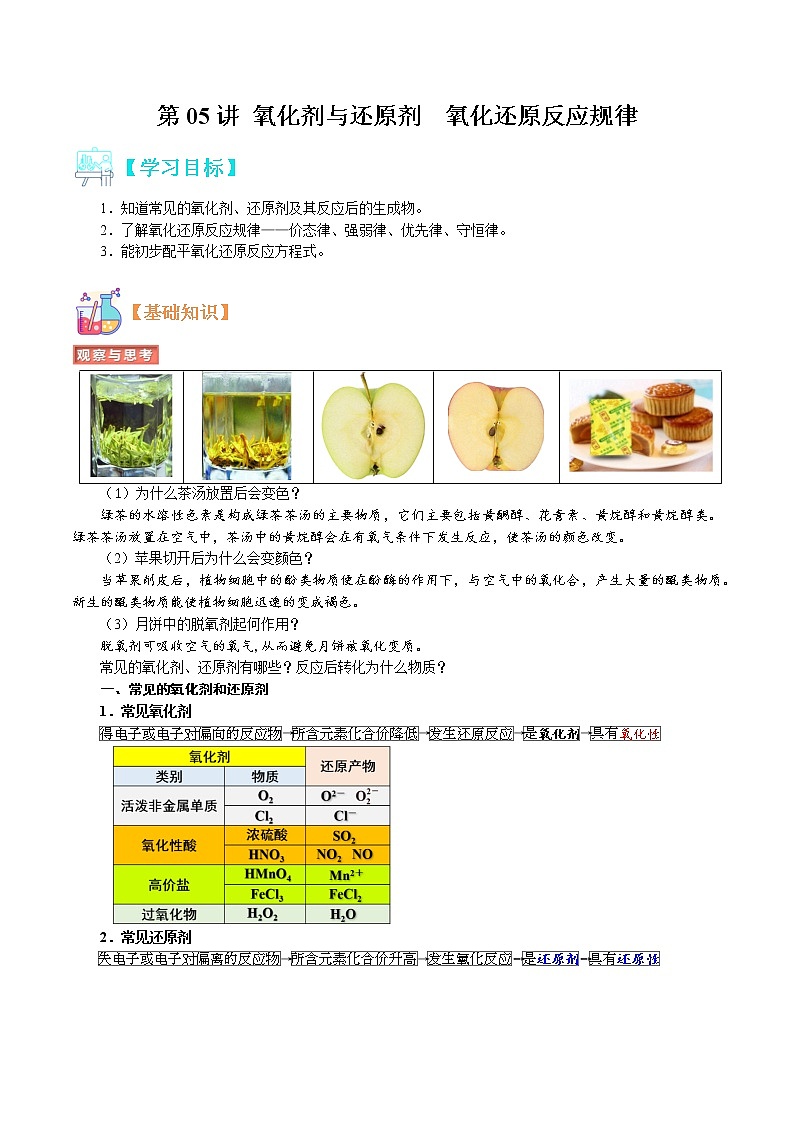
(1)为什么茶汤放置后会变色?
绿茶的水溶性色素是构成绿茶茶汤的主要物质,它们主要包括黄酮醇、花青素、黄烷醇和黄烷醇类。绿茶茶汤放置在空气中,茶汤中的黄烷醇会在有氧气条件下发生反应,使茶汤的颜色改变。
(2)苹果切开后为什么会变颜色?
当苹果削皮后,植物细胞中的酚类物质便在酚酶的作用下,与空气中的氧化合,产生大量的醌类物质。新生的醌类物质能使植物细胞迅速的变成褐色。
(3)月饼中的脱氧剂起何作用?
脱氧剂可吸收空气的氧气,从而避免月饼被氧化变质。
常见的氧化剂、还原剂有哪些?反应后转化为什么物质?
一、常见的氧化剂和还原剂
1.常见氧化剂
→→→→
2.常见还原剂
→→→→
(1)物质得电子能力越强,其氧化性就越强;失电子能力越强,其还原性就越强。
(2)物质的氧化性或还原性的强弱取决于物质得、失电子的难易程度,与得失电子数目的多少无关。
如Na-e-=Na+,Al-3e-=Al3+,Al失去电子的数目较多,但Al的还原性却比Na弱。
方程式
双氧水性质(氧化性、还原性)
Cl2+H2O2=2HCl+O2↑
2FeCl2+H2O2+2HCl=2FeCl3+2H2O
2H2O2H2O+O2↑
二、氧化还原反应规律
1.价态律
“高价氧化、低价还原、中间价态两头兼”即最高价时只有氧化性,最低价时只有还原性,中间价态时既有氧化性又有还原性。
①元素的化合价处于最高(最低)价态时,具有氧化(还原)性,但不一定具有强氧化(还原)性,如Na+(弱氧化性)、F-(弱还原性)。
②一般来说,同种元素价态越高,氧化性越强;价态越低,还原性越强。
为何苹果汁中加柠檬汁后就不变色了?——柠檬汁中某种与空气中的氧气发生了反应。
苹果汁中和柠檬汁中的某种物质都有还原性,哪一个还原性强?——柠檬汁的某种物质还原性更强。
2.强弱律
方程式
性质比较
氧化性
氧化剂>氧化产物
还原性
还原剂>还原产物
比较规律
比什么性,找什么剂,产物之性小于剂
物质氧化性、还原性的其他判据
根据元素的活动性顺序判断
根据反应条件的
难易判断
反应的条件越简单,反应就越容易发生,说明物质氧化性(或还原性)越强。如4HCl(浓)+MnO2MnCl2+2H2O+Cl2↑、16HCl(浓)+2KMnO4=2KCl+2MnCl2+8H2O+5Cl2↑,氧化性:KMnO4>MnO2。
根据元素被氧化或被还原的程度判断
某还原剂被不同氧化剂氧化时,元素化合价升得越高,说明氧化剂的氧化性越强。
2Fe+3Cl22FeCl3、Fe+SFeS,氧化性:Cl2>S。
同一物质在不同的条件下,其氧化性/还原性会有所不同。
(1)温度:①氧化性:浓硫酸(热)>浓硫酸(冷);②还原性:浓盐酸(热)>浓盐酸(冷)。
(2)浓度:HNO3(浓)>HNO3(稀)
(3)pH:①中性环境中NO3-不显氧化性,酸性环境中NO3-显强氧化性;②KMnO4(酸性)>KMnO4(中性)>KMnO4(碱性)
苹果汁中的酚类物质和柠檬汁中的维生素C都有还原性,哪一个先与空气中的O2反应?
维生素C的还原性比酚类强,维生素C先与空气中的O2反应。
3.优先先律
同时含有几种还原剂
按照还原性由强到弱的顺序依次与氧化剂反应
如在FeBr2溶液中(还原性Fe2+>Br-)通入Cl2时,Fe2+先与Cl2反应。
同时含有几种氧化剂
按照氧化性由强到弱的顺序依次与还原剂反应
如在含有Fe3+、Cu2+、H+的溶液中加入Fe粉,Fe粉先与Fe3+反应,然后依次为Cu2+、H+。
在含有Cu(NO3)2、Mg(NO3)2、AgNO3的溶液中加入过量锌粉,反应的离子先后顺序是____________。
下面两种双线桥的画法,哪种是正确的?
4.价态互不换位律
同种元素的不同价态间发生氧化还原反应,其价态只靠拢不交叉,即价态向中看齐(最多变为同一价态,不可能发生交叉现象。)
相邻价态之间不发生氧化还原反应,如S与SO2、SO2与H2SO4、H2S与S之间均不反应。
实验室用反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O制备氯气,若参加反应的氧化剂为20个,则被氧化的还原剂的个数是多少?
5.守恒律
原理
氧化还原反应中,氧化剂得到的电子总数等于还原剂失去的电子总数,表现为元素化合价升高的总数等于元素化合价降低的总数。
步骤
找物质
氧化剂→还原产物 还原剂→氧化产物
定得失
确定1个粒子得失电子数(化合价变化值×变价原子个数)
列关系
N(氧化剂)×1个粒子得电子数=N(还原剂)×1个粒子失电子数
在KI和KIO3混合溶液中加入稀硫酸,发生反应,生成碘、硫酸钾和水。此反应中被氧化的碘元素与被还原的碘元素的原子个数比是
A.5∶1 B.2∶1 C.1∶3 D.1∶5
工业上用如下反应制备单质磷:Ca3(PO4)2+SiO2+C→P+CaSiO3+CO↑,如何配平该方程式。
提示:根据氧化剂得电子总数或化合价降低总数与还原剂失电子总数或化合价升高总数相等解题。
一标:
二等:
三定:
四平:
五查:,反应前后原子数、电子得失数都相等。
三、氧化还原反应方程式的配平
配平三原理
电子守恒
氧化剂和还原剂得失电子总数相等
质量守恒
反应前后原子的种类和个数不变
电荷守恒
离子反应前后,所带电荷总数相等
配平五步曲
一标
标出价态变化元素的化合价
二等
据得失电子数相等,找最小公倍数
三定
先定氧化剂及还原产物的计量数,后定还原剂及氧化产物的计量数
四平
用观察法配其它物质的计量数
五查
查各微粒个数、得失电子数是否相等,查离子方程式电荷守恒
离子方程式中,若电荷不守恒,需根据溶液的酸碱性,利用H+/OH-配平电荷。
配平以下氧化还原反应方程式:
一般氧化还原反应
NH3+O2NO+H2O
自身氧化还原反应
NO2+H2O=HNO3+NO
部分氧化还原反应
NH3+Cl2=NH4Cl+H2O
离子反应
Fe2++Cr2O72-+H+=Fe3++Cr3++H2O
缺项氧化还原反应
Cl2+H2O2+NaOH=NaCl+O2↑+
配平的一些小技巧
①一般氧化还原反应:从左配——左边氧化剂、还原剂着手配平。
②配自身氧化还原反应:逆向配——从右边氧化产物、还原产物配平。
③部分氧化还原反应:先据电子守恒配价态变化的氧化剂或还原剂,再加上表现酸性或碱性的没有变价的部分。
④缺项氧化还原反应:先据电子守恒配平,再由质量守恒确定所缺的物质,一般所缺的物质是酸、碱、水。
【考点剖析】
考点一:氧化还原基本概念辨析
例1.(2022年江苏省宿迁市沭阳县期中)元素铬(Cr)的几种化合物存在如图转化关系,下列判断不正确的是
A.反应①②③中铬元素的化合价均发生了变化
B.反应①表明Cr2O3有酸性氧化物的性质
C.反应②利用了H2O2的氧化性
D.K2Cr2O7可作为氧化剂
考点二:氧化还原规律——价态律
例2.(2021年江苏省南通市如皋期中)下列物质参加氧化还原反应时,硫元素只能被氧化的是
A.Na2S B.S C.SO2 D.浓H2SO4
考点三:氧化还原反应规律——强弱律
例3.(2022年河北省唐山市遵化市期中)根据下列反应的化学方程式,判断有关物质的还原性强弱顺序是
I2+SO2+2H2O=H2SO4+2HI;2FeCl2+Cl2=2FeCl3;2FeCl3+2HI=2FeCl2+2HCl+I2
A.I->Fe2+>Cl->SO2 B.Cl->Fe2+>SO2>I-
C.Fe2+>I->Cl->SO2 D.SO2>I->Fe2+>Cl-
考点四:氧化还原反应规律——电子守恒律
例4.(2022年四川省资阳市期末改编)已知含有15NA个Na2SO3粒子的Na2SO3溶液恰好与含有5NA个KRO4粒子的KRO4溶液完全反应转化为Na2SO4。则R元素在产物中的化合价是
A.+1 B.+2 C.+3 D.+4
考点五:氧化还原方程式的配平
例5.(2022年天津市五校联考期中)自来水中的NO3-对人类健康产生危害。为了降低自来水中NO3-的浓度,某研究人员提出在碱性条件下用Al粉还原NO3-,产物是N2。发生的反应可表示如下,请完成方程式的配平。
______Al+______NO3-+______OH-→______AlO2-+______N2↑+_____H2O
考点六:信息氧化还原方程式的书写
例6.(2022年江苏省徐州市12月月考选编)亚硝酸钠(NaNO2)像食盐一样有咸味,但有很强的毒性,误食NaNO2会使人中毒。
自来水中的NO3-对人类健康会产生危害,碱性条件下用Mg还原NO3-,主要产物是Mg(OH)2 、N2等,写出该反应过程的离子方程式_______________________________________。
【真题演练】
1.(2022年河北省张家口市期中)2Fe3++2I-=2Fe2++I2,2Fe2++Cl2=2Fe3++2Cl-,则有关离子的还原性由强到弱顺序为
A.C1->Fe2+>I- B. Fe2+>I->Cl- C. I->Fe2+>Cl- D. Fe2+>Cl->I-
2.(2022年河南省新乡市期中)已知:一定条件下稀硝酸溶解铜的化学方程式为3Cu+8HNO3(浓)=3Cu(NO3)2+2NO↑+4H2O。下列说法错误的是
A.HNO3作氧化剂 B.铜作还原剂
C.Cu(NO3)2既是氧化产物又是还原产物 D.还原性:Cu>NO
3.(2022年江苏省盐城市响水中学期中)ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求,ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业制备ClO2的方法有多种,其中之一是用NaClO3和H2C2O4(草酸)的混合溶液加硫酸酸化制取ClO2,该反应中还原剂和氧化剂的个数之比是
A.1∶1 B.2∶1 C.1∶2 D.2∶3
4.(2022年山西省晋城市与高平市期中改编)判断下列反应中,电子转移方法不正确的是
A.
B.
C.
D.
5.(2022年湖北省期中)在常温下,发生下列几种反应:
①16H++10Z-+2XO4-=2X2++5Z2+8H2O
②2A2++B2=2A3++2B-
③2B-+Z2=B2+2Z-
根据上述反应,下列结论判断错误的是
A.溶液中可发生反应:Z2+2A2+=2A3++2Z-
B.Z元素①、③反应中都被氧化
C.氧化性强弱的顺序为:XO4->Z2>B2>A3+
D.反应①中,X2+是XO4-的还原产物
6.(2022年河南省新乡市期中)已知氧化性:Cl2>Br2>Fe3+>I2,下列不能发生的反应是
A.Cl2+2NaI=2NaCl+I2
B.Br2+2NaI=2NaBr+I2
C.2FeCl3+2NaI=2FeCl2+2NaCl+I2
D.3Br2+2FeCl2=2FeBr3+2Cl2↑
7.(2022年湖北省孝感市期中)回答下列问题:
(1)在S2-、Fe3+、Fe2+、Mg2+、S、I-、H+中,只有氧化性的是___________,只有还原性的是___________,既有氧化性又有还原性的是___________。
(2)某同学写出以下三个化学方程式(未配平):
①NO+HNO3―→N2O3+H2O
②N2O4+H2O―→HNO3+HNO2
③NH3+NO―→HNO2+H2O
其中你认为一定不可能实现的是___________(填序号)。
(3)下列三个氧化还原反应中,氧化性最强的物质是___________。
①2FeCl3+2KI=2FeCl2+2KCl+I2
②2FeCl2+Cl2=2FeCl3
③2NaClO3+4HCl(浓)=2NaCl+2ClO2↑+Cl2↑+2H2O
若溶质中Cl-与I-共存,为了氧化I-而Cl-不被氧化,除单质外,还可以用上述反应中的___________做氧化剂。
(4)第(3)问反应③中氧化产物是___________,还原产物是___________。
8.(2022年河南省新乡市期中)高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,主要用于饮用水处理,工业上有多种制备高铁酸钠的方法,其中一种方法的化学反应原理可用离子方程式表示为3ClO-+2Fe3++xOH-=2FeO42-+3Cl-+yH2O。
(1)上述反应中的x=_______,y=_______。
(2)上述反应中氧化剂为_______;还原产物为_______。
(3)由上述反应可知,氧化性强弱:ClO-_______(填“>”或“<”,下同)FeO42-;还原性强弱:Cl-_______Fe3+。
(4)请用单线桥法表示该反应中电子的转移情况:_______________________________________。
(5)已知:Na2FeO4在处理饮用水的过程中铁元素会被转化为Fe3+,进而Fe3+在水中产生Fe(OH)3胶体,Fe(OH)3胶体具有吸附性。
①Na2FeO4在处理饮用水的过程中_______(填“发生了”或“未发生”)氧化还原反应。
②Fe(OH)3胶体为_______色,写出区分胶体与溶液的操作及现象:_____________________________
___________________________________________________。
【过关检测】
1.在KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O的反应中,被氧化的氯与被还原的氯的原子个数比为
A.1∶6 B.6∶1 C.1∶5 D.5∶1
2.(2021年广东省惠州第一学期期末)已知,(1)2FeCl3+2KI=2FeCl2+2KC1+I2 (2)FeCl2+Cl2=2FeC13,据此可判断各物质的氧化性由强到弱的顺序是:
A.FeCl3>Cl2>I2 B.Cl2>FeCl3>I2
C.I2>Cl2>FeCl3 D.Cl2>I2>FeCl3
3.(2022年湖北省宜昌市期中)根据反应:①2Fe2++Br2=2Fe3++2Br-,②2Br-+Cl2=Br2+2Cl-,③2Fe3++2I-=2Fe2++I2。判断下列物质的氧化性由强到弱的顺序正确的是
A.Cl2>Br2>Fe3+>I2 B.Br2>Fe3+>Cl2>I2
C.Cl2>Br2>I2>Fe3+ D.I2>Fe3+>Br2>Cl2
4.(2022年江苏省江阴市期末)氢化钠(NaH)可在野外用作生氢剂,其中氢元素为-1价。NaH用作生氢剂时的化学反应原理为:NaH+H2O=NaOH+H2↑。下列有关该反应的说法中,正确的是
A.该反应属于置换反应
B.H2O发生氧化反应,被还原
C.NaH是失去电子,是氧化剂
D.还原性大小:NaH>H2
5.(2022年北京市第四中学期中)Cl2通入70℃的氢氧化钠水溶液中,能同时发生两个自身氧化还原反应(未配平):NaOH+Cl2→NaCl+NaClO+H2O NaOH+Cl2→NaCl+NaClO3+H2O
反应完成后测得溶液中NaClO与NaClO3的数目之比为5∶2,则该溶液中NaCl与NaClO的数目之比为
A.2∶1 B.3∶1 C.15∶7 D.7∶5
6.(2022年湖北省期中改编)为了防止枪支生锈,常采用化学处理使钢铁零件表面生成Fe3O4的致密保护层——“发蓝”。化学处理过程中其中一步的反应为:Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑。下列有关的叙述不正确的是
A.NO2-的氧化性大于FeO22-的氧化性
B.反应中转移电子2NA个,则生成还原产物0.5NA个
C.枪支“发蓝”实质上是使铁表面钝化导致难以生锈
D.上述反应中,单质铁被氧化,而NaNO2作为氧化剂
7.(2022年江西省九校期中联考)已知还原性:I->Fe2+>Br-,且有下列三个反应:①Cl2(少量)+FeI2=FeCl2+I2 ②2Fe2++Br2=2Fe3++2Br- ③Co2O3+6HCl=2CoCl2+Cl2↑+3H2O。下列说法正确的是
A.①②③中氧化产物分别是I2、Fe3+、Cl2
B.根据以上方程式可以得到氧化性Cl2>Fe3+>Co2O3
C.可以推理得到Cl2(少量)+FeBr2=FeCl2+Br2
D.在反应③中HCl体现了酸性和还原性
8.(2022年江苏省淮安市期末)ClO2和亚氯酸钠(NaClO2)都是广泛使用的漂白剂、消毒剂。高浓度ClO2气体易发生爆炸,在生产、使用时需用其他气体进行稀释。某工厂生产ClO2和NaClO2的工艺流程为:
ClO2发生器中反应为NaClO3+Na2SO3+H2SO4―→Na2SO4+ClO2↑+H2O(未配平),下列有关该反应的说法中,正确的是
A.反应中Na2SO3是氧化剂
B.反应中ClO2是氧化产物
C.每生成1个ClO2转移2个电子
D.参加反应的NaClO3和Na2SO3的个数之比为2∶1
9.(2022年四川省宜宾市期末)工业废水中含有的重铬酸根(Cr2O72-)有毒,必须处理达标后才能排放。工业上常用绿矾(FeSO4·7H2O)做处理剂,反应的离子方程式如下:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。回答下列问题:
(1)上述反应中,还原剂是___________(填离子符号);氧化性:Cr2O72-___________Fe3+(填“>”或“<”)。
(2)用“单线桥”标出电子转移的方向和数目:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
10.(2021年江苏省南通市如皋期末)氧化还原反应在亚硝酸盐的制取和转化中有重要的应用。
(1)Ca(NO2)2(亚硝酸钙)可用作混凝土中钢筋的防护剂,实验室可用如下反应制备:
Ca(NO3)2+2CaFe2O4+4NO=3Ca(NO2)2+2Fe2O3
①该反应中的氧化剂是____________。
②该反应中被氧化的N原子与被还原的N原子的个数之比为____________。
(2)某氧化还原反应中的所有物质为NaNO2、Na2SO4、NO、H2SO4、NaI、I2和H2O。已知NaNO2是反应物。
①写出该反应的化学方程式并用单线桥标出电子转移的方向和数目:
_____________________________________________________________________。
②由该反应可以得到物质的氧化性顺序是_________>________。
【暑假初升高】人教版化学初三(升高一)暑假预习-第05讲 氧化还原反应——氧化剂与还原剂 氧化还原反应规律 讲学案: 这是一份【暑假初升高】人教版化学初三(升高一)暑假预习-第05讲 氧化还原反应——氧化剂与还原剂 氧化还原反应规律 讲学案,文件包含暑假初升高人教版化学初三升高一暑假预习-第05讲氧化还原反应氧化剂与还原剂氧化还原反应规律解析版docx、暑假初升高人教版化学初三升高一暑假预习-第05讲氧化还原反应氧化剂与还原剂氧化还原反应规律原卷版docx等2份学案配套教学资源,其中学案共25页, 欢迎下载使用。
第05讲 暑假小测01-【暑假自学课】2022年新高二化学暑假精品课(人教版选修4): 这是一份第05讲 暑假小测01-【暑假自学课】2022年新高二化学暑假精品课(人教版选修4),文件包含第05讲暑假小测01教师版-暑假自学课2022年新高二化学暑假精品课人教版选修4docx、第05讲暑假小测01学生版-暑假自学课2022年新高二化学暑假精品课人教版选修4docx等2份学案配套教学资源,其中学案共21页, 欢迎下载使用。
第05讲 气体摩尔体积-【暑假自学课】2022年新高一化学暑假精品课(苏教版2019必修第一册): 这是一份第05讲 气体摩尔体积-【暑假自学课】2022年新高一化学暑假精品课(苏教版2019必修第一册),文件包含第05讲气体摩尔体积-暑假自学课2022年新高一化学暑假精品课苏教版2019必修第一册解析版docx、第05讲气体摩尔体积-暑假自学课2022年新高一化学暑假精品课苏教版2019必修第一册原卷版docx等2份学案配套教学资源,其中学案共13页, 欢迎下载使用。












