

2022届新高考化学考前冲刺卷 河北卷
展开2022届新高考化学考前冲刺卷
河北卷
可能用到的相对原子质量:H 1 O 16 Na 23 S 32 W 184
一、单项选择题:本题共9小题,每小题3分,共27分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.现代社会的发展与进步离不开材料,下列有关材料的说法不正确的是( )
A.“辽宁舰”上用于舰载机降落的阻拦索是一种特种钢缆,属于纯金属材料
B.“超轻海绵”使用的石墨烯是新型无机非金属材料
C.某品牌手机使用的麒麟980芯片属于半导体材料
D.“中国天眼”用到的碳化硅是一种新型陶瓷材料
2.关于生活中的有机物,下列说法不正确的是( )
A.葡萄糖可以发生氧化反应、银镜反应和水解反应
B.工业上利用油脂在碱性条件下的水解反应制取肥皂和甘油
C.食用植物油的主要成分是高级不饱和脂肪酸甘油酯,是人体的营养物质
D.皮肤接触浓硝酸变黄是蛋白质的颜色反应
3.用如图实验装置进行有关实验,能达到实验目的的是( )
A.用装置甲定量测定化学反应速率
B.用装置乙干燥
C.用装置丙分离甲醇(沸点为64.7℃)与水的混合物
D.用装置丁除去溶在中的
4.类比和推理是化学研究的重要方法。下列类比或推理正确的是( )
A.卤素单质的熔点从到逐渐升高,则碱金属单质的熔点从Li到Cs逐渐升高
B.碳素钢在潮湿的空气中容易被腐蚀,则不锈钢在潮湿的空气中容易被腐蚀
C.合金的硬度一般大于其成分金属,则五角面值的铜合金长城币的硬度大于纯铜
D.氮气与氧气不容易化合,则磷单质与氧气不容易化合
5.某恒星内部发生的一种核反应为,X、Y为短周期元素,X的周期数是族序数的3倍。下列说法正确的是( )
A.的质量数为24
B.X、Y的简单离子的电子层结构相同
C.X、Y的氧化物均只含离子键
D.X、Y的最高价氧化物对应的水化物之间可发生反应
6.以高硫铝土矿(主要成分为,少量和硫酸盐)为原料制备聚合硫酸铁和明矾的部分工艺流程如下,下列说法错误的是( )
已知:赤泥液的主要成分为
A.赤泥液的作用是吸收“焙烧”阶段中产生的
B.聚合硫酸铁可用于净化自来水,与其组成中的具有氧化性有关
C.在“聚合”阶段,若增加用量,会使中x变大
D.从“滤液”到“明矾”的过程中还应有“除硅”步骤
7.代表阿伏加德罗常数的值。下列说法不正确的是( )
A.4.6gNa与足量的甘油水溶液反应,转移电子数为0.2
B.一定量淀粉水解生成时需要消耗的分子数为
C.常温下,1L中性溶液中水电离的数目为
D.标准状况下,含共用电子对数目为
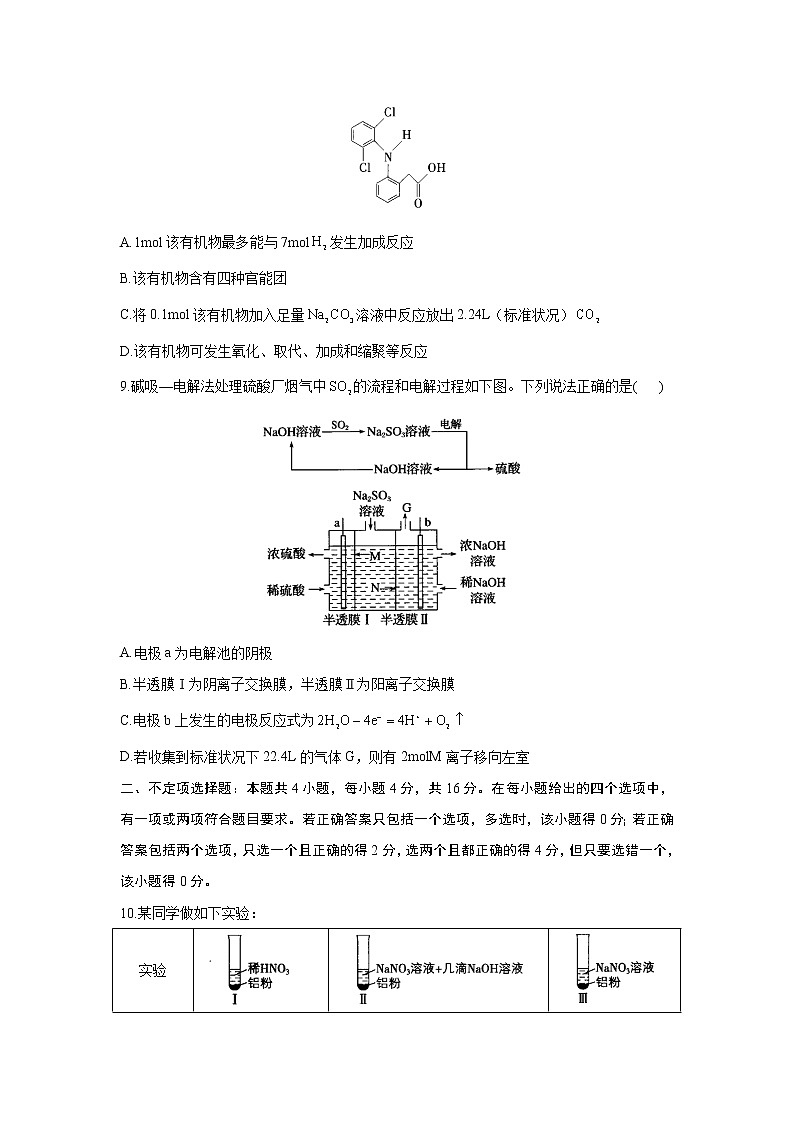
8.双氯芬酸具有抗炎、镇痛及解热作用,临床上用于风湿性关节炎、各种神经痛、癌症疼痛等的治疗。双氯芬酸的结构简式如图所示,下列说法正确的是( )
A.1mol该有机物最多能与7mol发生加成反应
B.该有机物含有四种官能团
C.将0.1mol该有机物加入足量溶液中反应放出2.24L(标准状况)
D.该有机物可发生氧化、取代、加成和缩聚等反应
9.碱吸—电解法处理硫酸厂烟气中的流程和电解过程如下图。下列说法正确的是( )
A.电极a为电解池的阴极
B.半透膜Ⅰ为阴离子交换膜,半透膜Ⅱ为阳离子交换膜
C.电极b上发生的电极反应式为
D.若收集到标准状况下22.4L的气体G,则有2molM离子移向左室
二、不定项选择题:本题共4小题,每小题4分,共16分。在每小题给出的四个选项中,有一项或两项符合题目要求。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得4分,但只要选错一个,该小题得0分。
10.某同学做如下实验:
实验
现象
溶液无色试管上方呈红棕色
产生大量气泡,能使湿润红色石蕊试纸变蓝
产生气泡,能使湿润红色石蕊试纸变蓝
下列说法不正确的是( )
A.实验Ⅰ试管上方呈现红棕色的原因是
B.根据实验Ⅱ、Ⅲ的气体检验结果不能说明都有产生
C.实验Ⅰ溶液中发生的反应是
D.在实验Ⅰ、Ⅱ、Ⅲ中,在酸、碱及中性溶液中都被还原
11.短周期主族元素W、X、Y、Z的原子序数依次增大,W的原子半径最小,W与Y同主族,X原子最外层电子数是其次外层电子数的3倍。火山喷口附近有Z的单质存在,四种元素形成的一种化合物Q的结构如函所示。下列说法错误的是( )
A.原子半径:W
C.W与Y形成的化合物属于离子化合物
D.Z的简单气态氢化物比X的简单气态氢化物稳定
12.在恒温条件下,向盛有食盐的2L恒容密闭容器中加入和,发生两个反应:
① 平衡常数
② 平衡常数
10min时反应达到平衡测得容器内体系的压强减少20%,10min内用NOCl(g)表示的平均反应速率。下列说法不正确的是( )
A.反应的平衡常数为
B.平衡后
C.其他条件保持不变,反应在恒压条件下进行,则平衡常数增大
D.平衡时的转化率为50%
13.“分子机器设计和合成”有着巨大的研究潜力。人类步入分子器件时代后,使得光控、温控和电控分子的能力更强。如图是蒽醌套索醚电控开关。下列说法错误的是( )
A.物质Ⅰ的分子式是 B.反应[a]是缩聚反应
C.1mol物质Ⅰ可与8mol发生加成反应 D.物质Ⅰ不可能所有原子共平面
三、非选择题:共57分。第14~16题为必考题,每个试题考生都必须作答。第17~18题为选考题,考生根据要求作答。
(一)必考题:共42分。
14.(14分)俗称大苏打、海波,易溶于水,在中性或碱性环境中能稳定存在,食品工业用作螯合剂、抗氧化剂,医药工业用作洗涤剂、消毒剂。
实验室用通入和的混合溶液中来制备并测定所得产品中其晶体纯度。
(1)用图甲所示装置制取。
①装置中用于滴加浓硫酸的仪器通常换成仪器A,仪器A的名称为______________,仪器A与原仪器相比,其优点是______________。
②三颈烧瓶中制取的反应的化学方程式为使用搅拌器搅拌的目的是______________。
③将获得的产品经过加热浓缩、降温结晶等步骤得到的晶体样品,欲得到此晶体为何不通过蒸发结晶:______________,
此样品中含有少量,也可能含有,如何验证此晶体样品中杂质的存在:______________。
(2)测定实验室制取的样品中的纯度。
采用氧化还原滴定法测定所制取的样品中的纯度,相关反应为。准确称取9.50g样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用碘的标准溶液进行滴定,滴定终点的现象是______________,碘水标准液应放在______________滴定管中,若滴定起始和终点的液面位置如图乙所示,且三次结果均和图乙数据一致,此样品中的纯度为______________(保留2位有效数字)。
15.(14分)一种阳极泥的主要成分为Cu、Ag、Pt、Au、和,从中回收Se和贵重金属的工艺流程如下图所示。
已知:①该工艺中萃取与反萃取原理为:;
②在碱性条件下很稳定,有很强的络合能力,与形成配离子,常温下该反应的平衡常数。
回答下列问题:
(1)试列举可加快“焙烧”速率的措施:___________(任填一条),写出焙烧时生成CuO的方程式___________。
(2)“滤渣I”的主要成分是___________;“酸浸氧化”中通入氧气的目的是___________。
(3)“沉银”时证明银离子沉淀完全的操作是___________。
(4)萃取后得到有机相的操作方法是___________,“反萃取剂”最好选用___________(填化学式)溶液。
(5)“溶浸”中发生的反应为该反应中平衡常数K′=_________[已知]。
(6)“滤液IV”中含有,则“还原”中发生反应的离子方程式为___________(提示:“滤液IV”可返回“溶浸”工序循环使用)。
16.(14分)作为绿色氧化剂和消毒剂,在工业生产及日常生活中应用广泛。已知:。回答下列问题:
(1)的电子式为_____,能用作消毒剂是因为分子结构中存在_____键(选填“H—O”或—O—O—”)。
(2)纯相对稳定,实验表明在54℃下恒温储存两周,浓度仍然保持99%,原因是分解反应的_____(填编号)。
a.比较小 b.反应速率比较小 c.不够大 d.活化能比较大
(3)一定条件下,溶液的酸碱性对催化分解反应的影响如图所示。
①pH=7时,0~10min分解反应的平均速率________。
②以下对图像的分析正确的是________(填序号)。
A.相同条件下,的浓度越小,分解速率越大
B.相同条件下,溶液的酸性越强,的分解速率越大
C.在0~50min间,pH=7时的分解百分率比pH=2时大
(4)液态是一种极弱的酸,测得常温下其电离常数,写出的一级电离方程式________。能与碱反应:,产物可以看成是的盐,结合电离常数计算说明(常温下)水溶液有强碱性的原因_______。
(5)的一种衍生物是,其阴离子结构式为,水溶液加热后有气体产生,同时溶液pH降低,用离子方程式表明原因________。
(二)选考题:共15分。请考生从2道题中任选一题作答,并用2B铅笔将答题卡上所选题目对应的题号右侧方框涂黑,按所涂题号进行评分;多涂、多答,按所涂的首题进行评分;不涂,按本选考题的首题进行评分。
[选修3:物质结构与性质]
17.钨(W),钼(Mo)作为难熔金属的代表为搭载神舟12号载人飞船(简称“神十二”)的长征2F运载火箭成功发射做出巨大贡献。
(1)铬、钼、钨是同族元素,且原子序数依次增大,基态钼原子的核外电子排布类似于基态铬原子,则基态钼原子的核外有______________个未成对电子;基态钨原子的核外电子排布是“洪特规则”的例外,则基态钨原子的价电子层的电子排布图为______________。金属钼、钨原子采取的体心立方结构的空间利用率为______________(用表示原子半径列式并计算)。
(2)钼常用作有机合成的催化剂,例如:
苯甲醛分子中碳原子的杂化类型为______________,最多有______________个原子共平面。环己基甲醇分子中采取杂化的原子是______________(填元素符号)。
(3)钨的碳化物晶胞结构如图所示,碳原子嵌入金属钨的晶格的间隙。并不破坏原有金属的晶格,形成填隙固溶体。
在此结构中,一个钨原子周围距离该钨原子最近的碳原子有______________个。该晶体的化学式为______________。该部分晶体的体积为,则碳化钨的密度为______________(用表示阿伏加德罗常数的值)。
[选修5:有机化学基础]
18.有机化合物H是合成某工业材料重要的中间体,科研人员拟以芳香化合物A为原料合成H,合成路线如图:
已知:①
②
回答下列问题:
(1)A分子质谱图的最大质荷比为______________。
(2)C物质中官能团的名称为______________。
(3)由E生成F的化学方程式为______________。
(4)由B生成C过程中①、D生成E过程中①的反应类型分别为______________。
(5)用“*”标出D的手性碳原子:______________。
(6)K是F的同系物,分子量比F小14,K能发生水解反应,也可以发生银镜反应,且苯环上含有两个支链,则K的结构有______________种。
(7)写出用环戊烷和2-丁炔为原料制备化合物的合成路线(其他无机试剂任选):______________。
答案以及解析
1.答案:A
解析: A.特种钢缆为金属合金材料,不是纯金属材料,故A错误; B.石墨烯超轻海绵为碳单质,属于无机非金属材料,故B正确; C.使用的麒麟980芯片主要成分为硅单质,为半导体材料,故C正确; D.中国天眼FAST用到的碳化硅是一种新型耐高温陶瓷材料,故D正确;故选:A。
2.答案:A
解析:葡萄糖是单糖,单糖不能发生水解,故A错误; 利用油脂在碱性条件下的水解反应工业上制取肥皂和甘油,故B正确;食用植物油的主要成分是高级不饱和脂肪酸甘油酯,故C正确;
皮肤的成分是蛋白质,含苯环的蛋白质遇浓硝酸变黄色,故D正确。
3.答案:D
解析:生成的氧气可从长颈漏斗逸出,不能测定反应速率,应改为分液漏斗,故A错误;温度计应处于蒸馏烧瓶的支管口处,故C错误。
4.答案:C
解析:卤素单质构成的晶体都是分子晶体,从到,分子间作用力逐渐增大、熔点逐渐升高,碱金属单质的晶体是金属晶体,从Li到Cs,金属键逐渐减弱、熔点逐渐降低,A错误;碳素钢在潮湿的空气中容易发生电化学腐蚀,不锈钢具有特殊的组织结构,具有抗腐蚀性能,在大气中比较稳定,不容易生锈,B错误;合金的硬度一般大于其成分金属,则铜合金长城币的硬度大于纯铜,C正确;氮气与氧气不容易化合,磷单质与氧气则相对容易化合,例如白磷在空气中容易自燃,D错误。
5.答案:B
解析:X、Y为短周期元素,X的周期数是族序数的3倍,则X是第三周期第ⅠA族的Na元素;X的质子数,其质量数为2×11+1=23,根据知,Y的质子数,则Y为Mg元素,其质量数。根据上述分析,的质量数为26,A错误;X、Y的简单离子依次为,两种离子都具有与Ne原子相同的电子层结构,B正确;X的常见氧化物有,Mg的常见氧化物为MgO,中只有离子键,而中既有离子键又有非极性共价键,C错误;X的最高价氧化物对应的水化物为NaOH,Mg的最高价氧化物对应的水化物为,NaOH与不反应,D错误。
6.答案:B
解析:A.由上述分析可知,焙烧时,与反应生成和,即,用赤泥液吸收生成的,即,故A正确;B.聚合硫酸铁可用于净化自来水,与其组成中的具有水解产生胶体的性质有关,与其组成中的具有氧化性无关,故B错误;C.在“聚合”阶段,若增加用量,碱性增强,x变大,故C正确;D.由上述分析可知,从“滤液”到“明矾”的过程中,由于碱浸造成二氧化硅溶于氢氧化钾,滤液中含硅酸盐,需要进行“除硅”步骤,故D正确。
7.答案:C
解析:钠与甘油、水都能反应,钠完全反应,转移电子数根据钠的质量计算,,钠完全反应转移0.2mol电子,A项正确;由淀粉水解方程式知,生成1mol葡萄糖,需要消耗,B项正确;发生水解反应,促进水的电离,水电离的氢离子等于溶液中氢离子和醋酸分子数之和,,C项错误;乙烯的电子式为,1个分子含6个共用电子对,,含共用电子对数为,D项正确。
8.答案:D
解析:该分子中只有2个苯环可以与发生加成反应,羧基中的碳氧双键不能与发生加成反应,故1mol该有机物最多能与6mol发生加成反应,A错误。该有机物中含有—Cl、—COOH、三种官能团,B错误。将0.1mol该有机物加入足量溶液中,反应生成 ,没有生成,只有当双氯芬酸过量时才能产生,C错误。双氯芬酸能燃烧,故可以发生氧化反应;含有氯原子羧基,可以发生取代反应;含有苯环,可以发生加成反应;含有亚氨基羧基,可以发生缩聚反应,D正确。
9.答案:B
解析:电极a处进入稀硫酸得到浓硫酸,说明通过半透膜Ⅰ进入左侧,在a电极上被氧化生成,电极反应为,所以半透膜Ⅰ为阴离子交換膜,电极a为阳极,电极b为阴极,水电离出的氢离子在阴极放电生成氢气,电极反应为,半透膜Ⅱ为阳离子交换膜,钠离子透过半透膜Ⅱ进入右侧,从而得到浓NaOH溶液。
10.答案:BC
解析:NO是无色气体,是红棕色气体,Al和稀硝酸反应生成无色的NO,NO不稳定,易被氧气氧化生成红棕色气体二氧化氮,则发生反应,A正确;能使湿润的红色石蕊试纸变蓝色的气体是氨气,根据实验Ⅱ、Ⅲ的气体检验结果及现象知,实验Ⅱ、Ⅲ都有产生,B错误;Al和稀硝酸反应生成NO,其离子方程式为,C错误;Ⅰ中生成NO,Ⅱ、Ⅲ中生成氨气,Ⅰ中溶液呈酸性,Ⅱ中溶液呈碱性,Ⅲ中溶液呈中性,则实验Ⅰ、Ⅱ、Ⅲ说明在酸、碱及中性溶液中都被还原,D正确。
11.答案:D
解析:同一周期主族元素,从左到右原子半径依次减小,同主族元素从上到下原子半径依次增大,则原子半径:H
解析:,反应的平衡常数,则,A项正确;10min时反应达到平衡,测得容器内体系的压强减少20%,则平衡时混合气体的总物质的量为(0.2+0.2+0.1)mol×(1-20%)=0.4mol,10min内用NOCl(g)
表示的平均反应速率,则平衡时,设①中反应的为,②中反应的为,则:
则,,联立方程,解得,故平衡后,B项正确;平衡常数只受温度影响,其他条件保持不变,反应在恒压条件下进行,则平衡常数不变,C项错误;根据上述分析,可计算平衡时的转化率为,D项正确。
13.答案:AB
解析:由结构简式可知,故A错误;物质Ⅰ生成Ⅱ,C=O生成C−O,为加成反应,故B错误;物质Ⅰ含有2个苯环、2个羰基,则1molⅠ可与8mol 发生加成反应,故C正确;含有饱和碳原子,具有甲烷的结构特点,则物质Ⅰ的所有原子不可能共平面,故D正确。
14.答案:(1)①滴液漏斗(1分)可以通过滴液速率来控制反应速率(1分)
②(2分)使反应物充分混合,加快反应速率(1分)
③蒸发结晶有可能使产品失去结晶水(1分)取少量样品,先加水溶解,再加足量稀盐酸酸化,过滤后再向滤液中滴加溶液,若产生白色沉淀,侧有(2分)
(2)当滴入最后一滴碘标准液后,锥形瓶中溶液由无色变成蓝色,且半分钟内不褪色(2分)
酸式(2分)95%(2分)
解析:(1)①为了更好地通过调节滴液速率控制反应速率,通常将分液漏斗换成滴液漏斗。
②中的S元素由+4价降低为+2价,中S元素由-2价升高为+2价,发生归中反应,中C元素转化为,根据化合价升降守恒配平即可;有固体参加的反应,反应速率较慢,使用搅拌器充分搅拌可以加快反应速率。③检验,和都会干扰实验,先加足量稀盐酸酸化,可以把转化为,把转化为和S沉淀,脱离反应体系,过滤后再加溶液,若产生白色沉淀则有。
(2)滴定过程碘单质逐步被逍耗,当碘单质过量后,淀粉遇碘变蓝色,且半分钟内不褪色;碘水显酸性,应盛放在酸式滴定管中;根据反应的化学方程式可知,,故,则样品中的纯度。
15.答案:(1)① 将阳极泥粉碎或搅拌(1分) ② (2分)
(2) ① Pt、Au (2分) ②防止生成的氮氧化物排放到空气中 (1分)
(3)静置,向上层清液中滴加NaCl溶液,若无沉淀产生,则沉淀完全 (2分)
(4)①分液 (1分) ② (1分)
(5) (2分)
(6)(2分)
解析: (1)固体表面积、反应物浓度、温度等因素都会影响反应速率,则加快“焙烧"速率的措施:将阳极泥粉碎或搅拌;焙烧时和反应生成CuO和,反应的方程式。
(2)由分析知,滤渣I的成分为Pt、Au;由于此时可能发生氧化还原反应产生氮的氧化物,通入可使氮氧化物又转化为而溶解,故通入氧气的目的是防止生成的氮氧化物排放到空气中;
(3)证明银离子沉淀完全即检验滤液中银离子是否存在,实验操作是静置,向上层清液中滴加NaCl溶液,若无沉淀产生,则沉淀完全;
(4)萃取后得到有机相的操作方法是分液;反萃取即使萃取平衡逆向移动,此时可向体系中加入酸,由于最终是获得,所以为了不引入新杂质,最好选用。
(5)对应反应平衡常数。
(6)由分析知,滤液Ⅲ中被还原为Ag,自身被氧化为,根据得失电子守恒初步配平方程式为:,结合流程知,可在左边添加4个配平电荷守恒,右边添加2个配平元素守恒,得完整方程式为: 。
16.答案:(1)(2分)—O—O—(1分)
(2)bd(2分)
(3)①0.1(1分) ②B(2分)
(4)(2分),的一级水解程度很大,故溶液碱性很强(2分)
(5)(2分)
解析:(1)过氧化氢的电子式为,利用过氧化氢消毒是因为其具有强氧化性,过氧化氢具有强氧化性的原因是分子中存在过氧键(—O—O—)。
(2)实验表明纯在54℃下恒温储存2周,浓度仍保持99%,说明54℃下纯过氧化氢的分解速录慢,其原因可能是过氧化氢分解反应的活化能大。
(3)①由题图可知,pH=7时,0~10min过氧化氢由变化到,浓度减少了,故。②相同条件下,过氧化氢浓度越大,分解速率越大,A项错误;由题图可知,相同条件下,pH=2时过氧化氢分解速率最大,pH=7时次之,pH=10时最小,即酸性越强过氧化氢分解速率越大,B项正确;在0~50min间,pH=7时和pH=2时过氧化氢的分解百分率相同,都是100%,C项错误。
(4)过氧化氢的一级电离方程式为,,说明的一级水解程度很大,故溶液碱性很强。
(5)在水中发生水解,加热可促进其水解,根据的结构式知,生成的气体为,又溶液pH降低,故离子反应方程式为。
17.答案:(1)6(1分)(1分)(2分)
(2)(2分)14(2分)C、O(2分)
(3)6(1分)WC(2分)(2分)
解析:(1)铬元素的价电子排布式为,基态钼原子的核外电子排布类似于基态铬原子,则基态钼原子的价电子排布式为,有6个未成对电子;基态钨原子的核外电子排布是“洪特规则”的例外,价电子层的电子排布图为。体心立方堆积晶胞边长,其空间利用率为。
(2)苯甲醛分子中碳原子的杂化类型为;若苯环、醛基确定的2个平面重合,则有14个原子共平面。环己基甲醇分子中,所有C原子形成4条共价键,无孤电子对,O原子形成2条共价键,含2对孤电子对,C、O均为杂化。
(3)据图可知,距离一个钨原子最近的碳原子的个数为6。钨原子位于晶胞顶点、棱、面心、内部,属于该晶胞的钨原子的个数为1,6个碳原子位于晶胞内部,即化学式为WC。晶胞的质量为,根据密度的定义可知,碳化钨的密度为。
18.答案:(1)106(2分)
(2)碳碳双键、羧基(2分)
(3)(2分)
(4)氧化反应(1分)消去反应(1分)
(5)(2分)
(6)12(2分)
(7)(3分)
解析:由信息①可知A应含有醛基,且含有7个C原子,应为,则B的结构简式为,则C的结构简式为,D的结构简式为,E的结构简式为,与乙醇发生酯化反应生成,对比F、H的结构简式可知G为。
(1)A的结构简式是,分子量为106,即质谱图的最大质荷比为106。
(2)C的结构简式为,官能团的名称为碳碳双键、羧基。
(3)E在硫酸、加热作用下与乙醇发生酯化反应生成F:。
(4)根据反应条件及有机物结构得出反应类型分别为氧化反应、消去反应。
(5)手性碳原子是指连接四个不同基团或原子的碳原子,即。
(6)K是F的同系物,分子量比F小14,且K能发生水解反应和银镜反应。则K中含有的基团为,苯环上两个支链,分别为与—OOCH;与—OOCH;与;与四种可能,每种又有邻、间、对三种位置,则共计12种。
(7)以环戊院和2-丁炔为原料制备化合物,环戊烷应先生成环戊烯,然后与2-丁炔发生加成反应生成,最后与溴发生加成可生成,由此写出反应的合成路线。
2023届新高考化学考前冲刺卷 【河北专版】: 这是一份2023届新高考化学考前冲刺卷 【河北专版】,共20页。
2023届高考化学考前冲刺卷 全国卷: 这是一份2023届高考化学考前冲刺卷 全国卷,共15页。试卷主要包含了病毒肆虐时,需做好消杀,设为阿伏加德罗常数的值等内容,欢迎下载使用。
2022届新高考化学考前冲刺卷 辽宁卷: 这是一份2022届新高考化学考前冲刺卷 辽宁卷,共20页。试卷主要包含了5 Fe 56,中国航天科技发展举世瞩目,下列化学用语的表示正确的是,范晔在《后汉书》中记载,代表阿伏加德罗常数的值等内容,欢迎下载使用。












