



最新高三化学第一轮复习 原电池 优质课件
展开一、原电池1.定义:把化学能转化为 的装置。
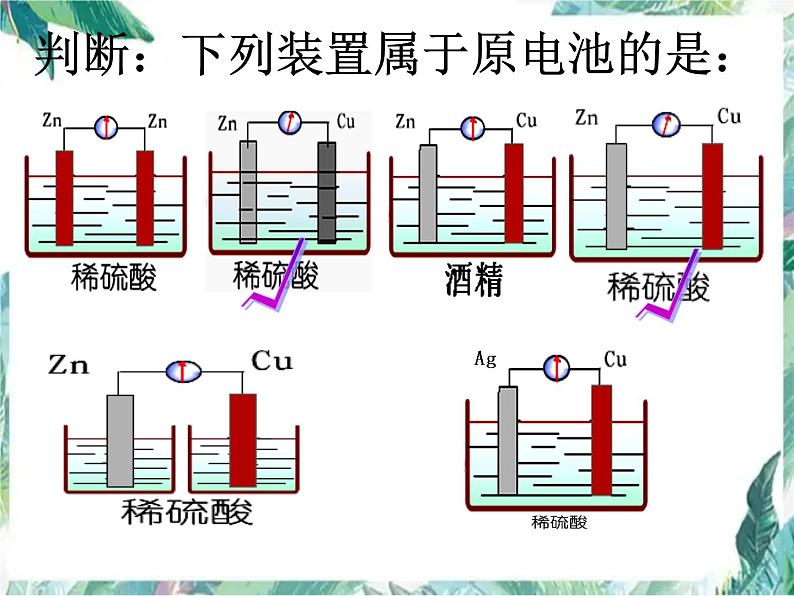
判断:下列装置属于原电池的是:
① 有活泼性不同的两电极② 有电解质溶液③ 形成闭合的回路④ 自发发生氧化还原反应
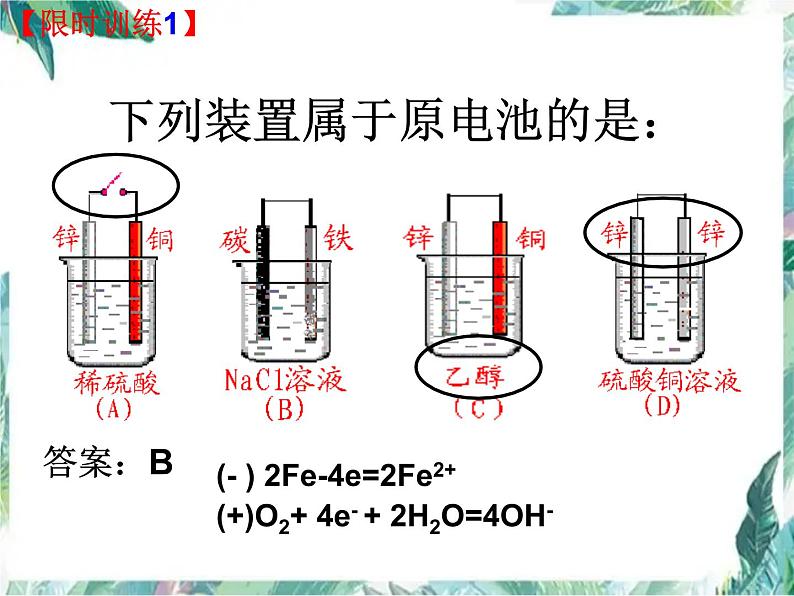
下列装置属于原电池的是:
(- ) 2Fe-4e=2Fe2+
(+)O2+ 4e- + 2H2O=4OH-
下列各组材料中,不能组成原电池的是( )
回归课本:必修2 P45第四题
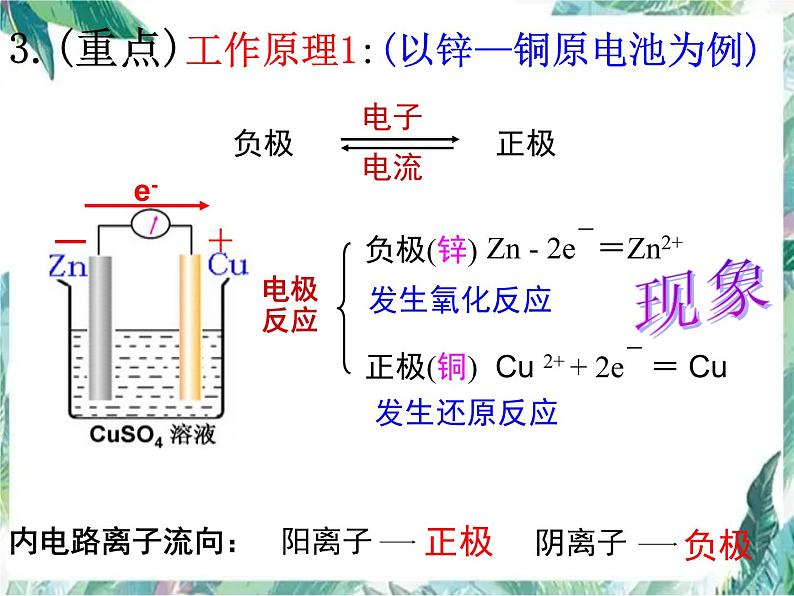
3.(重点)工作原理1:(以锌—铜原电池为例)
Zn - 2e-=Zn2+
Cu 2+ + 2e- = Cu
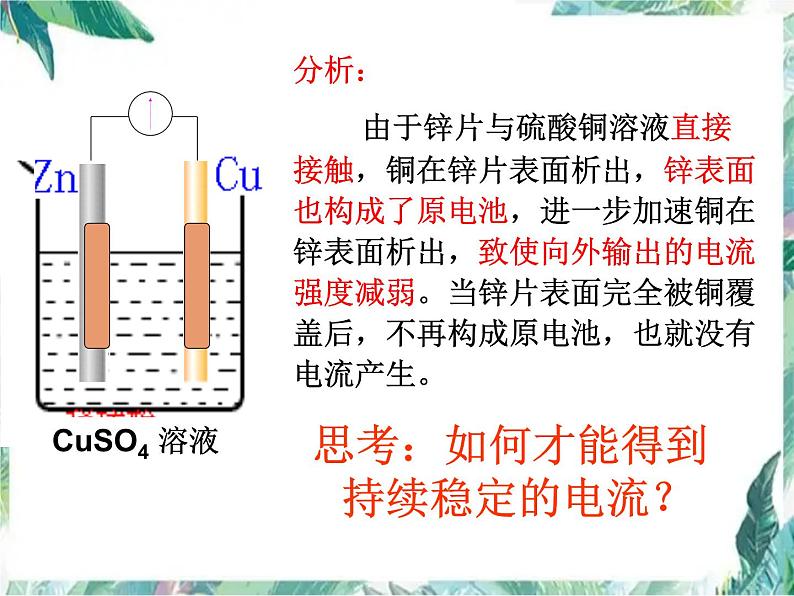
思考:如何才能得到持续稳定的电流?
分析: 由于锌片与硫酸铜溶液直接接触,铜在锌片表面析出,锌表面也构成了原电池,进一步加速铜在锌表面析出,致使向外输出的电流强度减弱。当锌片表面完全被铜覆盖后,不再构成原电池,也就没有电流产生。
(-)Zn-2e- =Zn2+
(+)Cu2+ +2e- =Cu
在同一烧杯中,一般电极与溶液含相同的金属元素
3.(重点)工作原理2:(以锌—铜原电池为例)
逐渐溶解,表面有红色物质生成
Zn-2e- =Zn2+
Cu2+ +2e- =Cu
Zn + Cu2+ =Zn2+ + Cu
铜锌原电池(如图9)工作时,下列叙述正确的是( ) A. 正极反应为:Zn-2e-=Zn2+ B. 电池反应为:Zn+Cu2+=Zn2+ +Cu C. 在外电路中,离子从负极流向正极 D. 盐桥中的K+移向ZnSO4溶液
4. 原电池原理的应用:
(1).比较金属活动性强弱
课本选修4 P73 第3题
把a、b、c、d四块金属片浸泡在稀H2SO4中,用导线两两相连,可以组成各种原电池。若a、b相连,a为负极;c、d相连,c为负极;a、c相连,c为正极;b、d相连,b为正极,则这四种金属的活动性由强到弱的顺序为 。
【2021全国卷改编】①②③④ 四种金属片两两相连浸入稀硫酸中都可组成原电池 ,①②相连时,外电路电流从②流向① ;①③相连时,③为正极,②④相连时,②有气泡逸出 ;③④ 相连时,③ 的质量减少 ,据此判断这四种金属活动性由大到小的顺序是( )A ①③②④ B ①③④② C ③ ④ ②① D ③ ① ②④
课本选修4 P73 第6题
根据下式所表示的氧化还原反应设计一个原电池:Zn(s)+Fe2+(aq)=Zn2+(aq)+Fe(s)(1)装置可采用烧杯和盐桥,画出此原电池的装置简图(2)注明原电池的正极和负极(3)注明外电路中电子的流向(4)写出两个电极上的电极反应
(2).设计原电池(突破)
Zn-2e-=Zn2+
Fe2+ + 2e-=Fe
请依据氧化还原反应:Fe3++Ag Fe2++Ag+ 设计的盐桥原电池(要求:用石墨、银作为电极)
控制适合的条件,将反应设计成如图所示的原电池。已知接通后,观察到电流计指针向右偏转。下列判断正确的是( )A.在外电路中,电子从石墨电极流向银电极B.盐桥中的K+移向乙烧杯C.一段时间后,电流计指针反向偏转,越过0刻度,向左边偏转D.电流计指针居中后,往甲烧杯中加入一定量的铁粉,电流计指针将向左偏转
依据氧化还原反应:2Ag+(aq) + Cu(s)=Cu2+(aq) + 2Ag(s)设计的盐桥原电池如下图1所示,试回答:(要求:在同一烧杯中,电极与溶液含相同的金属元素)(4)若电池工作时共转移了0.1ml电子,则正极的质量 (填 “增加、减小或不变”) g。 负极的质量 (填“增加、 减小或不变”) g。 (相对原子质量:H-1 Cu-64 Ag-108)
如锌与稀硫酸反应时加少量CuSO4溶液,产生H2 的速 率加快。
(4)用于金属的防护:如在船底镶上锌块或镁块保护船体
(3)加快氧化还原反应的速率例:实验室制备氢气方法:A、粗锌+浓硝酸 B、纯锌+稀硝酸C、粗锌+稀硫酸 D、纯锌+稀硫酸
一、原电池1、定义:2、组成条件:3、原电池的工作原理 (判断正负极)4、原电池原理的应用:
把化学能转化为电能的装置。
① 有活泼性不同的两电极 ② 有电解质溶液③ 形成闭合的回路 ④ 自发发生氧化还原反应
(1).比较金属活动性强弱 (2).设计原电池(3).加快氧化还原反应的速率 (4).用于金属的防护
Cu2++2e- =Cu
失e-,沿导线传递,有电流产生
1.铜锌原电池装置(如图),下列分析正确的是( )A.一段时间后两烧杯中c(Zn2+)、c(Cu2+)均减小B.原电池工作时,Cu电极流出电子,发生氧化反应D.盐桥中装有含氯化钾的琼脂,其作用是传递电子
某小组为研究原电池原理,设计如图装置,下列叙述正确的是( )A.装置Ⅰ,铜片上有O2逸出B.装置Ⅰ,锌片溶解,发生还原反应D.装置Ⅱ,外电路中,电子从锌电极流向铜电极
2024年高三化学一轮复习课件 原电池、化学电源及解题模型构建: 这是一份2024年高三化学一轮复习课件 原电池、化学电源及解题模型构建,共16页。PPT课件主要包含了“绿色电池”,“终极能源”,“清洁发电厂”,“超级发电机”,制氢难度大,液氢运输风险高,配套加氢站建设不足,成本高,氢氧燃料电池,失电子氧化反应等内容,欢迎下载使用。
2023届高三化学一轮复习 原电池 化学电源 课件: 这是一份2023届高三化学一轮复习 原电池 化学电源 课件,共37页。PPT课件主要包含了阴离子,工作原理,氧化还原反应,原电池,电解池,阳离子,失电子氧化反应,得电子还原反应,原电池名字前面为负极,二次电池等内容,欢迎下载使用。
6.2原电池 化学电源: 这是一份6.2原电池 化学电源,共60页。PPT课件主要包含了考点一,考点二,真题演练·素养通关,氧化还原反应,活泼性不同,闭合回路,答案C,答案B,答案D,AgNO3等内容,欢迎下载使用。












