

2023届高三化学一轮复习 原电池 化学电源 课件
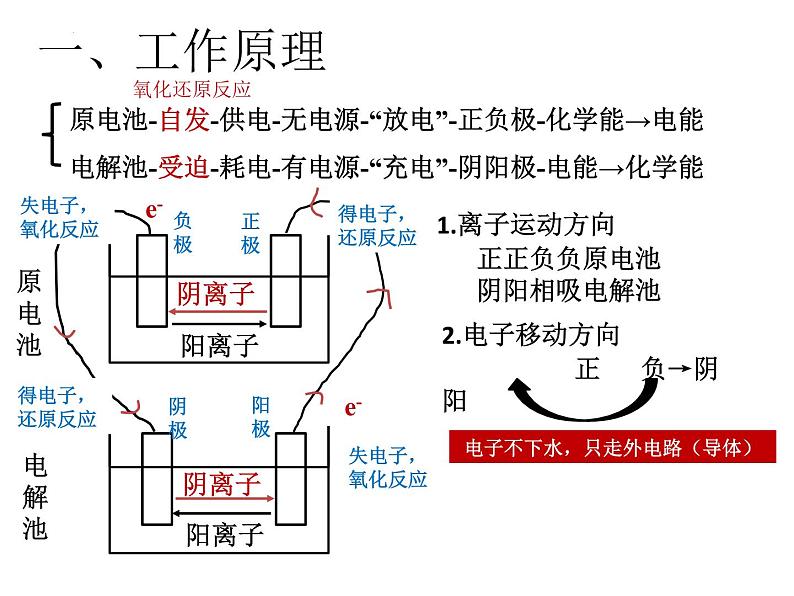
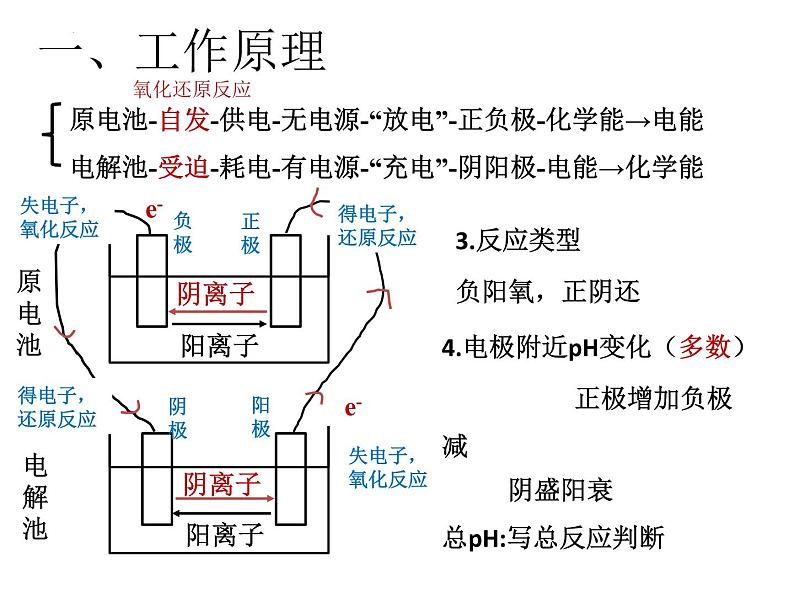
展开原电池-自发-供电-无电源-“放电”-正负极-化学能→电能电解池-受迫-耗电-有电源-“充电”-阴阳极-电能→化学能
1.离子运动方向 正正负负原电池 阴阳相吸电解池
2.电子移动方向 正 负→阴 阳
电子不下水,只走外电路(导体)
3.反应类型负阳氧,正阴还
4.电极附近pH变化(多数) 正极增加负极减 阴盛阳衰总pH:写总反应判断
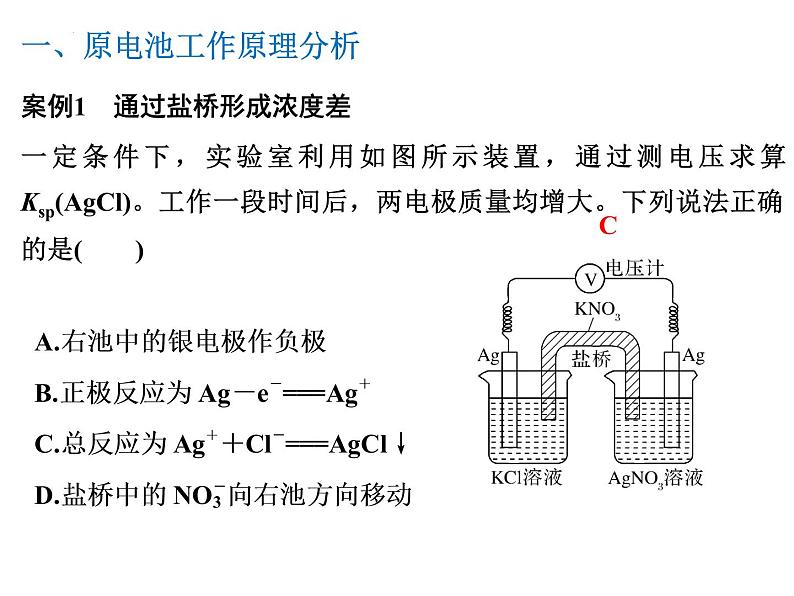
案例1 通过盐桥形成浓度差一定条件下,实验室利用如图所示装置,通过测电压求算Ksp(AgCl)。工作一段时间后,两电极质量均增大。下列说法正确的是( )
一、原电池工作原理分析
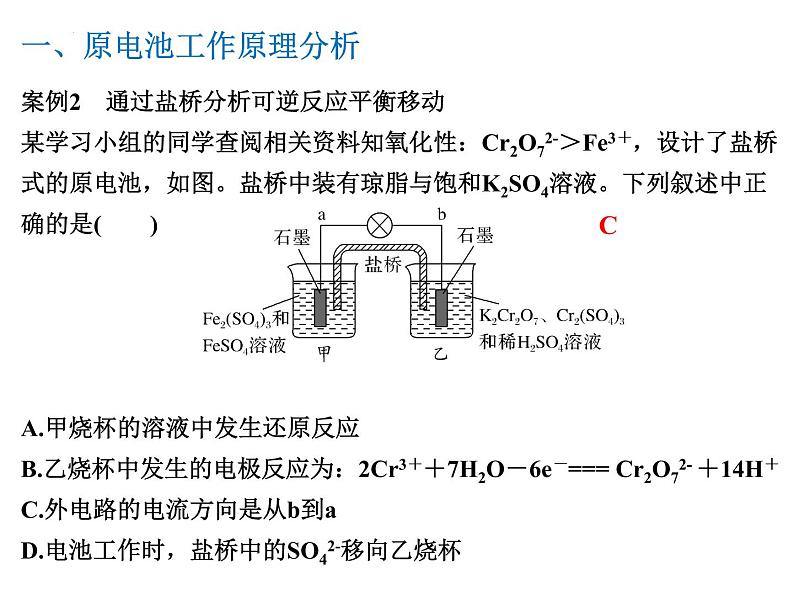
案例2 通过盐桥分析可逆反应平衡移动某学习小组的同学查阅相关资料知氧化性:Cr2O72->Fe3+,设计了盐桥式的原电池,如图。盐桥中装有琼脂与饱和K2SO4溶液。下列叙述中正确的是( )A.甲烧杯的溶液中发生还原反应B.乙烧杯中发生的电极反应为:2Cr3++7H2O-6e-=== Cr2O72- +14H+C.外电路的电流方向是从b到aD.电池工作时,盐桥中的SO42-移向乙烧杯
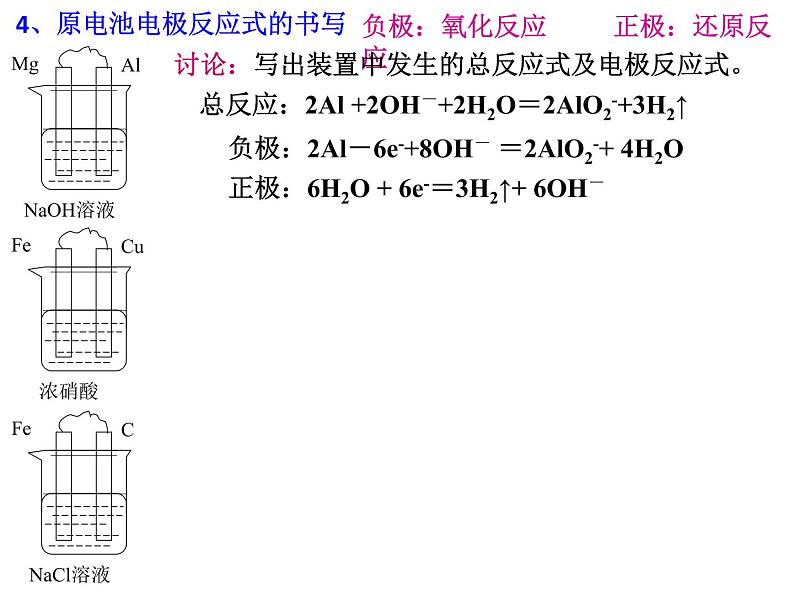
4、原电池电极反应式的书写
负极:氧化反应 正极:还原反应
总反应:2Al +2OH-+2H2O=2AlO2-+3H2↑
负极:2Al-6e-+8OH- =2AlO2-+ 4H2O正极:6H2O + 6e-=3H2↑+ 6OH-
讨论:写出装置中发生的总反应式及电极反应式。
1.几种重要原电池①铅蓄电池
Pb+ SO42- 2e- =PbSO4
PbO2 + 4H++SO42- +2e- =PbSO4 +2H2O
PbSO4 +2e- =Pb+ SO42-
PbSO4 +2H2O-2e- = PbO2 +4 H++ SO42-
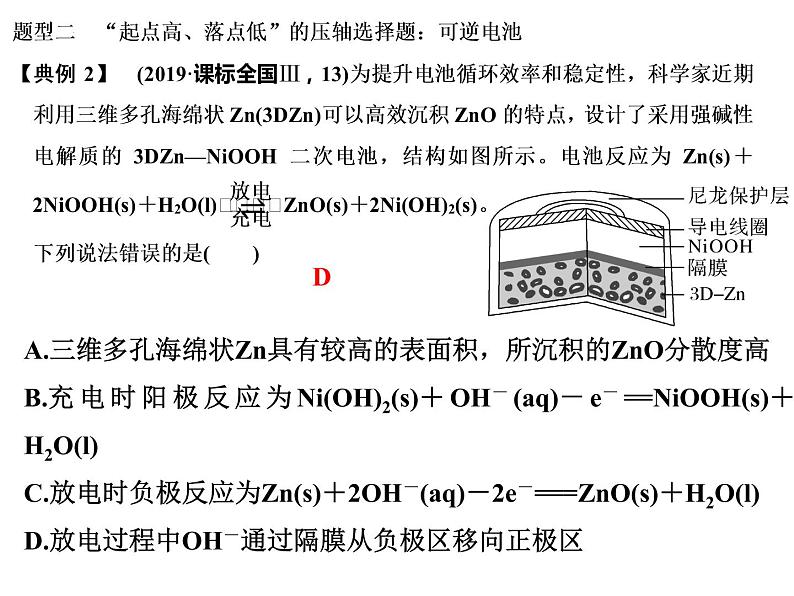
A.三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高B.充电时阳极反应为Ni(OH)2(s)+OH-(aq)-e-==NiOOH(s)+H2O(l)C.放电时负极反应为Zn(s)+2OH-(aq)-2e-===ZnO(s)+H2O(l)D.放电过程中OH-通过隔膜从负极区移向正极区
1.几种重要原电池②燃料电池
没点燃,无火苗,总反应不写点燃
CH4+2O2===CO2+2H2O
O2+4e-→2O2-
有H+要H+要变H2O
无H+要H2O要变OH-
要对应价态氧化物变酸根
①固体电解质(高温下传导O2-)
CH4-8e-+2H2O===CO2+8H+
2O2+8e-+8H+===4H2O
2O2+8e-+4H2O===8OH-
讨论5:锌–空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH–+2H2O===2Zn(OH)2。下列说法正确的是( )
A.充电时,电解质溶液中K+向阳极移动B.充电时,电解质溶液中c(OH-)减小
C.放电时,负极反应为:Zn+2OH–-2e–===Zn(OH) 2
D.放电时,电路中通过2ml电子,消耗氧气22.4L(标准状况)
2.电极反应式书写①反应物-生成物②得失电子守恒③电荷守恒(溶液看环境补H+r OH- )④元素守恒(配H补水,数氧)难写的电极反应式:金属作负极的:总→写负极→相减得正极燃料电池:总→正极→负极
2.电极反应式书写①反应物-生成物 化合价判断:Fe3O4 平均+8/3 实际+2、+3 Na2S2O3 平均+2 实际-2、+6有机物中:H +1 O -2 N -3 X -1 推CC6H10O5 ~6CO2~
8.一种三室微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示,图中有机废水中有机物可用C6H10O5表示。下列有关说法不正确的是( )A.Cl-由中间室移向左室B.X气体为CO2C.处理后的含NO3-废水的pH降低D.电路中每通过4 ml电子,产生标准状况下X气体的体积为22.4 L
某兴趣小组的同学用如图1所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流表的指针发生了偏转。请回答下列问题:(1)甲池为______(填“原电池”“电解池”或“电镀池”),通入CH3OH 电极的电极反应式为_________________________________。(2)乙池 A(石墨)电极的名称为_________(填“正极”“负极”“阴极”或“阳极”),乙池中总反应式为______________________________。
8OH- +CH3OH – 6e- == CO32- +6H2O
2.甲醇燃料电池是目前应用比较广泛的一种燃料电池,其工作原理如图2所示:写出M电极的电极方程式:___________________________________________
H2O + CH3OH – 6e- == CO2↑+6H+
3.利用如图3所示装置可制取H2,两个电极均为惰性电极,c为阴离子交换膜。右室的电极反应式为___________________________________________________
5OH- +C2H5OH – 4e- == CH3COO- +4H2O
4. 电解粗铜制精铜时,可采用NO2、O2和熔融NaNO3制作的燃料电池作电源,其原理如图4,该电池在使用过程中石墨 I电极上生成氧化物Y,则其正极的电极反应为:_____________________________________________________。
O2+2N2O5 +4e- ==4NO3-
5. SO2和NOx是主要大气污染物,利用图5装置可同时吸收SO2和NO。b为___极,阴极发生的反应式为________________________________________________。
2H++2HSO3- +2e- ==S2O42- +2H2O
6.一种可充电锂-空气电池如下图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。充电时,多孔碳材料上的电极反应式: ___________________________________
7. 锌银碱性电池的电解质溶液为 KOH 溶液,电池放电时正极的 Ag2O2 (O为-2价) 转化为Ag ,负极的Zn转化为K2Zn(OH)4,写出该电池正极反应式:__________________________________________________;电池的总反应式:____________________________________________________
4KOH+ Ag2O2 +2Zn +2H2O == 2Ag +2K2Zn(OH)4
2H2O +Ag2O2 +4e- ==2Ag +4OH-
8. 工业上使用下图装置,采用石墨作电极电解Na2CrO4溶液,使Na2CrO4转化为Na2Cr2O7,其转化原理为____________________________________________。
右侧溶液存在2CrO42- +2H+≒Cr2O72- +H2O,因阳极反应为2H2O– 4e- == O2↑+4H+,使c(H+)增大,平衡正向移动,所以Na2CrO4转化为Na2Cr2O7
平衡解释原因①摆平衡②说原因,平衡变化③结果(回应题意)
13.(1)高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中,如图1是高铁电池的模拟实验装置:
①该电池放电时正极的电极反应式为______________________________________________________________;
(2)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如下图所示,电池正极的电极反应式是________________,A是________。
FeO42-+4H2O+3e-===Fe(OH)3↓+5OH-
N2+8H++6e-===2NH4+
3.M、N、P、E四种金属,已知:①M+N2+===N+M2+;②M、P用导线连接放入NaHSO4溶液中,M表面有大量气泡逸出;③N、E用导线连接放入E的硫酸盐溶液中,电极反应为E2++2e-===E,N-2e-===N2+。则这四种金属的还原性由强到弱的顺序是________。提示 P>M>N>E
三、原电池的应用——判断金属活动性强弱
4.(1)将等质量的两份锌粉a、b分别加入过量的稀硫酸中,同时向a中加入少量的CuSO4溶液,产生H2的体积V(L)与时间t(min)的关系是________。(2)将过量的两份锌粉a、b分别加入定量的稀硫酸,同时向a中加入少量的CuSO4溶液,产生H2的体积V(L)与时间t(min)的关系是________。(3)将1中的CuSO4溶液改成CH3COONa溶液,其他条件不变,则图像是________。提示 (1)A (2)B (3)C
三、原电池的应用——加快反应速率
5.(1)完成原电池甲的装置示意图(如图),并作相应标注,要求:在同一烧杯中,电极与溶液含相同的金属元素。(2)以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时后,负极可观察到什么现象?(3)甲乙两种原电池哪种更有效地将化学能转化为电能?其原因是什么?
三、原电池的应用——设计原电池
(2020·三明市上学期期末质量检测)某课题组以纳米Fe2O3作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图)。下列说法正确的是( )A.放电时,正极的电极反应式为Fe2O3+6Li++6e-===2Fe+3Li2OB.该电池可以用水溶液做电解质溶液C.放电时,Fe作电池的负极,Fe2O3作电池的正极D.充电完成后,电池被磁铁吸引
P308 5.某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图。下列说法正确的是( )A.a为CH4,b为CO2B.CO3-向正极移动C.此电池在常温时也能工作D.正极电极反应式为:O2+2CO2+4e-===2CO3-
【典例1】 (2019·课标全国Ⅰ,12)利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如图所示。下列说法错误的是( )A.相比现有工业合成氨,该方法条件温和,同时还可提供电能B.阴极区,在氢化酶作用下发生反应H2+2MV2+===2H++2MV+C.正极区,固氮酶为催化剂,N2发生还原反应生成NH3D.电池工作时质子通过交换膜由负极区向正极区移动
5.(2019·安庆市五校联盟下学期开学考试)如图是一种锂钒氧化物热电池装置,电池总反应为xLi+LiV3O8===Li1+xV3O8。工作时,需先引发铁和氯酸钾反应使共晶体熔化,下列说法不正确的是( )A.组装该电池应当在无水、无氧的条件下进行B.整个过程的能量转化涉及化学能转化为热能和电能C.放电时LiV3O8电极反应为:xLi++LiV3O8-xe-===Li1+xV3O8D.充电时Cl-移向LiV3O8电极
4.某种浓差电池的装置如图所示,碱液室中加入电石渣浆液[主要成分为Ca(OH)2],酸液室通入CO2(以NaCl为支持电解质),产生电能的同时可生产纯碱等物质。下列叙述错误的是(双选)( )A.电子由M极经外电路流向N极B.N电极区的电极反应式为2H++2e-===H2↑C.在碱液室可以生成NaHCO3、Na2CO3D.放电一段时间后,酸液室溶液pH减小
4.(2019·福建厦门第一次质量检测)铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图。若上端开口关闭,可得到强还原性的H·(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的·OH(羟基自由基)。下列说法错误的是( )A.无论是否鼓入空气,负极的电极反应式均为Fe-2e-===Fe2+B.不鼓入空气时,正极的电极反应式为H++e-===H·C.鼓入空气时,每生成1 ml ·OH有2 ml电子发生转移D.处理含有草酸(H2C2O4)的污水时,上端开口应打开并鼓入空气
7.(2020·厦门外国语学校上学期月考)《科学美国人》曾评出的十大创新科技之一的碳呼吸电池,电池原理如下图所示,已知草酸铝[Al2(C2O4)3]难溶于水,则下列说法正确的是( )A.该装置将电能转变为化学能B.正极的电极反应为C2O42--2e-===2CO2C.每生成1 ml Al2(C2O4)3,有6 ml电子流过负载D.随着反应的进行草酸盐浓度不断减小
2024届高中化学一轮复习课件:原电池 化学电源: 这是一份2024届高中化学一轮复习课件:原电池 化学电源,共3页。PPT课件主要包含了原电池及组成条件,氧化还原,电极材料,AgNO3,CuSO4,Ag++e-Ag,CuNO32,题组一一次电池,题组三燃料电池等内容,欢迎下载使用。
2024届高考化学一轮复习原电池化学电源课件: 这是一份2024届高考化学一轮复习原电池化学电源课件,共35页。PPT课件主要包含了考点二化学电源,链接高考等内容,欢迎下载使用。
2024年高考化学一轮复习原电池化学电源课件: 这是一份2024年高考化学一轮复习原电池化学电源课件,共1页。













