



2022年中考化学第二轮专题复习题型五计算题课件PPT
展开这是一份2022年中考化学第二轮专题复习题型五计算题课件PPT,共25页。PPT课件主要包含了表格型,实验操作图型,坐标曲线型等内容,欢迎下载使用。
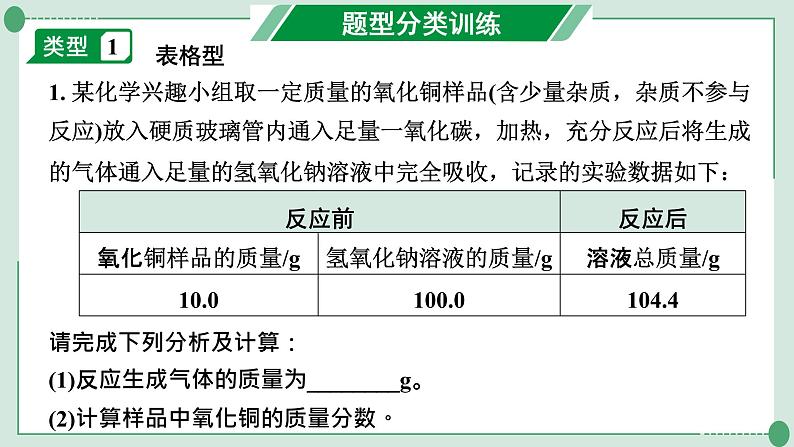
1. 某化学兴趣小组取一定质量的氧化铜样品(含少量杂质,杂质不参与反应)放入硬质玻璃管内通入足量一氧化碳,加热,充分反应后将生成的气体通入足量的氢氧化钠溶液中完全吸收,记录的实验数据如下:
请完成下列分析及计算:(1)反应生成气体的质量为________g。(2)计算样品中氧化铜的质量分数。
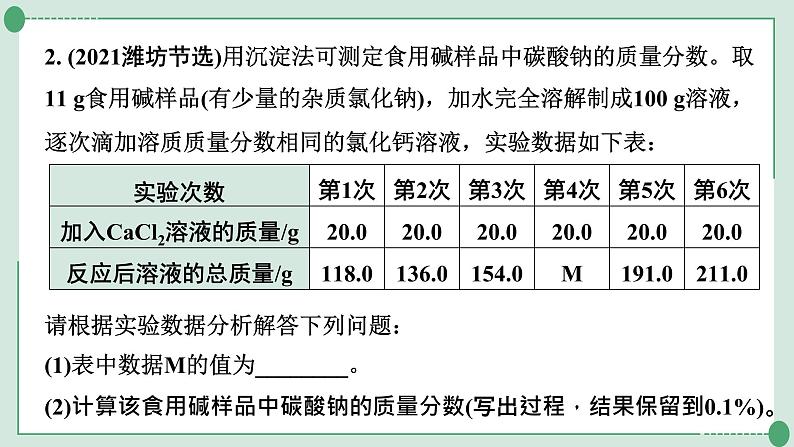
2. (2021潍坊节选)用沉淀法可测定食用碱样品中碳酸钠的质量分数。取11 g食用碱样品(有少量的杂质氯化钠),加水完全溶解制成100 g溶液,逐次滴加溶质质量分数相同的氯化钙溶液,实验数据如下表:
请根据实验数据分析解答下列问题:(1)表中数据M的值为________。(2)计算该食用碱样品中碳酸钠的质量分数(写出过程,结果保留到0.1%)。
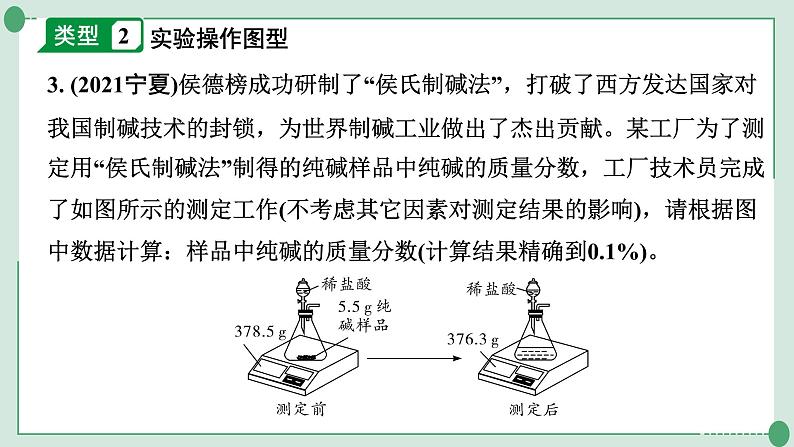
3. (2021宁夏)侯德榜成功研制了“侯氏制碱法”,打破了西方发达国家对我国制碱技术的封锁,为世界制碱工业做出了杰出贡献。某工厂为了测定用“侯氏制碱法”制得的纯碱样品中纯碱的质量分数,工厂技术员完成了如图所示的测定工作(不考虑其它因素对测定结果的影响),请根据图中数据计算:样品中纯碱的质量分数(计算结果精确到0.1%)。
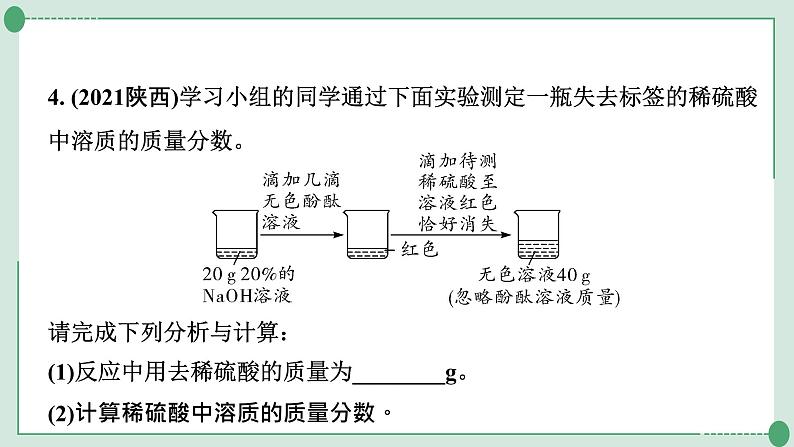
4. (2021陕西)学习小组的同学通过下面实验测定一瓶失去标签的稀硫酸中溶质的质量分数。
请完成下列分析与计算:(1)反应中用去稀硫酸的质量为________g。(2)计算稀硫酸中溶质的质量分数。
5. (2021黄石)取一氧化碳还原氧化铜实验的固体残留物20 g,向其中加入稀硫酸,剩余固体质量与加入稀硫酸质量关系如图所示,请回答下列问题。
(1)所取固体残留物中铜的质量为________ g。(2)求a点处溶液中溶质的质量分数(写出计算过程)。
6. (2021岳阳)向50.8 g溶质质量分数为5%的H2O2溶液中加入2 g MnO2粉末。反应开始后产生氧气的总质量随时间的变化关系如图所示,请回答:
(1)从反应开始到t时,产生氧气的总质量是______g。(2)试计算:t时,剩余H2O2溶液的溶质质量分数(写出计算过程)。
7. (2021福建黑白卷)太空空间工作站必须为宇航员提供可靠的水和氧气。已知每位宇航员每天约需要氧气0.64 kg,若用高氯酸锂来提供氧气(反应原理为LiClO4 LiCl+2O2↑),则容纳5人的空间站每天需要消耗高氯酸锂的质量是多少?(写出计算过程,计算结果保留2位小数)
文字叙述型(5年5考)
8. (2021徐州)某同学用溶质质量分数为15%的稀盐酸和大理石反应来制取二氧化碳气体:(1)用20.3 g溶质质量分数为37%的浓盐酸能配制上述稀盐酸_____ g(结果精确到1 g)。(2)若需收集10瓶(每瓶以125 mL计算)二氧化碳气体,至少需要多少克上述稀盐酸与足量的大理石反应才能制得(实验条件下二氧化碳的密度为2 g/L)?(写出计算过程,结果精确到0.01g)
(1)50(2)解:设收集10瓶二氧化碳气体所需上述稀盐酸的质量为x10瓶二氧化碳的质量为10×0.125 L×2 g/L=2.5 gCaCO3+2HCl === CaCl2+H2O+CO2↑ 73 44 x×15% 2.5g
x≈27.65g答:要收集10瓶二氧化碳气体至少需要15%的稀盐酸的质量约为27.65g。
10. (2021厦门5月质检)硫酸镁化肥在农业种植中有重要作用。某工厂以氧化镁矿粉和硫酸为原料制取硫酸镁,反应原理:MgO+H2SO4=== MgSO4+H2O。现用含MgO 48%的氧化镁矿粉25 t与足量硫酸反应,可制得硫酸镁的质量是多少?
11. (2021云南)氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中制备KClO3的化学反应方程式为3Cl2+6KOH 5KCl+KClO3+3H2O。若用Cl2与200 g的KOH溶液恰好完全反应,反应后溶液质量为221.3 g。计算:(1)参加反应的氯气的质量为________g。(2)所用KOH溶液中溶质的质量分数是多少?
以求100 g碳酸钙高温分解产生CO2的质量为例:
相关课件
这是一份2023年江西省中考化学第二轮专题复习课件-专题五 综合计算题,共33页。PPT课件主要包含了生石灰,熟石灰,CuSO4,在空气中充分加热,降温结晶,3或24等内容,欢迎下载使用。
这是一份2022年中考化学第二轮专题复习---题型六跨学科试题科普阅读题课件PPT,共28页。PPT课件主要包含了除去空气中的二氧化碳,澄清石灰水变浑浊,的速度,H2O+CO2↑,科普阅读题,合成纤维,过滤性,或绝热性和吸油性,屏蔽性,催化裂化等内容,欢迎下载使用。
这是一份2022年中考化学第二轮专题复习题型四实验探究题课件PPT,共60页。PPT课件主要包含了有关生产生活的探究,向量筒内滴加水使量,取的水更精确,先增大后减小,PFS溶液,延长静置时间,水样的pH变化,引起雨水pH增大,纯碱或苏打,产生氧气缓慢等内容,欢迎下载使用。












