

所属成套资源:2022届高考化学二轮复习全套提升模拟卷含答案
- 2022届高考化学二轮复习提升模拟卷6含答案 试卷 0 次下载
- 2022届高考化学二轮复习提升模拟卷7含答案 试卷 0 次下载
- 2022届高考化学二轮复习提升模拟卷9含答案 试卷 0 次下载
- 2022届高考化学二轮复习提升模拟卷10含答案 试卷 0 次下载
- 2022届高考化学二轮复习提升模拟卷11含答案 试卷 0 次下载
2022届高考化学二轮复习提升模拟卷8含答案
展开
这是一份2022届高考化学二轮复习提升模拟卷8含答案,共14页。试卷主要包含了8],0 ml/L计算),2×10-6等内容,欢迎下载使用。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5
第Ⅰ卷
一、选择题(本题共7小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。)
1.我国改革开放40周年取得了很多标志性成果,下列说法不正确的是( )
A.“中国天眼”的镜片材料为SiC,属于新型无机非金属材料
B.“蛟龙”号潜水器所使用的钛合金材料具有强度大、密度小、耐腐蚀等特性
C.北斗导航专用ASIC硬件结合国产处理器打造出一颗真正意义的“中国芯”,其主要成分为SiO2
D.港珠澳大桥设计使用寿命120年,水下钢柱镶铝块防腐的方法为牺牲阳极的阴极保护法
2.下列指定反应的离子方程式正确的是( )
A.Ca(CH3COO)2溶液与硫酸反应:Ca2++SOeq \\al(2-,4)===CaSO4↓
B.Cl2与热的NaOH溶液反应:Cl2+6OH-eq \(=====,\s\up7(△))Cl-+ClOeq \\al(-,3)+3H2O
C.电解K2MnO4碱性溶液制KMnO4:2MnOeq \\al(2-,4)+2H+eq \(=====,\s\up7(电解))2MnOeq \\al(-,4)+H2↑
D.NaHCO3与过量Ba(OH)2溶液反应:HCOeq \\al(-,3)+Ba2++OH-===BaCO3↓+H2O
3.下列关于有机化合物的说法正确的是( )
A.2甲基丁烷也称异丁烷
B.的羧基位置异构体数比的羟基位置异构体数少(不考虑立体异构)
C.乙醇、糖类和蛋白质都是人体必需的营养物质
D.合成橡胶与光导纤维都属于有机高分子材料
4.实验室利用废弃旧电池的铜帽(主要成分为Zn和Cu)回收Cu并制备ZnO的部分实验过程如图所示:
下列叙述错误的是( )
A.“溶解”操作中可用酸性条件下不断鼓入O2代替H2O2
B.铜帽溶解后,将溶液加热至沸腾以除去溶液中过量的H2O2
C.与加入锌粉反应的离子为Cu2+、H+
D.“过滤”操作后,将滤液蒸干、高温灼烧即可制取纯净的ZnO
5.如图所示的X、Y、Z、W四种短周期元素的原子最外层电子数之和为22,下列说法正确的是( )
A.X、Y、W三种元素最低价氢化物的沸点依次升高
B.Z、X、W三种元素氧化物对应水化物的酸性依次增强
C.由X、W和氢三种元素形成的化合物中只含共价键
D.X、Z形成的二元化合物是一种新型无机非金属材料
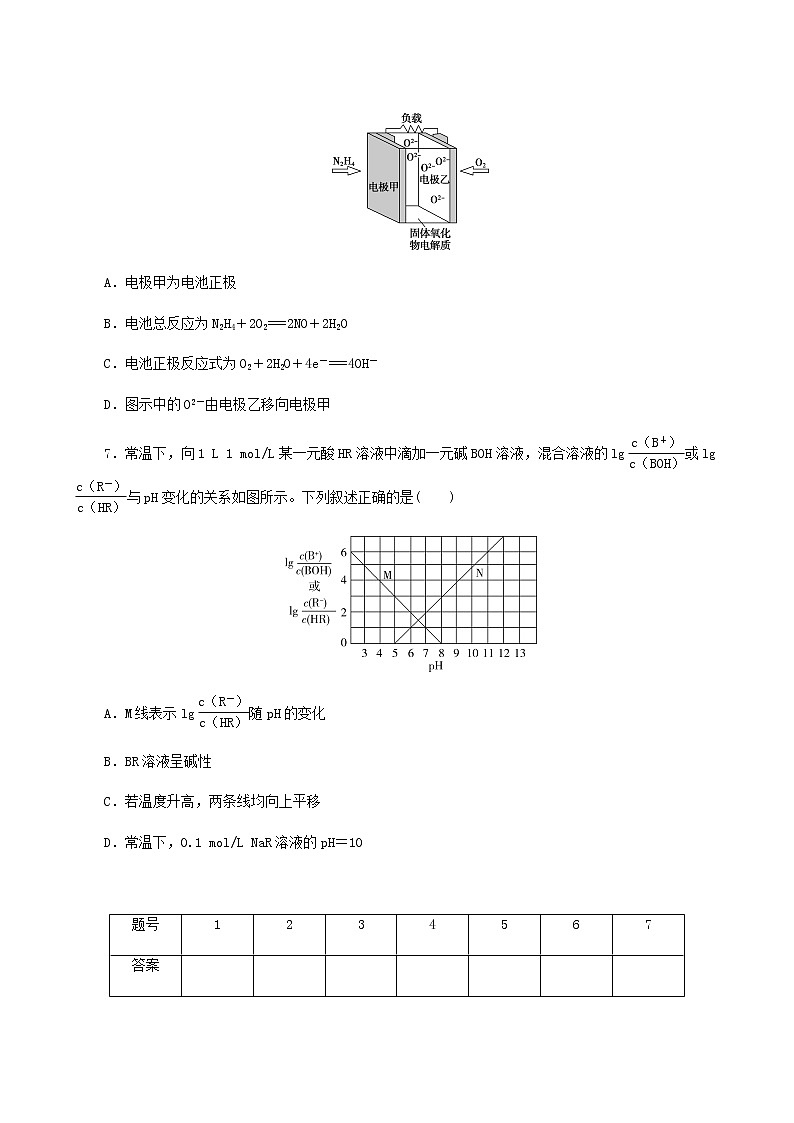
6.液体燃料电池相比于气体燃料电池具有体积小、无须气体存储装置等优点。某科研人员设计了以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池(如图所示)。该固体氧化物电解质的工作温度高达700~900 ℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是( )
A.电极甲为电池正极
B.电池总反应为N2H4+2O2===2NO+2H2O
C.电池正极反应式为O2+2H2O+4e-===4OH-
D.图示中的O2-由电极乙移向电极甲
7.常温下,向1 L 1 ml/L某一元酸HR溶液中滴加一元碱BOH溶液,混合溶液的lgeq \f(c(B+),c(BOH))或lgeq \f(c(R-),c(HR))与pH变化的关系如图所示。下列叙述正确的是( )
A.M线表示lgeq \f(c(R-),c(HR))随pH的变化
B.BR溶液呈碱性
C.若温度升高,两条线均向上平移
D.常温下,0.1 ml/L NaR溶液的pH=10
第Ⅱ卷
二、非选择题(包括必考题和选考题两部分。第8~10题为必考题,每个试题考生都必须作答。第11、12题为选考题,考生根据要求作答。)
(一)必考题(共43分)
8.(14分)四氯化锡常用作媒染剂和有机合成中的氯化催化剂,实验室制备四氯化锡的装置示意图和有关信息如下(部分夹持装置及加热仪器省略):
有关信息:①Sn的熔点为231 ℃,将金属锡熔融,缓缓通入干燥氯气进行反应,即可生成四氯化锡;②无水四氯化锡的熔点为-33 ℃,沸点为114.1 ℃;③无水四氯化锡遇水强烈水解,并产生有刺激性气味的白色烟雾,产物之一为SnO2。
(1)仪器A的名称是____________;仪器B的名称是____________。
(2)制备无水四氯化锡时各装置的连接顺序是( )→( )→( )→( )→( )(填装置序号)。
(3)Ⅰ、Ⅱ两处装置均需用酒精灯加热,实验开始时先点燃的酒精灯是________(填“Ⅰ”或“Ⅱ”)处的;该套装置还有一处不妥,该处是__________________________________。
(4)试剂X可能是________________;试剂Y可能是________________。
(5)SnCl4 蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为________________________________________。
(6)该小组的甲同学提出,可利用标准NaOH溶液滴定Ⅱ中剩余溶液的方法测定出盐酸与MnO2 反应的最低浓度。
①滴定时所用指示剂最好是________[填“甲基橙”“酚酞”或“石蕊”,假设开始出现Mn(OH)2 沉淀时的pH约为6.8]。
②假设实验时从Ⅱ中准确取出V2 mL剩余溶液并稀释到V3 mL,然后用0.100 0 ml · L-1 的 NaOH溶液进行滴定,滴定终点时消耗掉V1 mL NaOH溶液,则盐酸与MnO2 反应时的最低浓度应为________。
9.(14分)过渡金属催化的反应已成为重要的合成工具,贵金属成本高,会对环境造成不利影响,因此研究成本低廉的含锰、铁、钴、镍、铜等催化剂成为热点。以下是以含钴废渣(主要成分CO、C2O3,还含有Al2O3、ZnO等杂质)为原料制备CCO3的一种工艺流程:
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 ml/L计算):
回答下列问题:
(1)“酸浸”时通入SO2的目的是 ____________,反应的离子方程式为________________________________________________________________________。
(2)“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是________________________________________________________________________
________________________________________________________________________。
(3)“沉钴”时Na2CO3溶液需缓慢滴加的原因是
________________________________________________________________________
________________________________________________________________________。
(4)用得到的CCO3等为原料采用微波水热法和常规水热法可以制得两种CxNi(1-x)Fe2O4(其中C、Ni均为+2价),均可用作H2O2分解的催化剂,有较高的活性。如图是两种不同方法制得的CxNi(1-x)Fe2O4在10 ℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。
由图中信息可知:____________法制取得到的催化剂活性更高;C2+、Ni2+两种离子中催化效果更好的是____________。
(5)用纯碱沉淀转化法也可以从草酸钴(CC2O4)废料得到CCO3,向含有CC2O4固体的溶液中滴加Na2CO3溶液,当有CCO3沉淀生成时,溶液中eq \f(c(COeq \\al(2-,3)),c(C2Oeq \\al(2-,4)))=____________。[已知Ksp(CC2O4)=6.3×10-8;Ksp (CCO3)=1.4×10- 13]
10.(15分)乙炔可用于照明、焊接及切割金属,也是制备乙醛、醋酸、苯、合成橡胶、合成纤维等的基本原料。甲烷催化裂解是工业上制备乙炔的方法之一。回答下列问题:
(1)已知:CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1=-890 kJ/ml;C2H2(g)+eq \f(5,2)O2(g)===2CO2(g)+H2O(l) ΔH2=-1 300 kJ/ml;2H2(g)+O2(g)===2H2O(l) ΔH3=-572 kJ/ml。
则2CH4(g)===C2H2(g)+3H2(g) ΔH=________kJ/ml。
(2)某科研小组尝试利用固体表面催化工艺进行CH4的裂解。
①若用、、和分别表示CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图1所示。从吸附到解吸的过程中,能量状态最低的是________(填标号),其理由是___________________________________________。
②在恒容密闭容器中充入a ml甲烷,测得单位时间内在固体催化剂表面CH4的转化率[α(CH4)]与温度(t/℃)的关系如图2所示,t0℃后CH4的转化率突减的原因可能是________。
(3)甲烷分解体系中几种气体的平衡分压(p/Pa)与温度(t/℃)的关系如图3所示。
①t1℃时,向V L恒容密闭容器中充入0.12 ml CH4,只发生反应2CH4(g)C2H4(g)+2H2(g),达到平衡时,测得p(C2H4)=p(CH4)。CH4的平衡转化率为________。在上述平衡状态某一时刻,改变温度至t2℃,CH4以0.01 ml/(L·s)的平均速率增多,则t1________t2(填“>”“=”或“<”)。
②在图3中,t3℃时,化学反应2CH4(g)C2H2(g)+3H2(g)的压强平衡常数Kp=________。
(二)选考题(共15分。请考生从2道题中任选一题作答。如果多做,则按所做的第一题计分。)
11.(15分)[化学——选修3:物质结构与性质]
氢能被视为21世纪最具发展潜力的清洁能源,开发高效储氢材料是氢能利用的重要研究方向。
(1)H3BNH3是一种潜在的储氢材料,其中N原子的价电子轨道表达式为________________________________________________________________________。
(2)制备H3BNH3的化学反应为3CH4+2(HB===NH)3+6H2O===3CO2+6H3BNH3。其中(HB===NH)3是六元环状物质,与其互为等电子体的有机物分子式为________。CH4、H2O、CO2的键角由大到小的顺序为________。B、C、N、O第一电离能由大到小的顺序为________。
(3)C16S8是新型环烯类储氢材料,研究证明其分子呈平面结构,如图1所示。
①C16S8分子中C原子和S原子的杂化轨道类型分别为________。
②测得C16S8中碳硫键的键长介于C—S和C===S键之间,其原因可能是________________________________________________________________________。
(4)某种铜银合金晶体具有储氢功能,它是面心立方最密堆积结构,Cu原子位于面心,Ag原子位于顶点,H原子可进入由Cu原子和Ag原子构成的四面体空隙中。若将Cu、Ag原子等同看待,该晶体储氢后的晶胞结构与CaF2(如图2)相似,该晶体储氢后的化学式为________。
(5)MgH2是金属氢化物储氢材料,其晶胞如图3所示,已知该晶体的密度为ρ g/cm3,则该晶胞的体积为________cm3(用含ρ、NA的代数式表示)。
12.(15分)[化学——选修5:有机化学基础]
有机化合物G是抗肿瘤药物中一种关键的中间体,由烃A(C7H8)合成G的路线如下(部分反应条件及副产物已略去):
已知:①B比A的相对分子质量大79;
②D的分子式为C2H2O3,可发生银镜反应,且具有酸性。
回答下列问题:
(1)测定有机物的组成和结构的现代分析方法中,测定相对分子质量时使用的仪器名称是________。
(2)A的名称是________。由A生成B的化学方程式为________________________________________________________________________。
(3)D中所含官能团的名称是________________。
(4)反应③、④的反应类型分别是____________、____________。
(5)下列说法不正确的是________(填字母)。
A.可用FeCl3溶液鉴别C和E
B.有机物E中含有手性碳原子
C.B转化为C的第一步反应中的试剂甲为NaOH溶液
D.有机物E能发生加成反应,不能发生缩聚反应
(6)G的同分异构体中,符合下列要求的有________种(不考虑立体异构)。
①属于芳香族化合物;
②既能发生银镜反应,又能发生水解反应。
(7)设计由丙酮酸()为起始原料制备乙酸乙酯的合成路线(无机试剂任选):________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
合成反应流程图示例如下:
Aeq \(――→,\s\up7(反应物),\s\d5(反应条件))Beq \(――→,\s\up7(反应物),\s\d5(反应条件))……―→H
高考仿真模拟卷(八)
1.C
2.D [解析] (CH3COO)2Ca溶液与硫酸反应的离子反应为2CH3COO-+2H++Ca2++SOeq \\al(2-,4)===CaSO4↓+2CH3COOH,A错误;Cl2与热的NaOH溶液发生氧化还原反应生成NaClO3,正确的离子方程式为3Cl2+6OH-===5Cl-+ClOeq \\al(-,3)+3H2O,B错误;电解K2MnO4制KMnO4,阳极上MnOeq \\al(2-,4)放电生成MnOeq \\al(-,4),阴极上水放电生成OH-,总反应方程式为2K2MnO4+2H2Oeq \(=====,\s\up7(电解))2KMnO4+2KOH+H2↑,离子方程式为2MnOeq \\al(2-,4)+2H2Oeq \(=====,\s\up7(通电))2MnOeq \\al(-,4)+2OH-+H2↑,C错误;Ba(OH)2溶液中加入少量NaHCO3溶液,设量少的碳酸氢钠为1 ml,根据其需要可知所需的Ba2+的物质的量为1 ml,OH-的物质的量为1 ml,则该反应的离子方程式为HCOeq \\al(-,3)+Ba2++OH-===BaCO3↓+H2O,D正确。
3.B [解析] 2甲基丙烷的习惯命名为异丁烷,A不正确;的羧基位置异构体为5种,的羟基位置异构体为6种,B正确;乙醇不是人体必需的营养物质,C不正确;光导纤维的主要成分为SiO2,不属于有机高分子材料,D不正确。
4.D [解析] 酸性条件下,O2也可氧化Cu,A正确;加热时H2O2可分解为H2O和O2,B正确;Cu2+、H+能氧化Zn,C正确;过滤后滤液中含有ZnSO4,将其滤液加热蒸干、高温灼烧无法得到ZnO,D错误。
5.D [解析] 根据在短周期中,由X、Y、Z、W的位置可知,X和Y位于第二周期,Z和W位于第三周期,设Z元素原子的最外层电子数为a,则X、Y、W的原子的最外层电子数分别为a+1、a+2、a+3;有a+a+1+a+2+a+3=22,得a=4,Z的最外层电子数为4,Z元素为Si,同理可知X、Y、W分别为N、O、Cl。X、Y、W三种元素最低价氢化物分别为NH3、H2O、HCl,由于NH3、H2O分子间存在氢键,沸点会升高,因此沸点最高的是H2O,最低的是HCl,A项错误;Z、X、W元素氧化物对应的水化物的酸性不一定增强, 如Cl的含氧酸中的HClO为弱酸,其酸性比N的最高价氧化物的水化物HNO3的弱,B项错误;X、W和H三种元素形成的化合物为NH4Cl等,NH4Cl为离子化合物,其中既存在离子键又存在共价键,C项错误;Z和X形成的二元化合物为氮化硅,氮化硅是一种重要的结构陶瓷材料,它是一种新型无机非金属材料,D项正确。
6.D [解析] A.该燃料电池中,通入氧化剂氧气的电极为正极,通入N2H4的电极为负极,即甲为负极,故A错误;B.反应生成物均为无毒无害的物质,负极上反应生成氮气,则电池总反应为N2H4+O2===N2+2H2O,故B错误;C.正极上氧气得电子发生还原反应,电极反应式为O2+4e-===2O2-,故C错误;D.放电时,阴离子向负极移动,即O2-由电极乙移向电极甲,故D正确。
7.C [解析] 对于一元酸HRH++R-,当温度不变时,Ka=eq \f(c(H+)·c(R-),c(HR))不变,pH越大,c(H+)越小,则eq \f(c(R-),c(HR))越大,则lgeq \f(c(R-),c(HR))越大,对比图像可知N线表示lgeq \f(c(R-),c(HR))随pH的变化,故A错误;取N线上的任意一点,如pH=5时,即c(H+)=10-5 ml/L,lgeq \f(c(R-),c(HR))=0,eq \f(c(R-),c(HR))=1,则Ka=10-5,M线表示lgeq \f(c(B+),c(BOH))随pH的变化,取M线上的任意一点,如pH=8时,即c(OH-)=10-6 ml/L,lgeq \f(c(B+),c(BOH))=0,则Kb=10-6,由于Kbt2。②t3℃时,p(C2H2)=10-1.3 Pa、p(H2)=104 Pa、p(CH4)=103 Pa,Kp=eq \f(p(C2H2)×p3(H2),p2(CH4))=104.7。
[答案] (1)+378(2分)
(2)①A(2分) CH4的裂解为吸热反应,CH4分子活化需吸收能量(2分)
②温度过高,催化剂活性降低(2分)
(3)①66.7%(2分) >(2分)
②104.7(3分)
11.[解析] (1)氮原子价电子排布式为2s22p3,轨道表达式为。(2)(HB=NH)3分子共有12个原子、30个价电子,故其等电子体为C6H6。CH4、H2O、CO2三种分子的中心原子杂化轨道类型分别为sp3、sp3、sp,故键角最大的是CO2,由于H2O中存在孤电子对,孤电子对对成键电子对有较大的排斥作用,导致其键角变小,故键角最小的分子是H2O。同一周期从左到右第一电离能总体趋势是增大的,但N原子p轨道为半充满的稳定状态,故第一电离能N>O,则第一电离能由大到小的顺序为N>O>C>B。(3)①由图1知,碳原子形成了3个σ键且无孤电子对,故为sp2杂化;S都形成了2个σ键且均有2个孤电子对,故为sp3杂化。②硫原子上的孤电子对可能与碳原子上的没有杂化的p电子参与大π键的形成,从而导致碳硫键具有某些双键的性质。(4)面心立方结构中,6个面上各有一个铜原子、8个顶点上各有1个银原子,根据均摊原理易求出一个晶胞中含有3个铜原子、1个银原子,化学式为Cu3Ag。根据题给条件知,贮氢后的晶胞中氢原子位于晶胞体内,数目为8,故相应化学式为Cu3AgH8。(5)一个晶胞中含有2个“MgH2”,一个晶胞的质量为eq \f(2×26,NA) g,设晶胞体积为V cm3,则eq \f(2×26 ,NA)=V×ρ,V=eq \f(52,ρNA)。
[答案] (1)(2分)
(2)C6H6(1分) CO2>CH4>H2O(2分) N>O>C>B(2分)
(3)①sp2、sp3(各1分)
②C16S8分子中碳硫键具有一定的双键性质(2分)
(4)Cu3AgH8(2分)
(5)eq \f(52,ρNA)(2分)
12.[解析] (1)测定有机物相对分子质量的方法有许多,质谱法是近代发展起来的快速、微量、精确测定相对分子质量的方法,所用的仪器叫质谱仪。
(2)A的分子式为C7H8,且由合成路线可知A中含有苯环,故A为,名称为甲苯。将A和E的结构简式进行对比可知,苯环上甲基的邻位和间位各有一个取代基,而甲基会使苯环的邻位和对位活泼,且B比A相对分子质量大79,所以由A生成B是甲苯发生邻位溴代的反应,其化学方程式为
(3)由已知信息,D可发生银镜反应,且具有酸性,说明D中含有醛基和羧基。
(4)C为邻羟基甲苯,D为OHC—COOH,根据C、D、E三种有机物的结构简式可知,反应③为加成反应。由合成路线可知,反应④中E中的醇羟基去氢变为F中的羰基,故该反应为氧化反应。
(5)A项,根据合成路线中E的结构简式可知, E中含有酚羟基,C为邻羟基甲苯,也含有酚羟基,所以二者不能用氯化铁溶液鉴别,错误;B项,E中,与醇羟基相连的碳上连接了4个不同的原子或原子团,该碳原子为手性碳原子,正确;C项,B→C是邻溴甲苯生成邻羟基甲苯,发生的是卤代烃的水解反应,需要加入NaOH溶液,正确;D项,E中含有苯环,可以发生加成反应,且E有羟基和羧基,可以发生缩聚反应,错误。
(6)根据题意,G的同分异构体的结构中要有苯环、醛基、酯基,但是侧链上只有两个O,说明结构中有—OOCH。苯环侧链取代基分两种情况:①取代基为甲基和—OOCH,有邻、间、对3种结构;②取代基为—CH2OOCH,有1种结构。故满足条件的G的同分异构体有4种结构。
(7)先将丙酮酸在一定条件下转化为乙醛,然后将一部分乙醛在催化剂作用下与氢气加成转化为乙醇,另一部分乙醛发生催化氧化反应转化为乙酸,最后乙酸和乙醇发生酯化反应合成乙酸乙酯。
[答案] (1)质谱仪(2分)
(2)甲苯(1分)
(3)醛基、羧基(2分)
(4)加成反应(1分) 氧化反应(1分)
(5)AD(2分)
(6)4(2分)
(7)(2分)
X
Y
Z
W
题号
1
2
3
4
5
6
7
答案
金属离子
开始沉淀的pH
沉淀完全的pH
C2+
7.6
9.4
Al3+
3.0
5.0
Zn2+
5.4
8.0
相关试卷
这是一份高考化学二轮复习提升模拟卷12含答案,共14页。试卷主要包含了选择题等内容,欢迎下载使用。
这是一份高考化学二轮复习提升模拟卷9含答案,共14页。试卷主要包含了5 Ca 40 Fe 56等内容,欢迎下载使用。
这是一份高考化学二轮复习提升模拟卷8含答案,共14页。试卷主要包含了8],0 ml/L计算),2×10-6等内容,欢迎下载使用。









