



所属成套资源:高考化学三轮【临门一脚】 冲刺过关
预测04 化学计量专题-【临门一脚】 高考化学三轮冲刺过关
展开
这是一份预测04 化学计量专题-【临门一脚】 高考化学三轮冲刺过关,文件包含预测04化学计量专题解析版docx、预测04化学计量专题原卷版docx等2份试卷配套教学资源,其中试卷共34页, 欢迎下载使用。
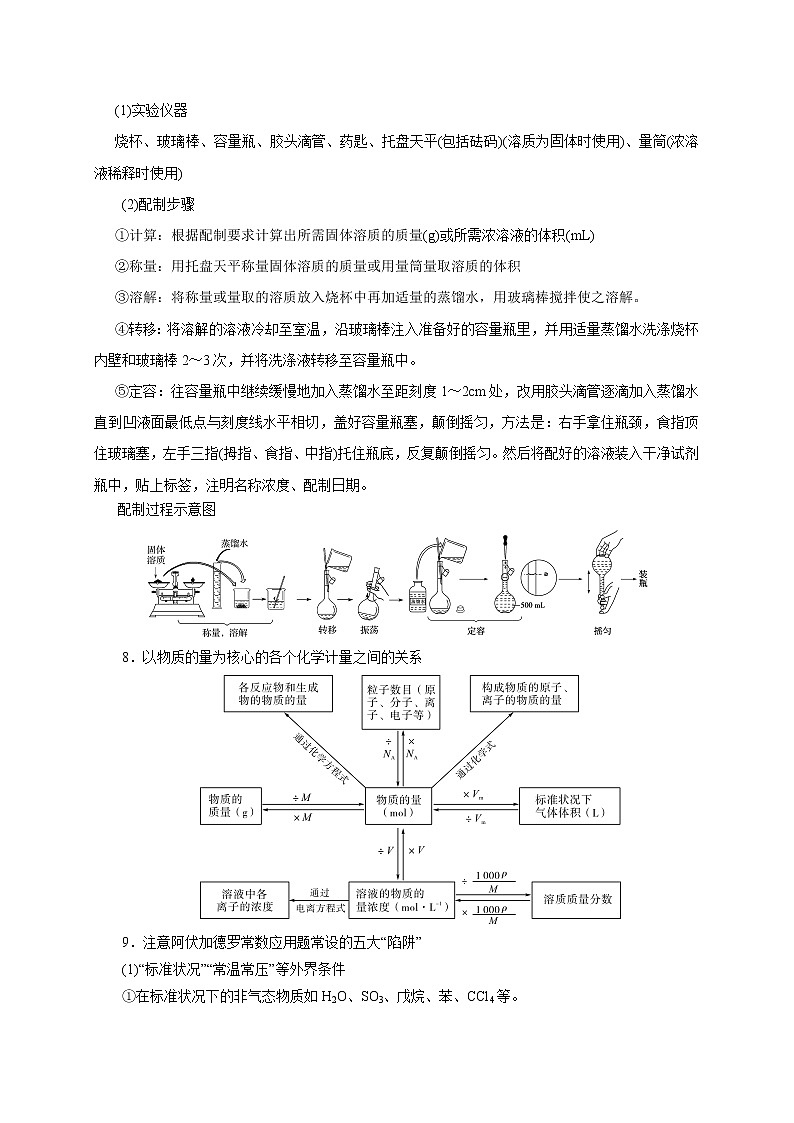
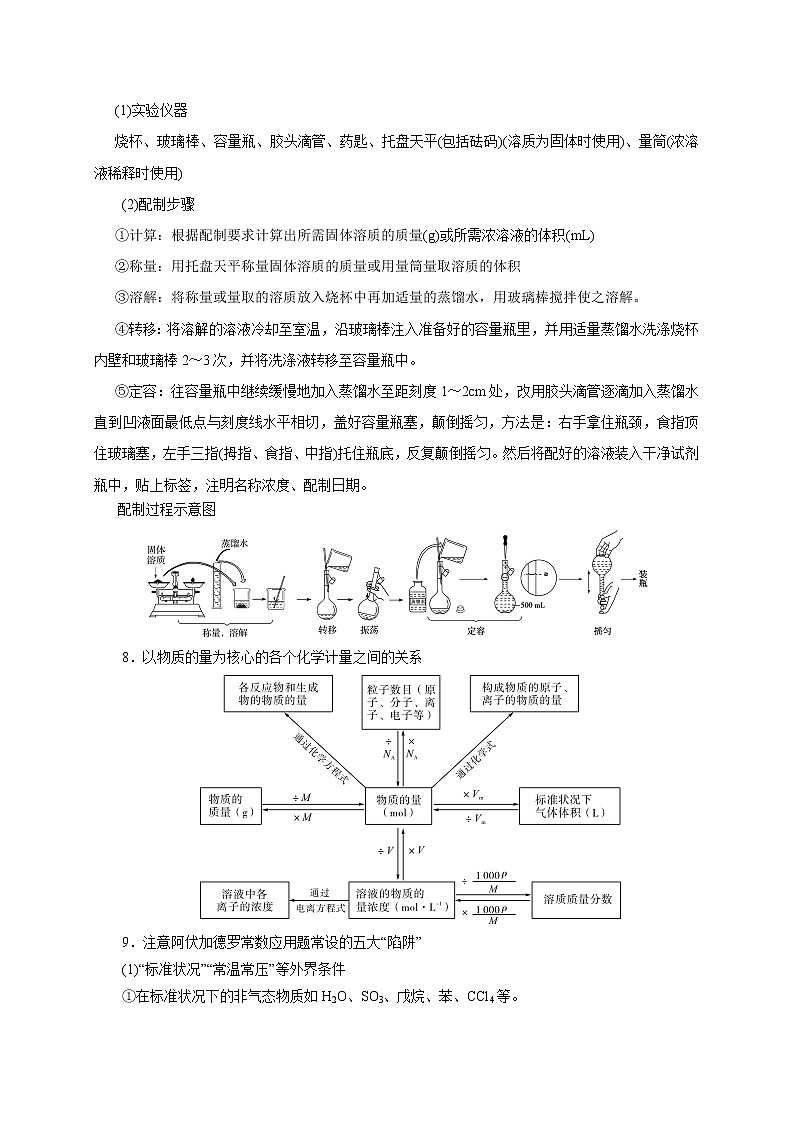
预测04 化学计量专题概率预测☆☆☆☆☆题型预测选择题☆☆☆☆简答题☆☆☆☆☆考向预测①考查物质的量的单位——摩尔(mol)、摩尔质量、气体摩尔体积、物质的量浓度、阿伏加德罗常数的含义及相互换算②考查阿伏加德罗常数(NA)③考查配制一定物质的量浓度溶液的方法①有关物质的量在化学方程式中的计算②氧化还原、化学平衡等计算③有关产品产率、纯度的计算化学计算要特别注意对“物质的量”的理解,利用物质的量建立宏观与微观的链接,还要构建以“物质的量”为中心的知识网络体系。有关阿伏加德罗常数的问题是比较重要的题型,涉及的概念很多,是近几年高考常出不衰的热点题型。该类试题多是通过阿伏加德罗常数将化学基本概念、基本原理、物质结构、元素化合物知识与化学计量联系起来,从物质状态、物质组成、化学键原子结构、气体摩尔体积、弱电解质的电离、盐类水解以及氧化还原反应中电子的转移等角度设计问题,形式灵活,涉及范围广,综合性强。阿伏加德罗定律及推论也常常在化学平衡计算中得到应用。高考大题的最后一步必有计算,计算都是要利用各种关系找到题中所给数据的物质与所求物质之间的关系,才能进行计算。1.物质的量(1)含义:物质的量是一个物理量,表示含有一定数目粒子的集合体,符号为n,单位为mol。(2)数值:1 mol任何物质所含有的微粒数与0.012_kg 12C所含的碳原子个数相等。2.阿伏加德罗常数(1)概念:1 mol任何粒子所含的微粒数,符号为NA,通常用6.02×1023_mol-1表示。(2)物质的量、微粒数(N)与阿伏加德罗常数的关系为:n=N/NA。3.摩尔质量(1)概念:单位物质的量的物质所具有的质量,符号:M,单位:g/mol。(2)数值:当微粒的摩尔质量以g/mol为单位时,在数值上等于该微粒的相对分子(原子)质量。(3)关系:物质的量、物质的质量与摩尔质量关系为:n=m/M。4.气体摩尔体积(1)概念:气体摩尔体积是指在一定温度和压强下,单位物质的量的气体所占有的体积,符号为Vm,单位为L·mol-1。(2)特例:标准状况是指温度为0_℃,压强为101_kPa,此情况下,气体摩尔体积为22.4_L·mol-1。(3)物质的量、气体体积与气体摩尔体积之间的关系为n=。5.阿伏加德罗定律(1)决定气体体积的外界条件:物质的量相同的气体,其体积的大小取决于气体所处的温度和压强。(2)阿伏加德罗定律的含义:在相同的温度和压强下,相同体积的任何气体含有相同的分子数。即T1=T2,p1=p2,V1=V2,则n1=n2。6.物质的量浓度(1)概念:表示单位体积溶液里所含溶质B的物质的量的物理量,符号为cB。(2)表达式:cB=;(3)单位:mol·L-1或mol/L。 (4)溶液中的计算①物质的量浓度与溶质质量分数之间的换算c====,w= 。(ρ:g·cm-3)②物质的量浓度与溶解度(S)的换算(饱和溶液)c===,S=。(ρ:g·cm-3)③气体溶质溶于水中制得溶液,其物质的量浓度和质量分数的计算在标准状况下,1 L水中溶解某气体V L,所得溶液密度为ρ,则:c===(ρ:g·cm-3);w=×100%==×100%。7.配制一定物质的量浓度的溶液(1)实验仪器烧杯、玻璃棒、容量瓶、胶头滴管、药匙、托盘天平(包括砝码)(溶质为固体时使用)、量筒(浓溶液稀释时使用)(2)配制步骤 ①计算:根据配制要求计算出所需固体溶质的质量(g)或所需浓溶液的体积(mL) ②称量:用托盘天平称量固体溶质的质量或用量筒量取溶质的体积 ③溶解:将称量或量取的溶质放入烧杯中再加适量的蒸馏水,用玻璃棒搅拌使之溶解。 ④转移:将溶解的溶液冷却至室温,沿玻璃棒注入准备好的容量瓶里,并用适量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将洗涤液转移至容量瓶中。⑤定容:往容量瓶中继续缓慢地加入蒸馏水至距刻度1~2cm处,改用胶头滴管逐滴加入蒸馏水直到凹液面最低点与刻度线水平相切,盖好容量瓶塞,颠倒摇匀,方法是:右手拿住瓶颈,食指顶住玻璃塞,左手三指(拇指、食指、中指)托住瓶底,反复颠倒摇匀。然后将配好的溶液装入干净试剂瓶中,贴上标签,注明名称浓度、配制日期。配制过程示意图8.以物质的量为核心的各个化学计量之间的关系9.注意阿伏加德罗常数应用题常设的五大“陷阱”(1)“标准状况”“常温常压”等外界条件①在标准状况下的非气态物质如H2O、SO3、戊烷、苯、CCl4等。②物质的质量、摩尔质量、粒子个数不受外界条件的影响。(2)物质的组成①特殊物质中所含粒子(分子、原子、电子、质子、中子等)的数目,如Ne、D2O、18O2、H37Cl。②物质中所含化学键的数目,如CO2、CnH2n+2等。③最简式相同的物质中的微粒数目,如NO2和N2O4、乙烯和丙烯、O2和O3等。④摩尔质量相同的物质中的粒子数目,如N2、CO、C2H4等。(3)氧化还原反应中电子转移(得失)的数目如Na2O2、NO2与H2O的反应;电解AgNO3溶液、CuSO4溶液的反应;Cl2与H2O、NaOH、Fe的反应等,分析该类题目时还要注意反应产物以及过量计算的问题。(4)弱电解质的电离、盐类的水解弱电解质在水溶液中部分电离,可水解的盐溶液中,离子发生微弱水解。如0.1 mol·L-1的乙酸溶液和0.1 mol·L-1的乙酸钠溶液中c(CH3COO-)不相等。(5)一些特殊的反应如一氧化氮和氧气不需要条件即可反应,二氧化氮和四氧化二氮之间存在相互转化,合成氨反应属于可逆反应等。解答有关阿伏加德罗常数类题目的“三”个步骤顺利解题的关键是细心审题:①不要忙于计算,首先应注意概念的适用条件,物质所在的状态等;②看准所求微粒名称,原子、分子、质子、中子、电子等;③注意可逆反应与各种平衡的存在;④时刻牢记特殊,特殊结构、特殊反应等。1.(2020•新课标Ⅲ卷)NA是阿伏加德罗常数的值。下列说法正确的是( )A.22.4 L(标准状况)氮气中含有7NA个中子B.1 mol重水比1 mol水多NA个质子C.12 g石墨烯和12 g金刚石均含有NA个碳原子D.1 L 1 mol·L−1 NaCl溶液含有28NA个电子2.(2020•浙江1月选考)设[aX+bY]为a个X微粒和b个Y微粒组成的一个微粒集合体,NA为阿伏加德罗常数的值。下列说法不正确的是( )A.H2(g)+O2(g)=H2O(l) ΔH=-286 kJ·mol−1,则每1 mol [H2(g)+O2(g)]生成1 mol [H2O(l)]放热286 kJB.Cr2O72-+ne−+14H+=2Cr3++7H2O,则每生成1 mol Cr3+转移电子数为3NAC.Al3++4OH−=[Al(OH)4]−,说明1 mol Al(OH)3电离出H+数为NAD.1 mol CO2与NaOH溶液完全反应,则n(CO32-)+n(HCO3-)+n(H2CO3)=1 mol3.(2020•浙江7月选考)NA为阿伏加德罗常数的值。下列说法正确的是( )A.4MnO4-+5HCHO+12H+=4Mn2++5CO2↑+11H2O,1mol[4MnO4-+5HCHO]完全反应转移的电子数为20NA B.用电解粗铜的方法精炼铜,当电路中通过的电子数为NA时,阳极应有32 g Cu转化为Cu2+C.常温下,pH=9的CH3COONa溶液中,水电离出的H+数为10−5NAD.1 L浓度为0.100 mol·L−1的Na2CO3溶液中,阴离子数为0.100NA4.(2021•浙江1月选考)设NA为阿伏加德罗常数的值,下列说法正确的是( )A.1 mol NH4F晶体中含有的共价键数目为3NAB.CH4和C2H4混合气体2.24L(标准状况)完全燃烧,则消耗O2分子数目为0.25NAC.向100mL 0.10mol·L-1FeCl3溶液中加入足量Cu粉充分反应,转移电子数目为0.01NAD.0.1 mol CH3COOH与足量CH3CH2OH充分反应生成的CH3COOCH2CH3分子数目为0.1NA1.(2021·湖北省七市教科研协作体高三联考)NA表示阿伏加德罗常数的值,下列说法中正确的是( )A.标准状况下,2.24 LBr2单质中含Br原子数目为0.2NAB.常温常压下,2.8g乙烯分子中含σ键数目为0.5NAC.0.1 mol·L-1盐酸中含Cl-数目为0.1 NAD.1 mol Cu与足量S完全反应生成Cu2S时转移电子数目为2NA2.(2021·福建厦门市·高三一模)Al遇到极稀的硝酸发生反应生成NH4NO3,其反应为8Al+30HNO3=3NH4NO3+8 Al(NO3)3+9H2O。设NA为阿伏加德罗常数的值。下列说法正确的是( )A.将0.2mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+的数目小于0.2NAB.1L0.1mol/L Al(NO3)3溶液中,阳离子的数目为0.1NAC.1.0g由H218O与D2O组成的混合物中所含有的中子总数为0.5NAD.反应中每消耗2.7g金属Al,转移的电子数为3NA3.(2021·东北三省四市教研联合体高三模拟考试)NA是阿伏伽德罗常数的值。下列说法正确的是( )A.标准状况下,22. 4L苯中含有6NA个碳氢键B.3.2g O2和O3混合气体中含有电子数1.6INAC.1L 1mol/L NaClO溶液中的阴离子数为NAD.一定条件下密闭容器中,1molH2和1molI2充分反应,转移电子数为2NA4.(2021·辽宁省高三新高考普通高中教育教学质量监测)NA是阿伏加德罗常数的值。下列说法正确的是( )A.将0.1 mol乙酸和足量的乙醇混合加热,反应生成的酯分子数为0.1NAB.用铜做阳极电解饱和食盐水,理论上溶液质量减少36.5 g时,电路中通过的电子数为0.1NAC.标准状况下,11.2 L乙烷和丙烯混合物中含氢原子数目为3NAD.27 g铝与足量的稀硝酸反应产生氢气分子数为1.5NA5.(2021·山东临沂市·高三一模)NA为阿伏加德罗常数的值。下列说法正确的是( )A.12 g NaHSO4晶体中阴离子所带电荷数为 0.2NAB.标准状况下,2.24 L CH3Cl中含有共价键的数目为0.4NAC.1L pH=13 的 Ba(OH)2溶液中 Ba2+数目为 0.1NAD.0.1mol FeI2与 0.1 mol Cl2 反应时转移电子的数目为0.3NA6.(2021·广西桂林、崇左市高三联合调研考试)设NA为阿伏加德罗常数的值。下列说法正确的是( )A.0.1 mol•L-1NH4NO3溶液中含有的氮原子总数为0.2NAB.12g石墨和金刚石的混合物含有4NA个碳原子C.1molCl2与足量铁充分反应,转移的电子数为2NAD.2.8gCO 和C2H4的混合气体中含有的质子数为1.4NA7.(2021·河北省“五个一名校”高三第二次模拟)NA是阿伏加德罗常数的值。下列说法错误的是( )A.1molH2O和足量Na2O2充分反应后,转移电子总数为2 NAB.标准状况下,39g苯中含有的数目为3 NAC.12g由3H和18O组成的水中,中子数和电子数之和为12 NAD.13g乙炔中含有的键的数目为NA8.(2021·广东汕头市·高三一模)我国“金牌火箭”长征二号用 N2H4做燃料,发生反应:2N2H4+ 2NO2 3N2+4H2O。设 NA 为阿伏伽德罗常数的值,下列有关说法正确的是( )A.标准状况下,22.4L H2O 中质子数目为 10 NAB.16g N2H4中含有极性共价键数目为 2.5 NAC.反应生成 1.5molN2时转移的电子数目为 4 NAD.密闭容器中 2molNO 和 1molO2充分反应生成 NO2,其分子数目为 2 NA9.(2021·福建省龙岩市高三毕业班第一次教学质量检测)设NA为阿伏加德罗常数的值,下列说法正确的是( )A.17g由16O和18O构成的氧气中所含质子数一定为8NA B.标况下,11.2LCH4和O2的混合气体中所含的分子数为0.5 NA C.用足量水吸收1mol Cl2,所得溶液中Cl2、HCl、HClO、Cl-四种微粒数目之和为2 NA D.常温下,1L 0.5mol·Lˉ1NHCl溶液与1L 0.25mol·Lˉ1NHCl溶液所含NH4+的物质的量相等10.(2021·重庆市强基联合体高三质量检测)设NA代表阿伏加德罗常量的值。下列说法正确的是( )A.100 g 20%NaOH溶液中含有的氧原子数为0.5NAB.标准状况下,11.2 L乙烷和乙烯混合物中含有的碳原子数为NAC.2 mol SO2与1 mol O2在密闭容器中充分反应后,容器中的分子总数为2NAD.用铜作电极电解饱和NaCl溶液,当电路上通过0.2 mol e-时,阴、阳两极产生的气体分子总数为0.2NA11.(2021·广东揭阳市高三教学质量测试)设为阿伏加德罗常数的数值。下列说法正确的是( )A.1molH2O2中含有共价键的数目为3NAB.23gNa燃烧生成Na2O2失去的电子数为2NAC.1L0.1 mol·Lˉ1Na2SO3溶液中含有0.3NA个氧原子D.标准状况下,22.4LHCl溶于水后溶液中含有NA个HCl分子12.(2021·青海西宁市普通高中五校高三联考)设NA为阿伏加德罗常数的值。下列说法正确的是( )A.标准状况下,2.24 L Cl2与CH4反应完全,生成物中气体分子数目是0.2NAB.34g质量分数为4%的H2O2水溶液中含氧原子数目为0.08 NAC.0.5 mol乙烯被溴的四氯化碳溶液完全吸收,断裂的共价键总数为NAD.0.1 mol SO2溶于足量水所得溶液中H2SO3、HSO3-、SO32-三种微粒的个数之和为0.1 NA13.(2021·四川高三二模)设NA为阿伏加德罗常数的值。下列叙述正确的是( )A.1L0.1 mo/L NH4NO3溶液中氮原子数目为0.2NAB.5.6gFe与水蒸气完全反应转移的电子数目为0.3NAC.等质量的N2和CO所含原子数目均为2NAD.标准状况下,5.6LCHCl3所含C—Cl键数目为0.75NA14.(2021·湖北部分重点中学联考新高考质量检测)下列各项关系的比较一定不相等的是( )A.等质量的Zn分别与足量稀硫酸和稀盐酸反应,生成H2的分子数B.相同质量的Fe分别与足量Cl2、S充分反应,转移的电子数C.室温下,用氨水调节NH4Cl溶液的pH至7,溶液中c (NH4+)和c (Cl-)D.等物质的量的C2H4和CH3COOH中所含氢原子数目15.(2021·四川泸州市高三第一次教学质量诊断性考试)设NA为阿伏加德罗常数的值,下列说法中正确的是( )A.1molCH3+正离子所含的电子总数为8 NAB.32g16O2与18O3混合气体中所含原子总数为2 NAC.常温常压下,22.4LNO2和CO2混合气体中含有2 NA个氧原子D.电解NaCl溶液共得到气体(标准状况),理论上转移了2 NA个电子16.(2021·浙江省之江教育评价高三联考)NA为阿伏加德罗常数的值。下列说法正确的是( )A.1 molNa被完全氧化为Na2O2时,失去NA个电子B.常温下,pH=10的碳酸钠溶液中,OH-的数目为10-4NAC.用电解粗铜的方法精炼铜,当电路中通过的电子数为NA时,阳极应有32 g Cu转化为Cu2+D.60 g二氧化硅固体中含有NA个二氧化硅分子17.(2021·浙江省七彩阳光新高考研究联盟高三联考)设NA为阿伏加德罗常数值,下列有关叙述正确的是( )A.0.1 mol·L-1 FeCl3溶液制成胶体,含有Fe(OH)3胶粒数一定小于0.1 NAB.含1 molCl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+数为NAC.12g石墨烯(单层石墨)中含有六元环的个数为0. 4NAD.标准状况下,盛有11. 2L SO3的密闭容器中硫原子数为0. 5NA18.(2021·广东梅州市·高三一模)设 NA为阿伏加德罗常数的值。下列说法正确的是( )A.18g D2O 含有 10NA个质子B.78g Na2O2中存在NA个共价键C.1mol Cu 和足量热浓硫酸反应可生成 NA个 SO3分子D.0.1mol FeCl3溶于 1L水中,所得溶液中含有0.1 NA个 Fe3+19.(2021·广东珠海市·高三一模)设 NA为阿伏伽德罗常数的值,下列有关叙述正确的是( )A.常温下,78g Na2O2中含有离子数为 4NAB.0.5mol/L 的 AlCl3溶液中所含 Al3+的数目小于 0.5NAC.1mol Cl2与过量 H2O 反应,转移的电子数目为NAD.标准状况下,11.2L N2和 NO 混合气体中的原子数为NA20.(2021·浙江省名校协作体高三联考)设NA为阿伏加德罗常数的值。下列叙述正确的是( )A.标准状况下,2.24L的乙烯和2.24L的己烯,碳氢键都为0.2mNA,m为烯烃碳原子数B.25℃,pH=12的NaOH溶液中含有OH-的数目约为0.01NAC.CH3CH2OH+3O2+4OH- = 2CO32-+5H2O,每消耗1molCH3CH2OH,有12NA电子发生转移D.2Na2O2+2H2O=4NaOH+O2↑,该反应转移电子数为2NA时,生成0.5mol O221.(2021·湖南永州市·高三二模)设NA表示阿伏加德罗常数的值。下列叙述正确的是( )A.pH=1的H2SO4溶液,含H+的数目为NAB.78 g苯含有碳碳双键的数目为3NAC.11.2L(标准状况)正戊烷含有的分子数目为0.5NAD.1 mol CH3COONa溶于稀醋酸,溶液呈中性时含CH3COO-数目为NA22.(2021·河南新乡市·高三其他模拟)NA表示阿伏加德罗常数的值,下列叙述正确的是( )A.1mol甲基中所含有的电子数为7NAB.标准状况下,2.24L己烷所含有的碳原子数为0.6NAC.0.2molKMnO4被还原时,转移的电子数一定为NAD.常温下,1LpH=5的NH4Cl溶液中由水电离出的氢离子数为10-5NA23.(2021·福建漳州市·高三一模)设 NA为阿伏加德罗常数的值。下列说法正确的是( )A.标准状况下,22.4 LCH2Cl2 中含有的共用电子对数目为 4NAB.常温下将 5.6 g 的铁块投入到足量的浓硫酸中,转移的电子数为0.3NAC.含 28 g 硅的二氧化硅晶体中存在的共价键总数为 2NAD.AlCl3溶液中 Al3+的物质的量浓度为1mol·L-1,则1L溶液中所含 Cl-的数目大于3NA24.(2021·广东省高三“六校联盟”第三次联考)反应 CaC2+ 2H2O→Ca(OH)2+C2H2 ↑ 可用于实验室制备乙炔气体。设 NA 为阿伏加德罗常数的值,下列说法正确的是( )A.0.1 mol CaC2 含有的离子数为0.3 NAB.1.8 gH218O中所含电子数目为NAC.0.1 mol C2H2完全燃烧转移的电子数为NAD.常温下pH = 12的Ca(OH)2溶液中,由水电离出的氢离子的数目为10-12NA25.(2021·安徽安庆市·高三一模)设NA为阿伏加德罗常数的值,下列说法正确的是( )A.25℃,pH=13的1.0LBa(OH)2溶液中含有OH-的数目为0.2NAB.60gSiO2晶体中Si—O键数目为2NAC.在K37ClO3+6H35Cl(浓)=KCl+3Cl2↑+3H2O反应中,若有212g氯气生成,则反应中转移电子的数目为5NAD.加热条件下,20mL10mol•L-1浓硝酸与足量铜反应转移电子数为0.1NA26.(2021·江西上饶市·高三一模)设NA为阿伏伽德罗常数的值,下列有关叙述正确的是( )A.2H2S+SO2=3S↓+2H2O反应中,每生成1mol氧化产物时转移电子数为NAB.物质的量相等的重水与水相差2NA个中子C.乙烯和丙烯组成的28g 混合气体中含氢原子数为4NAD.pH=13的1LBa(OH)2 溶液中所含有OH-数目为0.2NA27.(2021·甘肃白银市·高三期末)已知K2Cr2O7+4H2SO4+3H2C2O4=Cr2(SO4)3+6CO2↑+7H2O+K2SO4,设NA为阿伏加德罗常数的值。下列说法正确的是( )A.常温下,1LpH=1的H2SO4溶液中含有的H+数目为0.2NAB.0.1mol·L-1的K2SO4溶液中所含的离子总数为0.3NAC.1mol羟基(—OH)和1molOH-中所含的质子数和电子数均为9NAD.若该反应生成标准状况下气体2.24L,则反应中转移的电子数为0.1NA28.(2021·安徽六安市示范高中高三教学质量检测)设NA表示阿伏加德罗常数的值,下列说法正确的是( )A.将78g锌粉加入1Llmol·L-1FeCl3溶液中,置换出的铁原子数为0.8NAB.含0.2mol共价键的水蒸气分子间存在0.2NA个氢键C.查德威克发现中了:,当产生0.5mol时,产物X中含6NA中子D.500mL0.5mol·L-1NaCl溶液中微粒数大于0.5NA29.(2021·广东省华附、省实、广雅、深中高三四校联考)设NA为阿伏加德罗常数的值,下列说法正确的是( )A.常温下,pH=2的亚硫酸溶液中含有的H+数目为0.01NAB.标准状况下,2.24LCHCl3含有的共价键数为0.4NAC.1molN2与4molH2反应生成的NH3分子数为2NAD.14g乙烯和环丙烷混合气体中的氢原子数为2NA30.(2021·衡水中学高三质检)下列有关溶质的质量分数和物质的量浓度的计算结果错误的是( )A.有K2SO4和Al2(SO4)3的混合溶液,已如其中Al3+的物质的量浓度为0.4mol/L, SO的物质的量浓度为0.7mol/L,则此溶液中K+的物质的量浓度为0.2mol/LB.将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO 的物质的量浓变为mol/LC.将标准状况下,将VLA气体(摩尔质量为Mg/mol)溶于0.1L水中,所得溶液密度为ρg/cm3,则此溶液的物质的量浓度为.mol/LD.密度为0.91g/cm3的氨水,质量分数为25%。该氨水用等体积的水稀释后,所得溶液中溶质的质量分数等于12.5%31.(2021·浙江高三选考模拟)下列有关浓度的说法正确的是( )A.10℃时,100 mL 0.35 mol/L的KCl饱和溶液蒸发掉5 g水,冷却到10℃时,其体积小于100 mL,它的物质的量浓度大于0. 35 mol/LB.将标准状况下22. 4L HCl溶于1 L水中可得1 mol/L盐酸C.将78 gNa2O2溶于水,配成1 L溶液可得到浓度为1mol/L的溶液D.将25.0 g胆矾(CuSO4·5H2O)溶于水后配成100 mL溶液,所得溶液浓度为1 mol/L32.(2021·黑龙江大庆市大庆实验中学质检)截止到2021年1月18日全球新冠肺炎确诊人数超过9600万,在阻击新冠肺炎的战役中最大程度的体现了我国的政体优势。其中医用酒精(75%的乙醇)和“84” 消毒液(主要成分为次氯酸钠)、双氧水等均能起到杀菌作用。设NA为阿伏伽德罗常数的值,下列说法不正确的是( )A.74.5g 次氯酸钠中含有的离子总数为2NAB.46 g 75%的乙醇中含有的碳原子数为0.75NAC.34g H2O2中含有的共用电子对数为3NAD.1 mol乙醇完全燃烧,消耗氧气分子数为3NA33.(2021·贵州省新高考联盟高三教学质量监测)臭氧存在于大气层中,但在地表附近也会产生臭氧,其发生机理如图所示。NA表示阿伏伽德岁常数的值。以下表述正确的是( )A.标准状况下,1molNO与1mol氧气混合后体积为33.6LB.图中所示的化学变化均为氧化还原反应C.32gO3和O2的混合气体,所含电子数为16NAD.将1molNO2通入水中形成1L溶液,可得到1mol/L的硝酸溶液34.(2021·安徽宣城市质检)若将mgNaOH固体溶于水恰好配成200mL饱和溶液,其密度为ρ g·cm-3,则下列说法正确的是( )A.溶质的质量分数为B.溶质的物质的量浓度为 mol·L-1C.溶质和溶剂的物质的量之比为:D.从该溶液中取出50 mL,含NaOH的物质的量为mol
相关试卷
这是一份预测17 工业流程分析专题-【临门一脚】 高考化学三轮冲刺过关,文件包含预测17工业流程分析专题解析版docx、预测17工业流程分析专题原卷版docx等2份试卷配套教学资源,其中试卷共45页, 欢迎下载使用。
这是一份预测16 化学反应原理综合专题-【临门一脚】 高考化学三轮冲刺过关,文件包含预测16化学反应原理综合专题解析版docx、预测16化学反应原理综合专题原卷版docx等2份试卷配套教学资源,其中试卷共81页, 欢迎下载使用。
这是一份预测12 电化学基础专题-【临门一脚】 高考化学三轮冲刺过关,文件包含预测12电化学基础专题解析版docx、预测12电化学基础专题原卷版docx等2份试卷配套教学资源,其中试卷共76页, 欢迎下载使用。









