

高考化学二轮复习训练题: 高考压轴大题特训 题型04《“选择仪器型”定性、定量实验探究》(含答案)
展开题型四 “选择仪器型”定性、定量实验探究
1.(湖北省武昌区高三5月调研)青蒿素是一种有效的抗疟药。常温下,青蒿素为无色针状晶体,难溶于水,易溶于有机溶剂,熔点为156~157 ℃。提取青蒿素的方法之一是乙醚浸取法,提取流程如下:
请回答下列问题:
(1)对青蒿进行破碎的目的是_________________________________。
(2)操作Ⅰ用到的玻璃仪器是__________________________________________,
操作Ⅱ的名称是________。
(3)用下列实验装置测定青蒿素的化学式,将28.2 g青蒿素放在燃烧管C中充分燃烧:
①仪器各接口的连接顺序从左到右依次为__________(每个装置限用一次)。A装置中发生反应的化学方程式为___________________________________________。
②装置C中CuO的作用是________________________________________________
________________________________________________________________________。
③装置D中的试剂为________。
④已知青蒿素是烃的含氧衍生物,用合理连接后的装置进行实验。测量数据如下表:
装置质量 | 实验前/g | 实验后/g |
B | 22.6 | 42.4 |
E(不含干燥管) | 80.2 | 146.2 |
则青蒿素的最简式为____________。
(4)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH 、酚酞的水溶液中,青蒿素的溶解度较小,加热并搅拌,青蒿素的溶解度增大,且溶液红色变浅,与青蒿素化学性质相似的物质是________(填字母)。
A.乙醇 B.乙酸
C.乙酸乙酯 D.葡萄糖
答案 (1)增大青蒿与乙醚的接触面积,提高青蒿素的浸取率 (2)漏斗、玻璃棒、烧杯 蒸馏 (3)①afgdebchi 2H2O2 2H2O+O2↑ ②使青蒿素充分氧化生成CO2和H2O ③浓硫酸 ④C15H22O5 (4)C
解析 本题主要考查物质的分离方法。
(1)对青蒿进行破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素的浸取率。
(2)操作Ⅰ是过滤,用到的玻璃仪器是漏斗、玻璃棒、烧杯,操作Ⅱ将提取液中的乙醚分离出来,其名称是蒸馏。
(3)① 装置A产生的氧气需要经过装置D干燥,纯净的氧气进入装置C,产生的水蒸气被装置B吸收,二氧化碳被装置E吸收,仪器各接口的连接顺序从左到右依次为afgdebchi。A装置中发生反应的化学方程式为2H2O22H2O+O2↑。
② 装置C中CuO的作用是使青蒿素充分氧化生成CO2和H2O。
③ 装置D中的试剂为干燥剂浓硫酸。
④B吸收水19.8 g,其中含氢2.2 mol即2.2 g,E吸收二氧化碳66 g,其中含碳1.5 mol即18 g,28.2 g青蒿素含氧8 g即0.5 mol,则青蒿素的最简式为C15H22O5。
(4)在含有NaOH 、酚酞的水溶液中,乙酸乙酯水解,生成物乙酸与氢氧化钠反应使溶液红色变浅,所以与青蒿素化学性质相似的物质是乙酸乙酯,故选C。
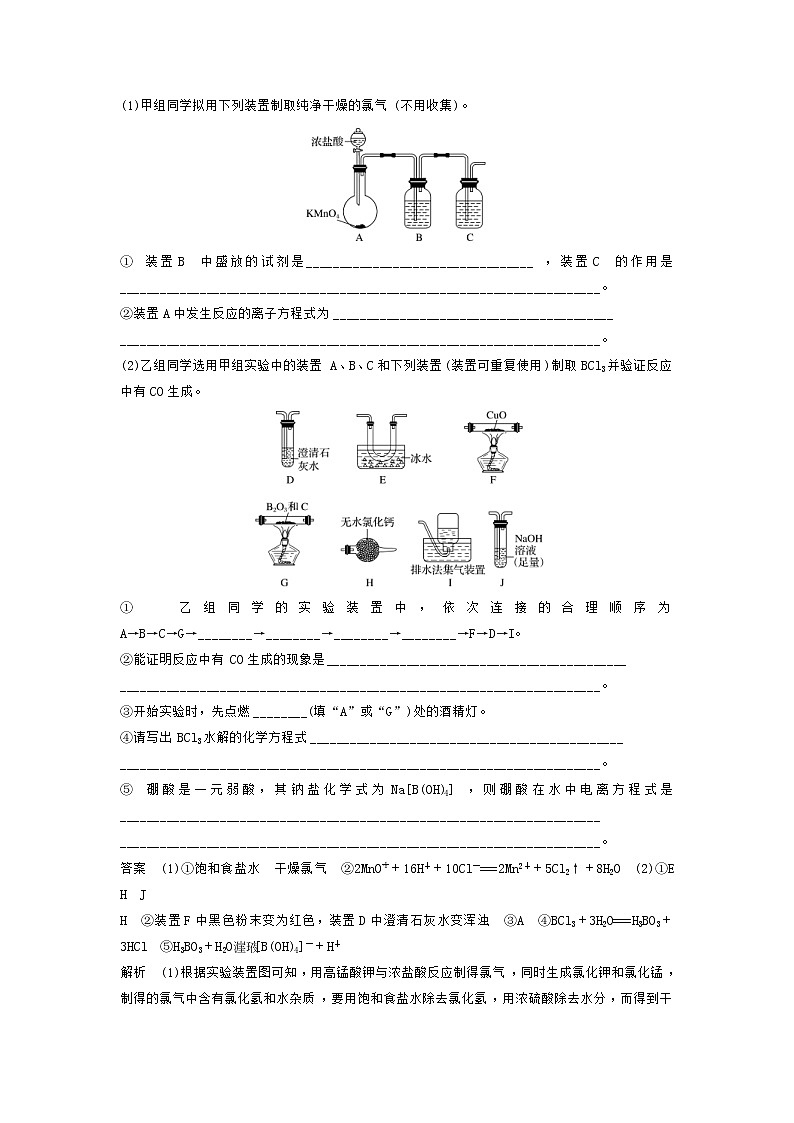
2.(河北省衡水中学高三最后一卷)三氯化硼的熔点为-107.3 ℃,沸点为12.5 ℃,易水解生成硼酸(H3BO3),可用于制造高纯硼、有机合成催化剂等。实验室制取三氯化硼的原理为B2O3+3C+3Cl22BCl3+3CO。
(1)甲组同学拟用下列装置制取纯净干燥的氯气(不用收集)。
①装置B中盛放的试剂是__________________________________,装置C的作用是________________________________________________________________________。
②装置A中发生反应的离子方程式为__________________________________________
________________________________________________________________________。
(2)乙组同学选用甲组实验中的装置A、B、C和下列装置(装置可重复使用)制取BCl3并验证反应中有CO生成。
①乙组同学的实验装置中,依次连接的合理顺序为A→B→C→G→________→________→________→________→F→D→I。
②能证明反应中有CO生成的现象是_____________________________________________
________________________________________________________________________。
③开始实验时,先点燃________(填“A”或“G”)处的酒精灯。
④请写出BCl3水解的化学方程式_______________________________________________
________________________________________________________________________。
⑤硼酸是一元弱酸,其钠盐化学式为Na[B(OH)4],则硼酸在水中电离方程式是________________________________________________________________________
________________________________________________________________________。
答案 (1)①饱和食盐水 干燥氯气 ②2MnO+16H++10Cl-===2Mn2++5Cl2↑+8H2O (2)①E H J
H ②装置F中黑色粉末变为红色,装置D中澄清石灰水变浑浊 ③A ④BCl3+3H2O===H3BO3+3HCl ⑤H3BO3+H2O[B(OH)4]-+H+
解析 (1)根据实验装置图可知,用高锰酸钾与浓盐酸反应制得氯气,同时生成氯化钾和氯化锰,制得的氯气中含有氯化氢和水杂质,要用饱和食盐水除去氯化氢,用浓硫酸除去水分,而得到干燥纯净的氯气。
①根据上面的分析可知,装置B中盛放的试剂是饱和食盐水,装置C中装有浓硫酸,其作用是干燥氯气;
②装置A中高锰酸钾与浓盐酸反应制得氯气,同时生成氯化钾和氯化锰,发生反应的离子方程式为 2MnO+16H++10Cl-===2Mn2++5Cl2↑+8H2O。
(2)乙组同学选用甲组实验中的装置A、B、C制得干燥的氯气,用氯气与B2O3、C反应生成三氯化硼和CO,三氯化硼的熔点为-107.3 ℃,沸点为12.5 ℃,所以收集三氯化硼要用冰水冷却,未反应的氯气尾气用氢氧化钠吸收,三氯化硼易水解,为防止氢氧化钠溶液中的水进入装置E,在E和J之间接上H装置,用于吸水,生成的CO经干燥后再通过F装置还原氧化铜,再将生成的气体通过澄清石灰水检验,可以证明原反应中有一氧化碳生成,多余的CO不能排放到空气中,要用排水法收集。
①根据上面的分析可知,乙组同学的实验装置中,依次连接的合理顺序为A→B→C→G→E→H→J→H→F→D→I;
②根据实验的原理可知,生成的CO能将黑色的氧化铜还原为红色的铜,同时产生能使澄清石灰水变浑浊的气体,所以能证明反应中有CO生成的现象是装置F中黑色粉末变为红色,装置D中澄清石灰水变浑浊;
③加热CuO前需要利用CO除去装置内空气,则开始实验时,先点燃A处的酒精灯;
④BCl3水解生成硼酸和氯化氢的化学方程式为BCl3+3H2O===H3BO3+3HCl;
⑤根据硼酸是一元弱酸,且其钠盐化学式为Na[B(OH)4],可知硼酸在水中电离方程式是H3BO3+H2O[B(OH)4]-+H+。
3.(六安市第一中学高三6月适应性考试)某研究小组探究在加热条件下FeSO4分解的气体产物及相关性质。已知:SO2的沸点为-10 ℃、SO3的沸点为44.8 ℃。
Ⅰ.用如图所示装置设计实验,验证分解FeSO4生成的气态产物。
(1)实验前必须进行的操作是________________________________________________
________________________________________________________________________
________________________________________________________________________。
(2)按气流方向连接各仪器,用字母表示接口的连接顺序:a→___________________。
(3)若观察到装置丙中有无色液体产生,装置丁中溶液变成无色,则FeSO4分解的化学方程式为_______________________________________________________________________
________________________________________________________________________。
Ⅱ.为探究SO2使品红溶液褪色的原理,进行如下实验:
实验1:将稀盐酸和NaOH溶液分别滴入品红水溶液中。观察到前者溶液颜色变浅,但未能完全褪色,后者溶液颜色几乎不变。
实验2:在滴有稀盐酸和NaOH溶液的两份品红水溶液中分别通入SO2。观察到前者溶液逐渐褪色,后者溶液很快褪色。
实验3:在两份品红水溶液中分别加入一小粒Na2SO3固体和NaHSO3固体,前者溶液很快褪色,后者溶液褪色很慢。
(1)由实验1可推测品红水溶液呈________性。
(2)由实验2、3可推知,使品红水溶液褪色的主要微粒是____________________(填化学式)。
(3)若将SO2通入品红的无水乙醇溶液,试预测可能出现的现象____________________
________________________________________________________________________。
(4)加热溶有Na2SO3的品红水溶液,发现不能恢复红色,试解释原因_______________
________________________________________________________________________。
答案 Ⅰ.(1)检查装置气密性 (2)d→e→f→g→b→c (3)2FeSO4Fe2O3+SO2↑+SO3↑ Ⅱ.(1)碱 (2)SO (3)品红的无水乙醇溶液不褪色 (4)Na2SO3溶液中的c(SO)大,加热后水解程度增大,但仍无法除尽
解析 Ⅰ.(1)验证分解FeSO4生成的气态产物,气体制备或检验气体的产生实验,在实验前必须进行检查装置气密性的操作。(2)先将高温分解气体通过丙装置冷却收集得到三氧化硫,再通过丁的品红水溶液检验二氧化硫的存在,最后用乙装置吸收尾气,按气流方向连接顺序为a→d→e→f→g→b→c。(3)若观察到装置丙中有无色液体产生,则产物有三氧化硫;装置丁中溶液变成无色,则产物中有二氧化硫,则 FeSO4分解的化学方程式为2FeSO4Fe2O3+ SO2↑+ SO3↑。
Ⅱ.(1)加入稀盐酸时品红颜色变浅,而加入氢氧化钠溶液时溶液颜色几乎不变,说明酸对品红溶液影响大,则由实验1可推测品红水溶液呈碱性。
(2)实验2:SO2通入盐酸中不反应,以亚硫酸的形式存在溶液中,溶液中电离出的亚硫酸根离子和亚硫酸氢根离子浓度都很小,品红水溶液逐渐褪色;SO2通入氢氧化钠溶液中反应生成亚硫酸钠,溶液中亚硫酸根离子(或亚硫酸氢根离子)浓度较大,品红水溶液很快褪色。可推测品红水溶液褪色可能是由亚硫酸根离子或亚硫酸氢根离子引起;实验3:在两份品红水溶液中分别加入一小粒Na2SO3固体和NaHSO3固体,前者溶液很快褪色,后者溶液褪色很慢。进一步说明是由亚硫酸根离子引起的褪色而不是亚硫酸氢根离子。(3)根据上述实验可知,使品红水溶液褪色的是亚硫酸根离子,若将SO2通入品红的无水乙醇溶液中,溶液中不存在亚硫酸根离子,则品红的无水乙醇溶液不褪色。(4)加热溶有Na2SO3的品红水溶液,Na2SO3溶液中的c(SO)大,加热后水解程度增大,但仍无法除尽,不能使品红水溶液恢复红色。
4.(桂林市桂林中学高三5月全程模拟)氨气和氯气是重要的工业原料,某兴趣小组设计了相关实验探究它们的某些性质。
实验一:用氨气认识喷泉实验的原理,并测定电离平衡常数K(NH3·H2O)。
(1)检查图1的装置Ⅰ的气密性的方法是______________________________________
________________________________________________________________________
________________________________________________________________________。
(2)喷泉实验结束后,发现三颈烧瓶未充满水(假如装置的气密性良好),原因是________________________________________________________________________。
用________(填仪器名称)量取25.00 mL喷泉实验后的氨水至锥形瓶中,用0.050 0 mol·L-1盐酸滴定测定氨水的浓度,滴定曲线如图2所示。下列关于该滴定实验的说法中正确的是________(填字母)。
A.当pH=7.0时,氨水与盐酸恰好中和
B.选择酚酞作为指示剂,测定结果偏低
C.酸式滴定管未用盐酸润洗会导致测定结果偏低
D.当 pH=11.0 时,K(NH3·H2O)约为2.3×10-5
实验二:拟用如下装置设计实验来探究纯净、干燥的氯气与氨气的反应。
(3)A中所发生反应的化学方程式为_________________________________________
________________________________________________________________________。
(4)上图中的装置连接顺序为A→________→________→________→________→________ (用大写字母表示)。若按照正确顺序连接实验装置后,整套实验装置存在的主要缺点是________________________________________________________________________。
(5)写出F装置中的反应的一种工业用途______________________________________
________________________________________________________________________。
(6)反应完成后,F装罝中底部有固体物质生成。请利用该固体物质设计一个实验方案证明NH3·H2O为弱碱(其余实验用品自选)________ __________________________________
________________________________________________________________________。
答案 (1)关闭止水夹 K,打开分液漏斗的旋塞和盖子,从分液漏斗往烧瓶中加水,若分液漏斗中形成一段水柱且一段时间不变化,说明气密性良好 (2)氨气中混有空气 碱式滴定管(或 25 mL 移液管) BD (3)2NH4Cl+Ca(OH)2CaCl2+2H2O+2NH3↑ (4)D F C E B 无尾气处理装置 (5)用氨气检验氯气管道是否泄漏 (6)取 F 装置中的固体物质溶于水配成溶液,测定溶液的 pH,若 pH<7,可证明 NH3·H2O 为弱碱
解析 (1)检查图1的装置Ⅰ的气密性的方法是关闭止水夹 K,打开分液漏斗的旋塞和盖子,从分液漏斗往烧瓶中加水,若分液漏斗中形成一段水柱且一段时间不变化,说明气密性良好 。(2)喷泉实验结束后,发现三颈烧瓶未充满水(假如装置的气密性良好),原因是氨气中混有空气。用碱式滴定管(或 25 mL 移液管) 量取25.00 mL喷泉实验后的氨水至锥形瓶;关于该滴定实验的说法:NH4Cl溶液呈酸性,当pH=7.0时,氨水与盐酸没有完全中和,盐酸不足,故A错误; 选择酚酞作为指示剂,加入的盐酸不足,测定结果偏低,故B正确;酸式滴定管未用盐酸润洗会导致所加盐酸体积偏大,测定结果偏高,故C错误;由图可知,恰好完全反应时,盐酸的体积为22.5 mL,c(NH3·H2O)==0.045 mol·L-1,当 pH=11.0 时,HCl的体积为0,K(NH3·H2O)==≈2.3×10-5,故D正确;故选BD。(3)A制取氨气,反应的化学方程式为2NH4Cl+Ca(OH)2CaCl2+2H2O+2NH3↑。(4)A制NH3,D干燥NH3,F混合两气体,C干燥Cl2,E除去Cl2中HCl,B制取Cl2,装置连接顺序为A→D→F→C→E→B ;若按照正确顺序连接实验装置后,整套实验装置存在的主要缺点是无尾气处理装置。(5)F装置中的反应的一种工业用途:用氨气检验氯气管道是否泄漏。(6)反应完成后,F装置中底部有固体物质生成。利用该固体物质设计一个实验方案证明NH3·H2O为弱碱:取 F 装置中的固体物质溶于水配成溶液,测定溶液的 pH,若 pH<7,可证明 NH3·H2O 为弱碱。
高考化学二轮复习训练题: 高考压轴大题特训 题型07《有机化学基础》(含答案): 这是一份高考化学二轮复习训练题: 高考压轴大题特训 题型07《有机化学基础》(含答案),共12页。
高考化学二轮复习训练题: 高考压轴大题特训 题型05《“性质、原理型”定性、定量综合实验》(含答案): 这是一份高考化学二轮复习训练题: 高考压轴大题特训 题型05《“性质、原理型”定性、定量综合实验》(含答案),共7页。试卷主要包含了某学生探究如下实验等内容,欢迎下载使用。
高考化学二轮复习训练题: 高考压轴大题特训 题型03《“整套装置型”定性、定量实验探究》(含答案): 这是一份高考化学二轮复习训练题: 高考压轴大题特训 题型03《“整套装置型”定性、定量实验探究》(含答案),共6页。试卷主要包含了二价铬不稳定,极易被氧化等内容,欢迎下载使用。












