

高考化学二轮专题大题练习专题31《化学平衡常数及化学平衡相关计算》(含详解)
展开www.ks5u.com(满分60分 时间30分钟)
姓名:_______________ 班级:_______________ 得分:_______________
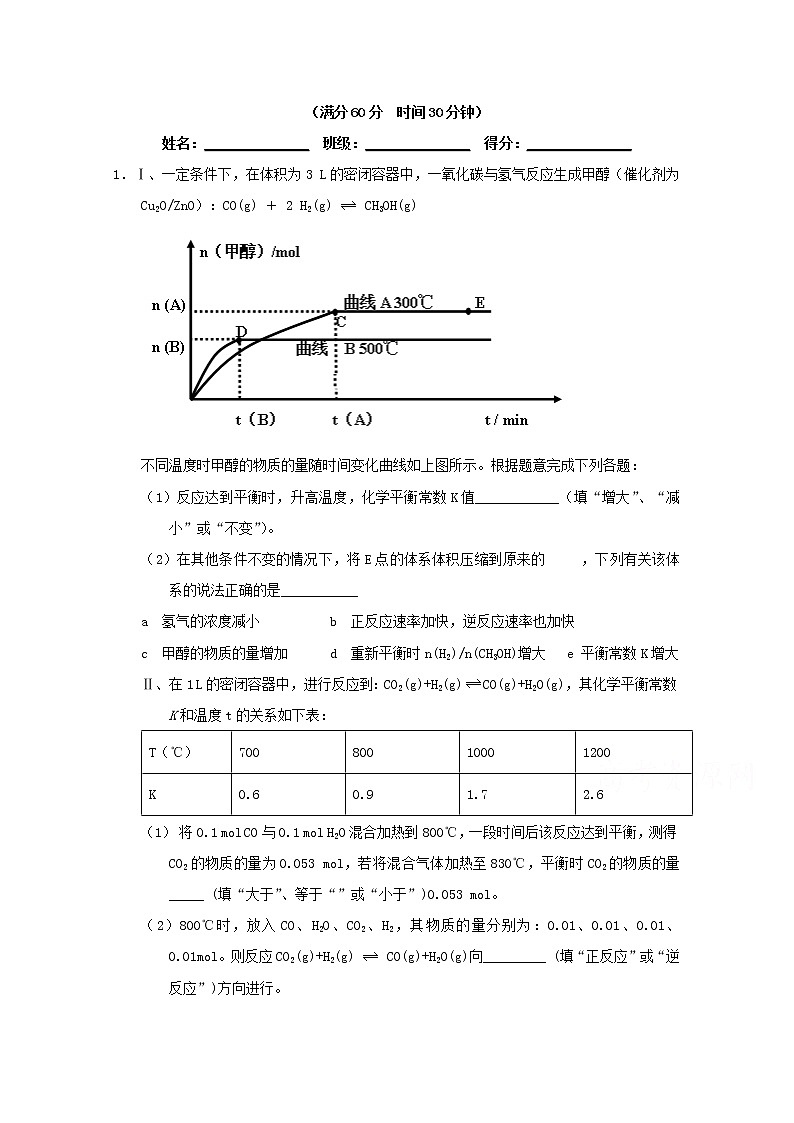
1.Ⅰ、一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g) + 2 H2(g) CH3OH(g)
不同温度时甲醇的物质的量随时间变化曲线如上图所示。根据题意完成下列各题:
(1)反应达到平衡时,升高温度,化学平衡常数K值____________(填“增大”、“减小”或“不变”)。
(2)在其他条件不变的情况下,将E点的体系体积压缩到原来的 ,下列有关该体系的说法正确的是___________
a 氢气的浓度减小 b 正反应速率加快,逆反应速率也加快
c 甲醇的物质的量增加 d 重新平衡时n(H2)/n(CH3OH)增大 e 平衡常数K增大
Ⅱ、在1 L的密闭容器中,进行反应到:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
T(℃) | 700 | 800 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.7 | 2.6 |
(1) 将0.1 mol CO与0.1 mol H2O混合加热到800℃,一段时间后该反应达到平衡,测得CO2的物质的量为0.053 mol,若将混合气体加热至830℃,平衡时CO2的物质的量_____ (填“大于”、等于“”或“小于”)0.053 mol。
(2)800℃时,放入CO、H2O、CO2、H2,其物质的量分别为:0.01、0.01、0.01、0.01mol。则反应CO2(g)+H2(g) CO(g)+H2O(g)向_________ (填“正反应”或“逆反应”)方向进行。
【答案】减小 b c 小于 逆反应
【解析】
【分析】
Ⅰ、由图象可知达到平衡后,升高温度,甲醇的物质的量减小,平衡向左移动,正反应为放热反应,因为升高温度平衡向吸热方向移动;
Ⅱ、根据表中的数据可知,温度越高,化学平衡常数越大,所以该反应为吸热反应。
【详解】
2.研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,
已知:Fe2O3(s)+ 3C(s)=2Fe(s)+ 3CO(g) ΔH 1=+489.0 kJ·mol-1
C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为___________________________________。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:____________________。
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图。①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ_____KⅡ(填“>”或“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容 器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为________。
③一定温度下,此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是_____。
a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH)
d.容器中密度不变 e.2个C=O断裂的同时有3个H-H断裂
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下图。若温度升高,则反应的平衡常数K将____(填“增大”、“减小”或“不变”。下同);若温度不变,提高投料比n(H2)/n(CO2),则K将__________;该反应△H_________0(填“>”、“<”或“=”)。
【答案】Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);ΔH=-28.5 kJ·mol-1 CO-2e-+4OH-=CO32-+2H2O > 1≥c>0.4 bd 减小 不变 <
【解析】
【分析】
(1)根据盖斯定律对已知的两个热化学方程式进行加合运算;
(2)分析CO燃烧反应方程式2CO+O2=2CO2,分析元素化合价变化确定负极原料及电子转移数目,电解质显强碱性,CO2、H+不能大量存在;
(3) ①一定温度下,可逆反应达到平衡状态时生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,称之为化学平衡常数,本题图像是生成物CH3OH的物质的量与时间函数关系,“先拐先平”的原则,生成物浓度越大,则反应物浓度越小,平衡常数就越大。②因为“要使平衡后乙与甲中相同组分的体积分数相等”,所以甲、乙互为“等同平衡”,平衡时各组分物质的量分别对应相等,利用“三段式”确定甲、乙容器中平衡时CH3OH物质的量,若使起始时维持化学反应向逆反应方向进行,则CH3OH初始物质的量不能低于平衡时的CH3OH物质的量,另外,只有反应完全从生成物开始,c才能取最大值。③判断化学平衡状态的标志有两条依据:一是根据正、逆反应速率相等;二是某一物理量不变时,“变量不变”。
(4) 根据平衡常数表达式分析反应物浓度与生成物浓度的相对变化即可解答。由图像分析温度影响平衡移动的方向,再根据勒夏特列原理分析该反应热△H的正负。
【详解】
②利用“三段式”先求出甲容器平衡时各组分物质的量。设甲容器平衡时CH3OH的物质的量为x。
恒温恒容下, ,则有,解得x=0.4mol。甲容器平衡时各组分物质的量分别为CO2为0.6mol、H2为1.8mol、CH3OH为0.4mol、H2O(g)为0.4mol。
因为“要使平衡后乙与甲中相同组分的体积分数相等”,甲、乙互为“等同平衡”,所以达到平衡时甲、乙容器中各组分物质的量分别对应相等。要使反应开始时逆向进行则有下列相关量:
态,d项正确;
e.CO2结构是O=C=O,H2的结构是H—H,单位时间内“2个C=O断裂”是用CO2表示的正反应速率,单位时间内“3个H—H断裂”是用H2表示的正反应速率,无法确定正、逆反应速率是否相等,所以2个C=O断裂的同时有3个H-H断裂不能判断该反应达到平衡状态,e项错误;答案选bd。
(4)由图像知在投料比不变时CO2的平衡转化率随温度的升高而减小,即生成物浓度越来越小,反应物浓度越来越大,根据平衡常数表达式推知平衡常数值越来越小,所以升高温度,反应的平衡常数K将减小。因为平衡常数只受温度的影响,与浓度无关,所以温度不变时,提高投料比,平衡常数K不变。由图像知随温度升高CO2的平衡转化率减小,即平衡向逆反应方向移动,根据勒夏特列原理,逆反应方向是吸热反应,则正反应为放热反应,即该反应△H<0。
3.在一定体积的密闭容器中,进行如下化学反应:其化学平衡常数K与温度t的关系如下:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答下列问题:
(1)该反应的化学平衡常数表达式为K =__________________。
(2)该反应为_________反应。(填“吸热”或“放热”)
(3)若反应温度升高,CO2的转化率________(填“增大”“减小”或“不变”);
(4)能判断该反应是否达到化学平衡状态的依据是______。
A.容器中压强不变 B.混合气体中 c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(5)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为_____℃。
【答案】c(CO)c(H2O)/c(CO2)c(H2) 吸热 增大 BC 830
【解析】
【详解】
化学平衡时,各组分的浓度不随时间的改变而改变,混合气体中 c(CO)不变是平衡的标志,故B正确;C、化学平衡状态的本质是v正=v逆,所以v正(H2)=v逆(H2O)表明水的正逆反应速率相同,表明反应达到平衡状态,故C正确;D、c(CO2)=c(CO)时,和二者的起始量与反应物的转化率有关,不能表明正逆反应速率相等,不能说明达到了平衡状态,故D错误;故选BC;
(5)平衡浓度符合下式c(CO2)•c(CH2)=c(CO)•c(H2O)时,浓度熵和平衡常数相等均等于1,平衡常数只受温度的影响,当K=1时,根据表中数据,温度是830℃,故答案为:830。
4.研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,同温度下涉及如下反应:
①2NO(g)+Cl2(g)2ClNO(g) ΔH1<0,平衡常数为K1;
②2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) ΔH2<0,平衡常数为K2。
(1)4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g) ΔH3,平衡常数K=___________________(用K1、K2表示)。ΔH3=___________(用ΔH1、ΔH2表示)。
(2)为研究不同条件对反应①的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应①达到平衡。测得10 min内v(ClNO)=7.5×10-3mol·L-1·min-1,则平衡后n(Cl2)=__________mol,NO的转化率α1=___________。其他条件保持不变,反应①在恒压条件下进行,平衡时NO的转化率为α2,α1____α2(填“>”“<”或“=”),平衡常数K1______________(填“增大”“减小”或“不变”)。若要使K1减小,可采用的措施是___________。
【答案】K12/K2 ΔH1×2-ΔH2 2.5x10-2 75% < 不变 升高温度
【解析】
【详解】
(1)①2NO(g)+Cl2(g)2ClNO(g) ΔH1<0,平衡常数为K1;②2NO2(g)+NaCl(s)NaNO3(s) 大。平衡常数只受温度影响,所以温度不变,平衡常数不变,要使平衡常数变小,使平衡逆向移动,则改变的条件为升高温度。
高考化学二轮专题大题练习专题41《烃》(含详解): 这是一份高考化学二轮专题大题练习专题41《烃》(含详解),共5页。试卷主要包含了氯乙烯是合成聚氯乙烯的单体等内容,欢迎下载使用。
高考化学二轮专题大题练习专题35《溶液酸碱性 PH相关计算》(含详解): 这是一份高考化学二轮专题大题练习专题35《溶液酸碱性 PH相关计算》(含详解),共6页。试卷主要包含了现有常温下的五份溶液,水的电离平衡曲线如图所示等内容,欢迎下载使用。
高考化学二轮专题大题练习专题32《化学平衡图像》(含详解): 这是一份高考化学二轮专题大题练习专题32《化学平衡图像》(含详解),共9页。












