

所属成套资源:2022届优质校一模试卷专题汇编解析版
2022届优质校一模试卷专题汇编6 元素周期表 解析版
展开
这是一份2022届优质校一模试卷专题汇编6 元素周期表 解析版,共17页。试卷主要包含了微粒中“各数”间的定量关系,“四同”比较,化学键与化合物的关系,巧识10电子、18电子微粒等内容,欢迎下载使用。
专题 6
××
元素周期表
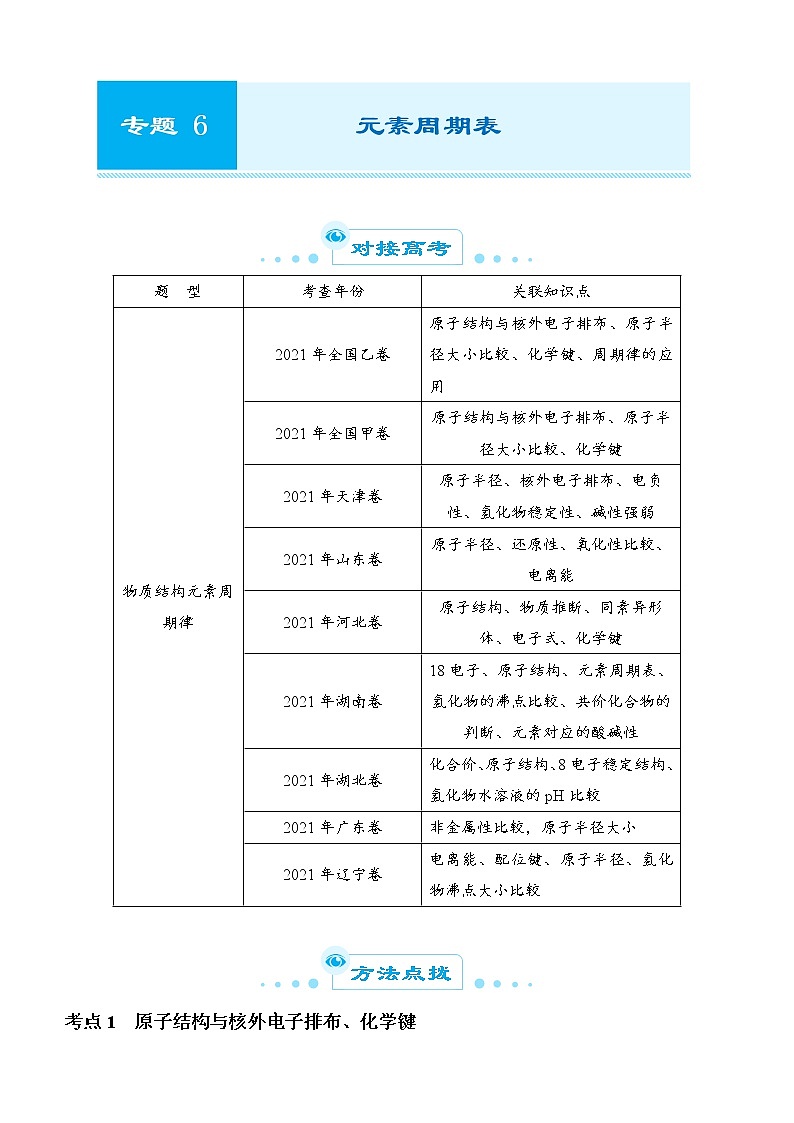
对接高考
题 型
考查年份
关联知识点
物质结构元素周期律
2021年全国乙卷
原子结构与核外电子排布、原子半径大小比较、化学键、周期律的应用
2021年全国甲卷
原子结构与核外电子排布、原子半径大小比较、化学键
2021年天津卷
原子半径、核外电子排布、电负性、氢化物稳定性、碱性强弱
2021年山东卷
原子半径、还原性、氧化性比较、电离能
2021年河北卷
原子结构、物质推断、同素异形体、电子式、化学键
2021年湖南卷
18电子、原子结构、元素周期表、氢化物的沸点比较、共价化合物的判断、元素对应的酸碱性
2021年湖北卷
化合价、原子结构、8电子稳定结构、氢化物水溶液的pH比较
2021年广东卷
非金属性比较,原子半径大小
2021年辽宁卷
电离能、配位键、原子半径、氢化物沸点大小比较
方法点拨
考点1 原子结构与核外电子排布、化学键
1.微粒中“各数”间的定量关系
(1)原子或离子:质量数(A)=质子数(Z)+中子数(N)。
(2)原子:核电荷数=质子数=原子序数=核外电子数。
(3)阴离子:核外电子数=质子数+离子电荷数。
(4)阳离子:核外电子数=质子数-离子电荷数。
2.“四同”比较
同位素
同素异形体
同分异构体
同系物
“同”含义
质子数相同
元素相同
分子式相同
结构相似
“异”含义
中子数不同
性质、结构、组成不同
结构不同
相差“CH2”
研究对象
核素、原子
单质
化合物
有机物
3.化学键与化合物的关系
4.巧识10电子、18电子微粒
(1)10电子微粒 (2)18电子微粒
例题1.(2021年湖南卷)W、X、Y、Z为原子序数依次增大的短周期主族元素,Y的原子序数等于W与X的原子序数之和,Z的最外层电子数为K层的一半,W与X可形成原子个数比为2∶1的分子。下列说法正确的是
A.简单离子半径:
B.W与Y能形成含有非极性键的化合物
C.X和Y的最简单氢化物的沸点:
D.由W、X、Y三种元素所组成化合物的水溶液均显酸性
考点2 元素周期表与元素周期律
1.周期表
(1)元素周期表的结构
①“七横七周期,三短三长一不全;十八纵行十六族,七主七副一Ⅷ一0”。
②从左到右族的分布:ⅠA、ⅡA、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、Ⅷ、ⅠB、ⅡB、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA、0。Ⅷ族:包括8、9、10三个纵列。
③0族:第18纵列,该族元素又称为稀有气体元素。
其原子序数为He 2,Ne 10,Ar 18,Kr 36,Xe 54,Rn 86。
④同周期第ⅡA和第ⅢA原子序数的差值可能为:1、11、25。
(2)电子排布规律
最外层电子数为1或2的原子可以是ⅠA族或ⅡA族或副族或Ⅷ族元素的原子或0族的He原子;最外层电子数是3~7的原子一定是主族元素的原子,且最外层电子数等于主族的族序数。
(3)分区
①分界线:沿着元素周期表中硼、硅、砷、碲、砹与铝、锗、锑、钋的交界处画一条虚线,即为金属元素区和非金属元素区的分界线。
②各区位置:分界线左下方为金属元素区,分界线右上方为非金属元素区。
③分界线附近元素的性质:既表现金属元素的性质,又表现非金属元素的性质。
2.周期律
(1)主族元素性质递变规律
项目
同周期(左→右)
同主族(上→下)
离子的氧化性、还原性
阳离子的氧化性逐渐增强,阴离子的还原性逐渐减弱
阳离子的氧化性逐渐减弱,阴离子的还原性逐渐增强
非金属元素气态氢化物的形成难易(氢化物的热稳定性)
形成由难→易(氢化物的热稳定性逐渐增强)
形成由易→难(氢化物的热稳定性逐渐减弱)
最高价氧化物对应的水化物的酸碱性
碱性逐渐减弱,酸性逐渐增强
碱性逐渐增强,酸性逐渐减弱
电离能
第一电离能逐渐增大(IIA族元素的I1大于IIIA族元素;VA族元素的I1大于VIA族元素)
逐渐减小
电负性
逐渐增大
逐渐减小
(2)“四看”突破粒子半径大小比较
“一看”电子层数:当最外层电子数相同,电子层数不同时,电子层数越多,半径越大。(同主族)
“二看”核电荷数:当电子层数相同时,核电荷数越大,半径越小。(同周期)
“三看”核外电子数:当电子层数和核电荷数均相同时,核外电子数越多,半径越大。(同元素)
“四看”原子序数:当核外电子数相同时,原子序数越高,离子半径越小。(同结构)
(3)元素金属性和非金属性强弱的判断方法
金属性比较
本质
原子越易失电子,金属性越强(与原子失电子数目无关)
判断方法
①在金属活动性顺序表中越靠前,金属性越强
②单质与水或非氧化性酸反应越剧烈,金属性越强
③单质还原性越强或阳离子氧化性越弱,金属性越强
④最高价氧化物对应水化物的碱性越强,金属性越强
⑤若Xn++Y―→X+Ym+,则Y比X的金属性强
⑥元素在周期表中的位置:左边或下方元素的金属性强
非金属性比较
本质
原子越易得电子,非金属性越强(与原子得电子数目无关)
判断方法
①与H2化合越容易,气态氢化物越稳定,非金属性越强
②单质氧化性越强或阴离子还原性越弱,非金属性越强
③最高价氧化物对应水化物的酸性越强,非金属性越强
④元素在周期表中的位置:右边或上方元素的非金属性强
(4)元素周期律的“特殊性”
①O、F无最高正价
②元素的非金属性越强,其单质的活泼性不一定越强,如N非金属性较强,但N2性质稳定。
③氢键不会影响稳定性,但是会影响熔沸点,另外最简单的气体氢化物熔沸点需要考虑氢键的影响,但是如果仅仅只是氢化物的话,不一定是有氢键的物质熔沸点高,例如烷烃当碳个数超过11时变成固体,其熔沸点则变得更高了。
例题2.(2021年北京卷)下列性质的比较,不能用元素周期律解释的是
A.酸性:HClO4>H2SO3>H2SiO3 B.碱性:KOH>NaOH>LiOH
C.热稳定性:H2O>H2S>PH3 D.非金属性:F>O>N
考点3 近几年的热门考点—结构式推断
根据2/8电子稳定结构推断
H/卤素成一个键;O/S成两个键;B/N成三个键;Si/C成四个键
特殊情况:N也可能成四个键,则其中一条是配位键,而且是提供孤对电子对一方;B也能成四个键,其中一条是配位键,而且是接受孤对电子对一方。在[ ]外面的一般都是金属阳离子,一价往往是Na或者Li,二价是Mg或者Ca。
例题3.(2021年辽宁卷)某多孔储氢材料前驱体结构如图,M、W、X、Y、Z五种元素原子序数依次增大,基态Z原子的电子填充了3个能级,其中有2个未成对电子。下列说法正确的是
A.氢化物沸点: B.原子半径:
C.第一电离能: D.阴、阳离子中均有配位键
试题汇编
1.(2022·重庆南开中学模拟)2020年12月17日,“嫦娥五号”顺利将月壤带回地球。科学家发现月壤中有地球土壤中没有的。是一种优良的核反应原料,与氘发生核聚变反应,放出巨大的能量:,下列有关说法正确的是
A.和互为同位素
B.等质量的和具有相同的中子数
C.与发生的核聚变反应属于化学变化
D.位于周期表的第1行、第18列
2.(2021·云南·昆明一中高三)W、X、Y、Z为原子序数依次增大的短周期主族元素,且主族序数满足Y=W+X;Z的最外层电子数比K层电子数多一个,W与Y可形成原子数之比为1∶1的18e-分子。下列说法错误的是
A.简单离子半径:X>Y>Z
B.W与X能形成含有非极性键的化合物
C.受到氢键的影响,最简单氢化物的稳定性:Y>X
D.W、X、Y三种元素组成的化合物溶于水可能显碱性
3.(2021·辽宁沈阳·高三)2019年诺贝尔化学奖颁给研究锂电池的科学家,一种用作锂电池电解液的锂盐结构如图所示。其中,X位于第三周期,X原子的电子数为Z原子的两倍,W、Z、Y位于同一周期。下列叙述正确的是
A.非金属性:X>Z>W
B.原子半径:X>W>Z
C.电负性:W>Z>Y
D.X的氧化物对应的水化物均为强酸
4.(2021·北京师大附中高三)如图所示是元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
A.W的基态原子的最外层p轨道上有3个未成对电子
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的电负性比X的电负性大
D.第一电离能:R>Y>W
5.(2021·山东日照·模拟)短周期主族元素X、Y、Z、W原子序数依次增大,X原子核外有7个电子,基态Y原子无未成对电子,Z与X为同族元素,W最高价含氧酸为二元酸,下列说法正确的是
A.原子半径:r(X)W>Y>X D.火星气体中可能含有XY、XY2
11.(2021·黑龙江·大庆一模)X、Y、Z、Q、R 是五种短周期主族元素,原子序数依次增大。X、Y 最高正价与最低负价之和均为0,Q与X同主族,Z的氧化物是大气的主要污染物之一,Z与R的最外层电子数之和为8,下列说法正确的是
A.原子半径大小顺序为:R>Q>Z>Y>X
B.Y的氢化物的沸点一定低于Z的氢化物
C.Z、Q、R的最高价氧化物对应的水化物两两之间可以相互反应
D.元素Q、R分别与氯元素形成的化合物均为离子化合物
12.(2021·黑龙江·高三)X、Y、Z、W、M均为短周期主族元素,X、Y同周期,Z、W、M也处于同一周期,Y是形成化合物种类最多的元素,M为短周期中除稀有气体元素外原子半径最大的元素,X、Y原子最外层电子数之和等于Z、W原子最外层电子数之和,X、W的简单离子X2-、W3+具有相同的电子层结构。下列说法正确的是
A.Y最高价氧化物对应的水化物为弱酸
B.原子半径大小顺序为:M>W>X>Y>Z
C.X、Y、M形成的盐只有一种
D.简单氢化物的沸点:Y>X
13.(2021·浙江台州·一模)已知前4周期的主族元素在周期表中的相对位置如图所示,其中X元素的单质在常温下为液体。下列说法不正确的是
A.与Q同族的元素,从上到下最高价氧化物的水化物在水中溶解度依次增大
B.Y元素可能存在、及不稳定等多种氧化物
C.在Z、R、Y的最高价氧化物的水化物中,R的最高价氧化物的水化物酸性最弱
D.位于第6周期与X同族的元素,原子序数为85,属于金属元素
14.(2021·江苏无锡·高三)、、、是周期表中的短周期主族元素。下列有关说法正确的是
A.元素S在周期表中位于第3周期ⅣA族
B.第一电离能:
C.原子半径r:
D.因为水分子间含有氢键,氢化物的稳定性
15.(2021·山东·枣庄市第三中学高三)短周期元素原子组成的某种分子的结构式如图所示。X原子的核外电子只有一种运动状态;W、Y、Z位于同一周期,Z元素原子中p轨道所含电子数与s轨道相等。E与W有相同数目的价电子。下列说法错误的是
A.电负性:
B.简单阴离子半径:
C.同周期中,第一电离能大于Z的元素有2种
D.同主族元素中,W形成的气态氢化物最稳定
16.(2021·湖南师大附中高三)X、Y为第三周期元素、Y的最高正价与最低负价的代数和为6,二者形成的一种化合物能以[XY4]+[XY6]-的形式存在。下列说法错误的是
A.原子半径:X>Y
B.简单氢化物的还原性:X>Y
C.同周期元素形成的单质中Y的氧化性最强
D.X的简单氢化物沸点比上一周期同主族元素的高
17.(2021·江苏常州·高三)短周期主族元素X、Y、Z、W的原子序数依次增大。X和Y的单质常温下均为气体,Z的族序数等于其周期序数,W的核外电子数是X和Y的核外电子数之和的2倍。下列有关说法正确的是
A.W位于周期表第二周期VIA族
B.第一电离能:Y<W
C.简单离子的半径:X<Y<Z<W
D.X、Y和W可形成含共价键的离子化合物
18.(2021·湖北·高三)某多孔储氢材料前驱体结构如图,M、W、X、Y、Z五种短周期元素原子序数依次增大,基态Z原子的电子填充了3个能级,其中有2个未成对电子。下列叙述正确的是
A.最简单氢化物的热稳定性:X>Y
B.该化合物阴阳离子中均有配位键
C.第一电离能:Z>Y>X>W
D.Y元素基态原子有5种不同运动状态的电子
参考答案
方法点拨:
例题1.【答案】B
【解析】Z的最外层电子数为K层的一半,则Z的核外有3个电子层,最外层电子数为1,即为Na,W与X能形成原子个数比为2∶1的18电子的分子,则形成的化合物为N2H4,所以W为H,X为N,Y的原子序数是W和X的原子序数之和,则Y为O。据此分析解答。A.离子的电子层数相同时,原子序数越小,半径越大,即离子半径大小为:N3->O2->Na+,即简单离子半径为:X>Y>Z,故A错误;B.W为H,Y为O,能形成H2O2,含有极性共价键和非极性共价键,故B正确;C.X的最简单氢化物为氨气,Y的最简单氢化物为水,水的沸点高于氨气,即最简单氢化物的沸点为Y>X,故C错误;D.由W、X、Y三种元素形成的化合物有硝酸,硝酸铵,氨水等,硝酸,硝酸铵显酸性,氨水显碱性,故由W、X、Y三种元素形成的化合物不一定都是酸性,故D错误;故选B。
例题2.【答案】A
【解析】A.元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强,由于S元素最高价含氧酸是H2SO4,不是H2SO3,因此不能根据元素周期律判断酸性:HClO4>H2SO3>H2SiO3,A错误;B.同一主族元素的金属性随原子序数的增大而增强。元素的金属性越强,其最高价氧化物对应的水化物的碱性就越强。元素的金属性:K>Na>Li,所以碱性:KOH>NaOH>LiOH,B正确;C.同一周期元素的非金属性随原子序数的增大而增强;同一主族元素的非金属性随原子序数的增大而减弱。元素的非金属性越强,其简单氢化物的稳定性就越强。元素的非金属性:O>S>P,所以氢化物的热稳定性:H2O>H2S>PH3,C正确;D.同一周期元素的非金属性随原子序数的增大而增强,所以元素的非金属性:F>O>N,D正确;故合理选项是A。
例题3.【答案】D
【解析】由题干信息可知,基态Z原子的电子填充了3个能级,其中有2个未成对电子,故Z为C或者O,根据多孔储氢材料前驱体结构图可知Y周围形成了4个单键,再结合信息M、W、X、Y、Z五种元素原子序数依次增大,故Y为N,故Z为O,M只形成一个单键,M为H,X为C,则W为B,据此分析解题。A.由分析可知,X、Y的氢化物分别为:CH4和NH3,由于NH3存在分子间氢键,故氢化物沸点:,A错误;B.根据同一周期从左往右主族元素的原子半径依次减小,同一主族从上往下依次增大,故原子半径:,B错误;C.根据同一周期从左往右元素的第一电离能呈增大趋势,IIA与IIIA,VA与VIA反常,故第一电离能:,C错误;D.由于阳离子中的Y原子是N原子,形成了类似于铵根离子的阳离子,故存在配位键,阴离子中的W为B,最外层上只有3个电子,能形成3个共价键,现在形成了4个共价键,故还有一个配位键,D正确;故答案为:D。
试题汇编:
1.【答案】D
【解析】A.D和H互为同位素,和是不同单质,A错误;B.等质量的和中子数之比为2∶3,B错误;C.核聚变不是化学反应,C错误;D.属于He元素,是稀有气体,位于周期表的第1行、第18列,D正确;故选D。
2.【答案】C
【解析】依题意:W、X、Y、Z为原子序数依次增大的短周期主族元素,Z的最外层电子数比K层电子数多一个,故Z可能为B或Al,W与Y可形成原子数之比为1∶1的18e-分子即H2O2故W为H,Y为O,Z为Al,主族序数满足Y=W+X,故X 为N 。A.简单离子半径:X(N3-)>Y(O2-)>Z(Al3+),A正确;B.W与X能形成H2N—NH2,其为含有非极性键的化合物,B正确;C.氢键影响熔、沸点,不影响氢化物的稳定性,氢化物的稳定性与元素非金属性相关,C错误;D.W(H),X(N),Y(O)三种元素组成的化合物N2H4·H2O(或NH3·H2O)溶于水显碱性,D正确;故选C。
3.【答案】B
【解析】从结构图中可以看出,X能形成6个共价键,则其原子的最外层有6个电子,X位于第三周期,从而得出X为硫元素;X原子的电子数为Z原子的两倍,则Z为氧元素;从结构图中可以看出,Y能形成1个共价键,W、Z、Y位于同一周期,则Y为氟元素;阴离子所得电子应填充在W的最外层上,所以W的最外层应有5个电子,从而确定W为氮元素。W、X、Y、Z分别为N、S、F、O元素。A.X、Z、W分别为S、O、N元素,非金属性:Z(O)>W(N)>X(S),A不正确;B.X、Z、W分别为S、O、N元素,原子半径:X(S)>W(N)>Z(O),B正确;C.W、Y、Z分别为N、F、O元素,非金属性Y(F)>Z(O)>W(N),则电负性:Y(F)>Z(O)>W(N),C不正确;D.X为S元素,X的氧化物对应的水化物H2SO3为弱酸,D不正确;故选B。
4.【答案】A
【解析】从图中可以看出,R为稀有气体元素;由此推出R、W、X、Y、Z分别为Ar、P、N、S、Br。A.W为磷元素,其基态原子的电子排布式为1s22s22p63s23p3,最外层p轨道上有3个未成对电子,A正确;B.Y、Z为S、Br,Br比S多一个电子层,原子转化为阴离子时,电子层数不变,它们的阴离子电子层结构不相同,B不正确;C.W、X分别为P、N,二者为同主族元素,P在N的下方,非金属性P比N小,所以W(P)的电负性比X(N)的电负性小,C不正确;D.R、W、Y分别为Ar、P、S,Ar的第一电离能最大,P的最外电子层处于半满状态,第一电离能出现反常,所以第一电离能:R(Ar)>W(P)>Y(S),D不正确;故选A。
5.【答案】D
【解析】X原子核外有7个电子,则其原子序数为7,所以X为N;Z与X为同族元素,则Z为P;基态Y原子无未成对电子,且原子序数介于N和P之间,则Y为Mg;W的原子序数比P大,最高价含氧酸为二元酸,则W为S。A.同一周期,从左到右原子半径逐渐减小,同一主族,从上到下原子半径逐渐增大,故原子半径:r(Y)>r(Z)>r(W)> r(X),故A错误;B.Mg2+核外有两个电子层,而S2-核外有三个电子层,二者结构不同,故B错误;C.元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,非金属性:N>P,酸性:HNO3>H3PO4,故C错误;D.同一周期从左到右第一电离能呈增大趋势,但是在VA族元素的价电子处于半充满状态,较难失电子,则其第一电离能比同周期VIA族元素的第一电离能大,则第一电离能:I1(Y)Y>Z,故A错误;B.W为H、X为C,C和H形成的化合物种类最多,故B正确;C.元素非金属性越强,最简单氢化物的沸点越高,而非金属性:F>Cl,则沸点Z>M,故C错误;D.X、M最高价氧化物对应水化物分别是H2CO3、HClO4,由于碳酸是弱酸,高氯酸是强酸,则酸性:XY(P)>X(Si),故B错误;C.Y为P,P元素的最高价氧化物对应水化物为磷酸,磷酸是三元中强酸,只能部分电离,属于弱电解质,故C正确;D.新化合物中P元素最外层电子数为5+2+1=8,满足8电子稳定结构,故D错误;故选C。
10.【答案】C
【解析】已知X、Y、Z、W为原子序数递增的四种短周期元素,其中Z为金属元素,其单质与热水反应后溶液能使酚酞试液变为浅红色,则Z为Mg;X、W为同一主族元素,Y也是地球地壳中含量最高的元素,则Y为O元素;火星岩石含有则,根据化合物中元素化合价代数和为零即可得W的化合价为+4价,则W为Si,X为C元素。综上所述X、Y、Z、W分别为C、O、Mg、Si。A、W为14号Si元素,位于元素周期表中第三周期第IVA族,故A正确;B、X、W分别为C、Si的同一主族非金属元素,由X的非金属性强于W,所以X、W简单氢化物的稳定性:X>W,故B正确;C、电子层越多,原子半径越大,同一周期,从左到右,原子半径逐渐减小,X、Y、Z、W分别为C、O、Mg、Si,则原子半径:Z>W>X>Y,故C错;D.XY、XY2分别为CO、CO2,故D正确;答案选C。
11.【答案】C
【解析】X、Y、Z、Q、R是五种短周期主族元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0,则X是H,Y为C,Q与X同主族,则Q为Na,Z的氧化物是大气的主要污染物之一,Z是N,Z与R的最外层电子数之和为8,则R是P,X、Y、Z、Q、R分别是:H,C,N,Na,Al。A.—般而言,电子层数越多,半径越大,电子层数相同,质子数越小,半径越大,所以原子半径大小顺序为:Na >Al > C > N > H,A错误;B.Y的氢化物碳原子数可能比较多,常温的时候可能为固态,沸点较大,B错误;C.Z、Q、R的最高价氧化物对应的水化物分别为硝酸,氢氧化钠,氢氧化铝,这些物质两两之间可以相互反应,C正确;D.AlCl3为共价化合物,不是离子化合物,D错误;故选C。
12.【答案】A
【解析】X、Y、Z、W、M均为短周期主族元素,X、Y同周期,Z、W、M也处于同一周期,Y是形成化合物种类最多的元素,则Y是C元素;M为短周期中除稀有气体元素外原子半径最大的元素,则M是Na元素;X、W的简单离子X2-、W3+具有相同的电子层结构,则X是O元素,W是Al元素;X、Y原子最外层电子数之和等于Z、W原子最外层电子数之和, 则Z是Cl元素。根据上述分析可知:X是O,Y是C,Z是Cl,W是Al,M是Na元素。A.Y是C,其最高价氧化物对应的水化物是H2CO3,H2CO3是弱酸,A正确;B.同一周期元素,原子序数越大,原子半径越小;不同周期元素,原子核外电子层数越多,原子半径越大,则上述五种元素的原子半径大小关系为:M>W>Z>Y>X,B错误;C.X是O,Y是C,M是Na元素,这三种元素形成的盐可以是Na2CO3、Na2C2O4等,因此三种元素不仅只形成一种盐,C错误;D.X是O,Y是C,其形成的简单氢化物是H2O、CH4,前者在室温下呈液态,后者呈固态,则二者的沸点:H2O>CH4,所以简单氢化物的沸点:X>Y,D错误。
13.【答案】D
【解析】X元素的单质在常温下为液体,X是Br元素;根据在元素周期表中的相对位置,可知Y是S元素、Z是C元素、R是Si元素、Q是Mg元素。A.Mg是ⅡA族元素,ⅡA族元素从上到下最高价氧化物的水化物在水中溶解度依次增大,故A正确;B.根据化合价规律,S元素可能存在、及不稳定等多种氧化物,故B正确;C.非金属性越强,最高价含氧酸的酸性越强,非金属性S>C>Si,所以最高价氧化物的水化物中,H2SiO3的酸性最弱,故C正确;D.位于第6周期与Br同族的元素是At,原子序数为85,属于非金属元素,故D错误;选D。
14.【答案】B
【解析】A.元素S在周期表中位于第3周期ⅥA族,A错误;B.同周期第一电离能从左到右呈增大趋势,故,B正确;C.同周期从左到右元素原子半径减小,同主族从上到下元素原子半径增大,故,C错误;D.氢键影响物质的物理性质,氢化物的稳定性是因为氢氧键键能大于氢硫键键能,D错误;故选B。
15.【答案】C
【解析】X原子的核外电子只有一种运动状态,则X原子核外只有1个电子,因此X为H,W原子的成键数为1,则W为F或Cl,Y的成键数为4,则Y为C或Si,Z元素原子中p轨道所含电子数与s轨道相等,则Z为O或Mg,因Z与非金属原子之间形成的是共价键,则Z为O,W、Y、Z位于同一周期,因此W为F,Y为C,E与F原子有相同数目的价电子,且为短周期元素,则E为Cl。由上述分析可知,X为H,Y为C,Z为O,W为F,E为Cl。A.同一周期从左至右元素的电负性逐渐增大,同一主族从上至下元素的电负性逐渐减小,因此电负性:F>C>H,故A正确;B.Cl-核外有3个电子层,F-、O2-核外有2个电子层,粒子核外电子层数越多,其半径越大,电子层数相同时,原子核内质子数越多,半径越小,因此半径:Cl->O2->F-,故B正确;C.同一周期中,原子的第一电离能从左至右有逐渐增大的趋势,由于价电子所填充轨道全充满或半充满会反常,因此第二周期中第一电离能大于O原子的有N、F、Ne,共3种,故C错误;D.元素的非金属性越强,其形成的简单气态氢化物的稳定性越好,同主族元素从上至下元素的非金属性逐渐减弱,因此VIIA族中元素形成的气态氢化物中HF最稳定,故D正确;故答案为C。
16.【答案】D
【解析】Y位于第三周期,且最高正价与最低负价的代数和为6,则Y是Cl,由X、Y形成的阴离子和阳离子知,X与Y容易形成共价键,根据化合物的形式知X是P。A.P与Cl在同一周期,则P半径大,即X> Y,A项不符合题意;B.两者对应的简单氢化物分别是PH3和HCl,PH3的还原性强,即X>Y,B项不符合题意;C.同周期元素从左往右,金属性减弱,非金属性增强,各元素对应金属单质还原性减弱,非金属单质的氧化性增强,所以Cl2的氧化性最强,C项不符合题意;D. X是P,上一周期同主族元素为N,NH3存在氢键,PH3的沸点比NH3低,D项不符合题意;故答案为D。
17.【答案】D
【解析】短周期主族元素X、Y、Z、W的原子序数依次增大。X和Y的单质常温下均为气体,Z的族序数等于其周期序数,则Z是13号Al元素;W的核外电子数是X和Y的核外电子数之和的2倍,则W是16号S元素,X是1号H元素,Y是7号N元素。根据上述分析可知X是H,Y是N,Z是Al,W是S元素。A.W是S元素,位于元素周期表第三周期第VIA族,A错误;B.Y是N,W是S,N原子半径比S小,N原子最外层电子处于半满的稳定状态,因此其第一电离能大于S元素,即第一电离能:Y>W,B错误;C.H+核外无电子,离子半径最小;N、Al核外电子排布是2、8,电子层结构相同,离子的原子序数越大,离子半径越小,则离子半径:Al3+<N3-;S2-核外电子排布是2、8、8,电子层数最多,故其半径最大,因此简单离子的半径:X<Z<Y<W,C错误;D.X是H,Y是N,W是S,三种元素形成的化合物如(NH4)2S是离子化合物,其阳离子中含有共价键,因此属于含有共价键的离子化合物,D正确;故选D。
18.【答案】B
【解析】由题干信息可知,基态Z原子的电子填充了3个能级,其中有2个未成对电子,故Z为C元素或者O原子,根据多孔材料前驱体机构,Z可以形成2个共价键,因此,Z为O元素,M只形成一个单键,因此M为H元素,Y周围形成了4个化学键,因此Y为N元素,X可形成4个共价键,因此X为C元素,W为B元素。综上所述,M为H元素、W为B元素、X为C元素、Y为N元素、Z为O元素。A.C的非金属性弱于N,因此其气态氢化物的稳定CH4
相关试卷
这是一份2022届优质校一模试卷专题汇编9 化学实验基础 解析版,共22页。试卷主要包含了防堵塞装置,流速控制器,连通器,防倒吸装置,保护装置,尾气处理装置,下列实验操作不正确的是等内容,欢迎下载使用。
这是一份2022届优质校一模试卷专题汇编8 新信息反应机理分析 解析版,共18页。试卷主要包含了化学动力学与反应历程,基元反应与非基元反应,有效碰撞理论与活化能,过渡态与中间体,能垒与决速步,催化剂与中间产物的判断等内容,欢迎下载使用。
这是一份2022届优质校一模试卷专题汇编5 有机物的结构与性质 解析版,共16页。试卷主要包含了能助力自噬细胞“吞没”致病蛋白,有机物与日常生活,的结构如下图所示等内容,欢迎下载使用。








