

四川省宜宾市2021-2022学年高三第一次诊断检测理综化学试题(含答案)
展开(考试时间:150分钟满分:300分)
可能用到的相对原子质量:H 1 C 12 O 16 K 39 Mn 55 Fe 56
一、选择题:本题共7小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。
7.2021年9月7日是“国际清新空气蓝天日”,其主题是“健康的空气,健康的地球”。下列叙述错误的是
A.提高汽油燃烧效率,可减少汽车有害尾气的排放
B.多利用太阳能、风能等新能源,可减少污染物的排放
C.对燃煤进行“脱硫”处理,可减少酸雨的形成
D.加高工厂的烟囱,可减少有害气体的排放
8.MEK抑制剂司美替尼是治疗癌症的一种新药,由(a)和乙醇(b)为原料合成。下列叙述正确的是
A.a分子含有3种官能团
B.b分子所有原子可能共平面
C.a和b均能发生加成反应、取代反应
D.a和b可用饱和碳酸氢钠溶液加以鉴别
9.X、Y、Z、M为原子序数依次增大的短周期主族元素,在周期表中互不相邻。X、Z同主族,Y、Z原子序数相差4,Z和M最外层电子数之和为8。下列叙述正确的是
A.原子半径:M>Z>Y>XB.最高价含氧酸酸性:M>Y
C.ZX为共价化合物D.Z的氧化物只有一种
10.设NA为阿伏加德罗常数的值。下列叙述正确的是
A.28 gC3H6中C—H键的数目为4 NA
B.标准状况下,22.4 L SO3含有的原子数为4NA
C.物质的量相等的H2O和D2O,其中子数相差2NA
D.1 L 0.1 ml•L−1 Al2(SO4)3溶液中含有Al3+的数目为0.2 NA
11.下列实验装置正确且能达到相应实验目的的是
12.锰及其化合物在工业上应用十分广泛。利用右图装置,可从MnSO4溶液中电沉积金属锰,并联产MnO2,同时回收硫酸。下列叙述错误的是
A.a连接电源负极
B.膜n为阴离子交换膜
C.阳极上的反应式为:
Mn2++2H2O-2e-===MnO2+4H+
D.阴极析出11 g Mn,理论上外电路中迁移了0.4 ml电子
13.湿法提银工艺中,浸出的Ag+需加入Cl-进行沉淀。25 ℃时,平衡体系中含Ag微粒的分布系数δ[如δ()=]随lgc(Cl-)的变化曲线如下图所示。已知:lg[Ksp(AgCl)]=-9.75。下列叙述错误的是
A.AgCl溶解度随c(Cl-)增大而不断减小
B.沉淀最彻底时,溶液中c(Ag+)=10-7.21 ml•L−1
C.当c(Cl-)=10-2 ml•L−1时,溶液中c(AgCl)>c(Ag+)>c(AgCl)
D.25 ℃时,AgCl+Cl-AgCl的平衡常数K=100.2
26.(14分)
含氯消毒剂和过氧化物消毒剂均可有效灭杀新冠病毒。
= 1 \* ROMAN I.二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的广谱消毒剂。制备ClO2常见的方法有:
方法1:2NaClO3+2NaCl+2H2SO4===2ClO2↑+Cl2↑+2Na2SO4+2H2O
方法2:在酸性条件下,由NaClO3和双氧水反应制备ClO2。
(1)ClO2中氯元素的化合价是_______,H2O2的电子式是_______。
(2)方法1的反应中,氧化产物与还原产物的物质的量之比是_______。
(3)方法2发生反应的离子方程式是_______。
(4)和方法2比较,方法1的不足之处是_______(写出一点即可)。
= 2 \* ROMAN II.过碳酸钠(2Na2CO3·3H2O2),俗名固态双氧水,具有去污杀菌等功效。其制备原理为:2Na2CO3(aq)+3H2O2(aq)===2Na2CO3·3H2O2(aq) ΔH<0。
(5)结合过氧化氢和碳酸钠的性质,推测制备过碳酸钠的原料中,碳酸钠与过氧化氢的物质的量之比应_______(填“>”、“<”或“=”)2∶3,且加入Na2CO3溶液速度不能过快,原因是_______。
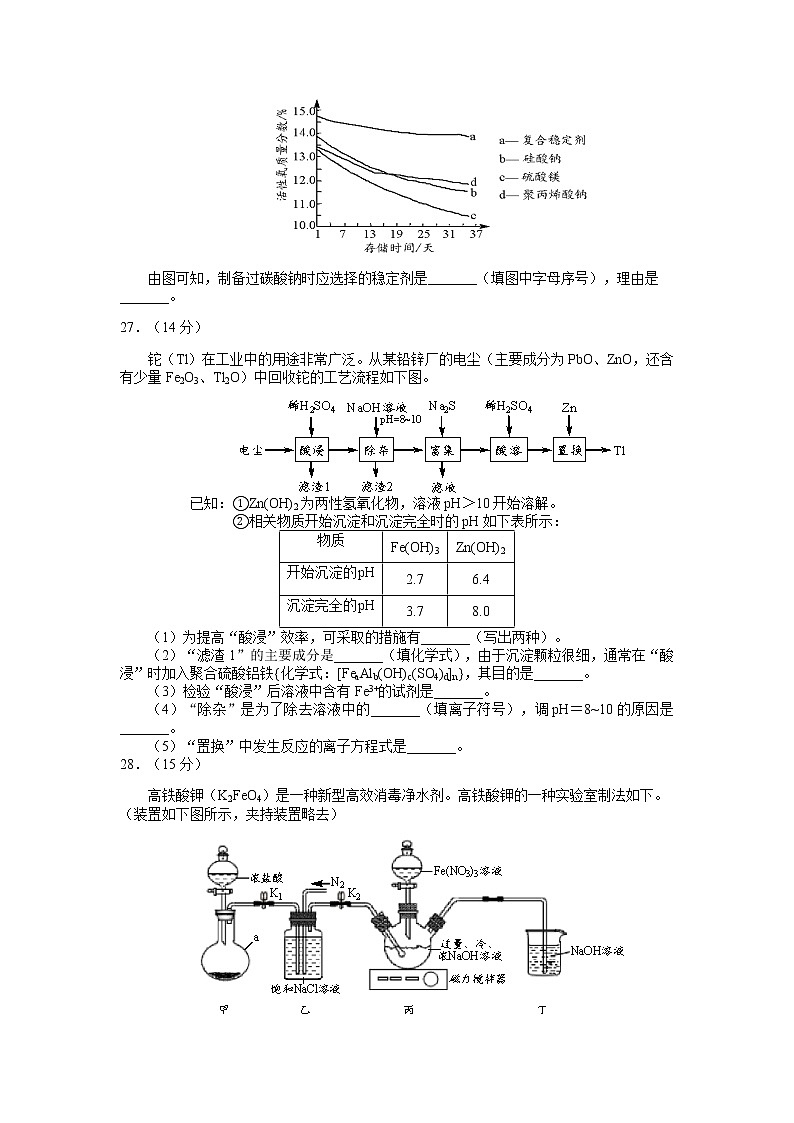
(6)过碳酸钠的储存稳定性是重要的品质指标。以不同种类的稳定剂制备的过碳酸钠产品,测得其活性氧质量分数随时间的变化如下图所示。
由图可知,制备过碳酸钠时应选择的稳定剂是_______(填图中字母序号),理由是_______。
27.(14分)
铊(Tl)在工业中的用途非常广泛。从某铅锌厂的电尘(主要成分为PbO、ZnO,还含有少量Fe2O3、Tl2O)中回收铊的工艺流程如下图。
已知:①Zn(OH)2为两性氢氧化物,溶液pH>10开始溶解。
②相关物质开始沉淀和沉淀完全时的pH如下表所示:
(1)为提高“酸浸”效率,可采取的措施有_______(写出两种)。
(2)“滤渣1”的主要成分是_______(填化学式),由于沉淀颗粒很细,通常在“酸浸”时加入聚合硫酸铝铁{化学式:[FeaAlb(OH)c(SO4)d]n},其目的是_______。
(3)检验“酸浸”后溶液中含有Fe3+的试剂是_______。
(4)“除杂”是为了除去溶液中的_______(填离子符号),调pH=8~10的原因是_______。
(5)“置换”中发生反应的离子方程式是_______。
28.(15分)
高铁酸钾(K2FeO4)是一种新型高效消毒净水剂。高铁酸钾的一种实验室制法如下。(装置如下图所示,夹持装置略去)
Ⅰ.组装好仪器,检查装置气密性,装入药品。
Ⅱ.打开止水夹K1、K2和甲中分液漏斗活塞,反应一段时间,关闭止水夹K1。
Ⅲ.开启磁力搅拌器,缓慢加入100 mL0.8 ml•L−1 Fe(NO3)3溶液,充分反应。
Ⅳ.反应结束,通入N2一段时间,取下三颈烧瓶,在低温下加入KOH固体至溶液饱和,析出粗产品,过滤。
Ⅴ.将粗产品溶于冷的稀KOH溶液,过滤除杂,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置,过滤,用乙醚洗涤。
Ⅵ.重复操作Ⅴ,在真空干燥箱中干燥,得到9.9 g产品。
回答下列问题:
(1)仪器a的名称是_______,a中所盛装的药品是_______(选填字母序号)。
A.NaCl B.MnO2 C.Na2CO3D.KMnO4
(2)步骤Ⅰ,检查甲装置气密性的方法是_______。
(3)乙装置中饱和NaCl溶液的作用是_______。
(4)步骤Ⅱ,丙中三颈烧瓶内发生反应的离子方程式是_______。
(5)步骤Ⅲ,丙中生成Na2FeO4的离子方程式是______。
(6)步骤Ⅳ中通入N2的目的是_______。步骤Ⅴ,将粗产品“过滤除杂”,主要目的是除去_______(填化学式)。
(7)该实验中产品的产率为_______。
35.(15分)
硅芯片的使用减小了电子产品的体积和质量,加快了计算速率。
(1)工业上用SiO2与碳反应制粗硅的反应为:SiO2(s)+2C(s)===Si(s)+2CO(g) ΔH。
已知:2C(s)+O2(g)===2CO(g) ΔH1=―221 kJ·ml-1
Si(s)+O2(g)===SiO2(s) ΔH2=―911 kJ·ml-1
则ΔH=_______。制备粗硅的反应能自发进行的条件是_______(填“高温”、“低温”或“任意温度”)。
(2)由SiO2生成Si的部分反应机理如下:
反应1:SiO2(s)+C(s)SiO(g)+CO(g)
反应2:SiO(g)+2C(s)SiC(s)+CO(g)
反应3:……
在压强为10 MPa条件下,测得反应平衡体系中SiO(g)和CO(g)的分压比[ QUOTE p(SiO)p(CO)p(SiO)p(CO)]随温度的变化关系如右图所示。
假设体系中只有SiO和CO为气体,则在1500℃时,用各物质的平衡分压表示反应1的平衡常数Kp=_______MPa2(列出计算式即可)。
(3)硅烷法制备多晶硅的核心反应为:2SiHCl3(g)SiH2Cl2(g)+SiCl4(g)。在恒容密闭容器中加入一定量的SiHCl3,分别在50 ℃和70 ℃进行反应,测得SiHCl3的转化率随时间的变化关系如下图所示。
已知:50 ℃时,平衡常数为0.02;70 ℃时,平衡常数为0.04。
①代表温度为70℃的曲线是_______(填“M”或“N”)。
②a点和b点对应的容器中,v正(a)_______v正(b)(填“>”、“<”或“=”),理由是_______。
③曲线M对应的SiHCl3平衡转化率为_______。(保留两位有效数字)
④已知:该反应的速率v正=k正•x2(SiHCl3),v逆=k逆•x(SiH2Cl2)•x(SiCl4),k正、k逆分别为正、逆反应速率常数,x为物质的量分数,且平衡常数K= QUOTE 。则b点时的 QUOTE =_______。
36.(题略)
A.制备并收集
少量NH3
B.制备少量O2
C.制备并检验SO2气体
D.比较元素非金属
性:Cl>C>Si
物质
Fe(OH)3
Zn(OH)2
开始沉淀的pH
2.7
6.4
沉淀完全的pH
3.7
8.0
四川省巴中市2023届高三一模考试理综化学试题含答案: 这是一份四川省巴中市2023届高三一模考试理综化学试题含答案,共9页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
四川省宜宾市2023届高三下学期高考模拟(第二次诊断考试)理综化学试题: 这是一份四川省宜宾市2023届高三下学期高考模拟(第二次诊断考试)理综化学试题,共18页。试卷主要包含了单选题,实验题,工业流程题,原理综合题,结构与性质,有机推断题等内容,欢迎下载使用。
2020珠海高三三模理综-化学试题含答案: 这是一份2020珠海高三三模理综-化学试题含答案












