


辽宁省六校协作体2021-2022学年高二下学期期初考试化学试题含答案
展开考试时间:75分钟 满分100分
命题校:东港市第二中学
可能用到的相对原子质量:H 1 C12 O 16 Na 23 Mn 55
一.选择题(本题共15小题,每题3分,共计45分,每小题只有一个选项符合要求)
1.化学与科技生产、生活环境等密切相关,下列说法错误的是( )
A.电热水器用镁棒防止内胆腐蚀,利用了外加电源的阴极保护法
B.明矾能用于净水是因为铝离子水解生成的氢氧化铝胶体具有吸附性
C.减少燃煤的使用,改用风能太阳能等能源符合“低碳生活”理念
D.市售暖贴的发热原理是利用原电池加快氧化还原反应速率
2.1ml/L盐酸与铁片的反应,下列措施不能加快产生H2反应速率的是( )
A.加入一小块铜片B.改用等体积3ml/L盐酸
C.用等量铁粉代替铁片D.改用等体积 98%的硫酸
3.下列说法正确的是( )
A. 向1L1ml/L的NaOH溶液中加入下列物质:①浓H2SO4(△H1);②稀硝酸(△H2);③稀醋酸(△H3)恰好完全反应的热效应△H1>△H2>△H3
B.甲烷的标准燃烧热为890. 3kJ·ml-1 ,则甲烷燃烧热的热化学方程式可表示为CH4(g)+ 2O2(g) =CO2(g)+2H2O(g) ΔH=-890. 3kJ·ml-1
C.同温同压下,H2(g)+ Cl2(g)=2HCl(g)在光照条件和点燃条件下的ΔH 相同
D.500℃、30MPa下,将0. 5ml N2(g)和1. 5ml H2(g)置于密闭的容器中充分反应生成NH3(g),放热19. 3kJ,其热化学方程式为N2(g) + 3H2(g) 2NH3(g) ΔH = - 38.6kJ·ml- 1
4.下列说法不正确的是( )
A.互为手性异构体的分子组成相同,官能团不同
B.利用手性催化剂合成可以只得到一种或主要得到一种手性分子
C.原子中的电子在跃迁时会发生能量的变化,能量的表现形式之一是光 辐射,这也是原子光谱产生的原因
D.霓虹灯光、激光、焰火都与电子跃迁释放能量有关
5.NA代表阿伏加德罗常数的值,下列叙述错误的是( )
A.锌-铜稀硫酸原电池中,当电路中有2个电子通过时,产生
B.4.6g的符合分子式的分子中, 极性共价键数为0.7NA
C.1LpH=2的醋酸溶液中,的数目为0.01NA
D.电镀铜时,当阳极质量减少64g时,电路中通过的电子数为2NA
6.工业上常用和为原料合成,过程中发生如下两个反应
反应Ⅰ:
反应Ⅱ:
已知:几种化学键的键能如下表所示:
则“C≡O”的键能(kJ/ml)是( )
A.1070B.1067C.1162D.1152
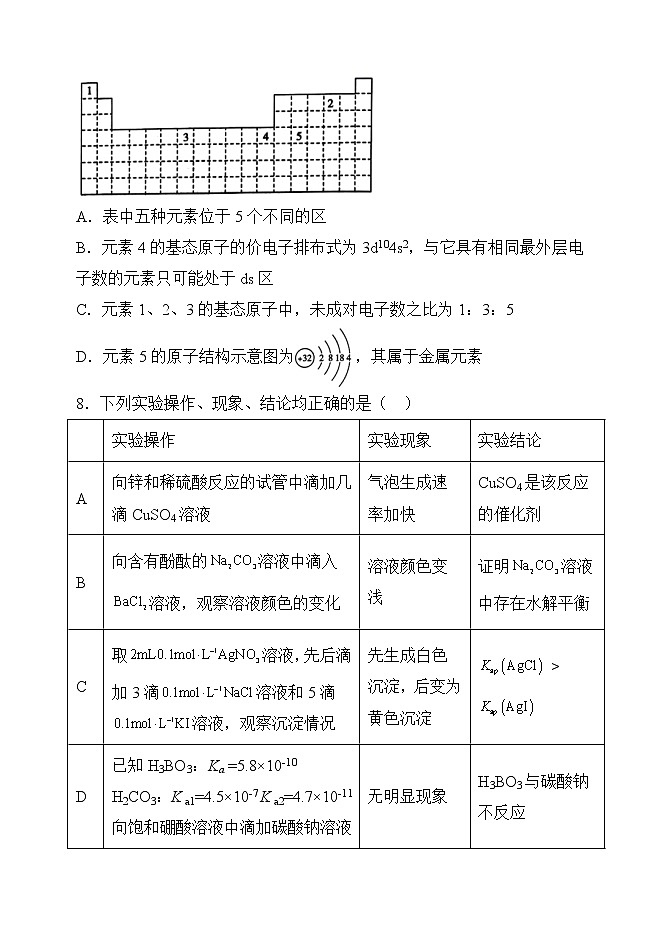
7.已知某些元素在元素周期表中的位置如图所示,下列说法正确的是( )
A.表中五种元素位于5个不同的区
B.元素4的基态原子的价电子排布式为3d104s2,与它具有相同最外层电子数的元素只可能处于ds区
C.元素1、2、3的基态原子中,未成对电子数之比为1:3:5
D.元素5的原子结构示意图为,其属于金属元素
8.下列实验操作、现象、结论均正确的是( )
9.下列有关溶液的说法中正确的是( )
A.向0.1 ml·L-1HF溶液中滴加NaOH溶液至中性,c(Na+) > c(F-)
B.pH=2的H2SO3溶液与pH=12的NaOH溶液以任意比例混合:
c(Na+)+c(H+)=c(OH-)+c()+2 c()
C.已知H2CO3:Ka1=4.5×10-7 Ka2=4.7×10-11 NH3·H2O:Kb=1.8×10-5则NH4HCO3溶液中c(H+) >c(OH-)
D.一定温度下将足量的AgCl分别放入下列物质中: ① 5ml水
② 10ml 0.1 ml·L-1的 MgCl2溶液 ③ 20ml 0.1 ml·L-1AgNO3溶液,则AgCl的溶解度由大到小的排列顺序①>②=③
10.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.溶液中=10−12的溶液:K+、AlO、CO、Na+
B.pH=7的溶液中:Cl-、Fe3+、、Na+
C.滴入甲基橙指示剂呈红色的溶液中:Na+、NH、ClO-、NO
D.由水电离产生的c(H+)=1×10-13 ml/L的溶液中:Na+、Ba2+、、Cl-
11.深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根离子腐蚀,其电化学腐蚀原理如下图所示,下列叙述正确的是( )
A.此铁管道发生的是吸氧腐蚀
B.输送暖气的管道也易发生此类腐蚀
C.在这种情况下,土壤的c(OH-)增大
D.若管道上刷富铜油漆可以延缓管道的腐蚀
12.下列说法正确的有几项( )
(1)AgCl难溶于水,故属于弱电解质
(2)氨水中存在NH3·H2O分子,故氨水属于弱电解质
(3)稀醋酸加水稀释,各离子浓度减小但是电离程度增大
(4) 用广泛pH试纸测定NaClO溶液的pH为12
(5)稀醋酸中加入CH3COONa固体,醋酸的电离程度减小,溶液导电能力增强
(6)对于0.1ml/L醋酸溶液,适当加热,溶液中的值增大
(7)将液面在8.20mL处的25mL碱式滴定管中的NaOH溶液全部放出,其体积为16.80mL
(8)中和滴定实验时,滴定管、锥形瓶均用待装溶液润洗
(9)将氯化钠溶液加热,溶液pH值将变小
A.2B.3C.4D.5
13.已知:pBa2+=-lgc(Ba2+),pKa=-lgKa。向20 mL 0.1 ml/L BaCl2溶液中滴加0.2 ml/L Na2CO3溶液的滴定曲线如图所示。下列描述错误的是( )
(常温下,H2CO3的电离常数pKa1=6.4,pKa2=10.3;Ksp(BaSO4) =1.1×10-10。)
A.在碳酸钠溶液中,Kh1(CO)=1.0×10-3.7
B.根据曲线数据计算可知Ksp(BaCO3)的数量级为10-9
C.相同条件下,若改为0.15 ml/L BaCl2溶液,反应终点F移到K点
D.相同条件下,若改为0.2 ml/L Na2SO4溶液,反应终点F移向H点
14.由γ˗羟基丁酸(HOCH2CH2CH2COOH)生成γ˗丁内酯( )的反应如下:HOCH2CH2CH2COOH +H2O。在25°C时,溶液中
γ˗羟基丁酸初始浓度为0.180ml/L,随着反应的进行,测得γ˗丁内酯的浓度随时间的变化如下表所示。下列说法中错误的是( )
A.在120min时,γ˗羟基丁酸的转化率为50%
B.在50~80min内,以γ˗丁内酯的浓度变化表示的反应速率为0.0007ml/(L·min)
C.在25°C时,该反应的平衡常数为K=2.75
D.为提高平衡时γ˗羟基丁酸的转化率,及时移出γ˗丁内酯平衡正向移动,加快反应速率
15.相同金属在其不同浓度盐溶液中可形成浓差电池(浓度大的氧化性强)。如下图所示装置是利用浓差电池电解溶液(a、b电极均为石墨电极),可以制得、、和。下列说法不正确的是( )
A.a电极的电极反应式为
B.电池放电过程中,电极上的电极反应式为
C.c、d离子交换膜依次为阴离子交换膜和阳离子交换膜
D.电池从开始工作到停止放电,电解池理论上可制得
二.非选择题(本题共4小题,共计55分)
16.(12分)已知和碳元素同主族的X元素位于元素周期表中的第一个长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们形成的化合物分子式是XY4 试回答:
(1)Y元素的基态原子的核外电子排布式为___________,X元素原子价层电子轨道表示式为___________。
(2)若X、Y两元素电负性分别为1.8和3.0,则XY4中X与Y之间的化学键为___________。(填“共价键”或“离子键”)
(3)该化合物的空间结构为___________形,分子为___________。(填“极性分子”或“非极性分子”)
(4)该化合物的沸点与SiCl4比较___________(填化学式)的高。
(5) X元素与C(碳)元素分别形成的简单氢化物稳定性_________(填化学式)更稳定。
(6)C(碳)元素与H(氢)元素形成的常见有机溶剂中C(碳)原子的轨道杂化方式为________。
(7)有两种元素与Y同一周期,其中一种元素有3个成单电子,另一种元素位于ⅥA族,则三种元素第一电离能由大到小顺序___________。
(用元素符号表示)
(8)与X元素同周期且成单电子最多的元素在周期表中的位置___________。
17.(14分) 已知NH3、NO、NO2都是有毒气体,必须经过严格处理,否则会污染空气。请回答下列问题:
(1)已知如下热化学方程式:
①N2(g)+O2 (g)=2NO(g) △H1=akJ/ml;
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H2=bkJ/ml
③2NO(g)+O2(g)=2NO2(g) △H3=ckJ/ml;
则4NH3(g)+7O2(g)=4NO2(g)+6H2O(g) △H=___________kJ/ml。
(2)工业合成NH3的反应解决了世界约三分之一的人粮食问题。已知N2(g)+3H2(g)2NH3(g),且该反应的v正=k正·c(N2)·c3(H2),
ν逆=k逆·c2(NH3),则反应N2(g)+H2(g)NH3(g)的平衡常数K=_______(用k正和k逆表示)。
(3)已知合成氨的反应升高温度平衡常数会减小,则该反应的正反应活化能E1和逆反应活化能E2的相对大小关系为:E1______E2。(填“>”、“<”或“=”)。
(4) 500℃时,向容积为2L的密闭容器中通入1mlN2和3mlH2,模拟合成氨的反应,容器内的压强随时间的变化如下表所示:
①达到平衡时N2的转化率为___________。
②用压强表示该反应的平衡常数Kp=___________(Kp等于平衡时生成物分压幂的乘积与反应物分压幂的乘积的比值,某物质的分压等于总压x该物质的物质的量分数)。
③随着反应的进行合成氨的正反应速率与NH3的体积分数的关系如下图所示,若降低温度再次达到平衡时,可能的点为___________(从点“A、B、C、D”中选择)
(5)H2NCOONH4是工业由氨气合成尿素的中间产物。在一定温度下、体积不变的密闭容器中加入H2NCOONH4,发生反应:H2NCOONH4(s)⇌2NH3(g)+CO2(g),能说明该反应达到平衡状态的是___________(填标号)。
A.混合气体的压强不变
B.混合气体的密度不变
C.混合气体的总物质的量不变
D.混合气体的平均相对分子质量不变
E.NH3的体积分数不变
18.(15分)甲醇是一种重要的化工原料和新型燃料。如图是甲醇燃料电池工作的示意图,连接电键K工作一段时间。
(1)甲中负极的电极反应式为_____________________。
(2)若丙中为铝,为石墨,溶液为稀,若能使铝的表面生成一层致密的氧化膜,则电极反应式为___________。
(3)若、、、均为石墨,溶液为饱和氯化钠溶液:
①工作一段时间后,断开电键K ,向乙中所得溶液加入后恰好使电解质溶液复原,则丙中电极上生成的气体标况下的体积__________。
②丙中为使两极产物不发生反应,可以在两极之间放置__________(“阴”或“阳”)离子交换膜。
(4)若把乙装置改为精炼铜装置(粗铜含、、、、等杂质),下列说法正确的是___________。
A.电解过程中,阳极减少的质量与阴极增加的质量相等
B.为粗铜,发生氧化反应
C.溶液的浓度保持不变
D.杂质都将以单质的形式沉淀到池底
(5)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有),实验室利用如图装置模拟该方法:
M电极通入物质___________(填 CH3OH或O2)
②电解池中阳极反应式为:___________;
转化为Cr3+的离子方程式为: _________________________________。
19. (14分)高纯二氧化锰广泛应用于电子工业。工业上以碳酸锰矿(主要成分为MnCO3,含少量SiO2、Al2O3、FeCO3、PbCO3等杂质)为原料制备高纯二氧化锰的流程图如下:
已知:常温下,溶液中金属离子开始沉淀和完全沉淀时的pH如下表所示:
回答下列问题:
(1)滤渣I的主要成分是_______(填化学式)
(2)“除杂”时需控制溶液的pH范围是_______
(3)常温下,Ksp[Mn(OH)2]=_______
(已知:当c(Mn2+)=10-5ml·L-1,认为Mn2+沉淀完全)
(4)MnO2含量测定:准确称取m克MnO2样品于锥形瓶中,加入25.00mL 0.2000ml·L-1草酸钠溶液和适量硫酸,加热将MnO2转化为MnSO4。待样品完全溶解后,冷却,立即用0.1000ml·L-1KMnO4溶液滴定过量的草酸钠溶液,消耗KMnO4溶液16.00mL
①0.1000ml·L-1KMnO4溶液装在_______滴定管(填“酸式”“碱式”)中
滴定终点的现象是__________________________________________
MnO2样品的纯度为_______(用含m的式子表示)
④如果滴定终点时滴定管尖嘴处留有气泡则使测定结果_______
(填“偏大”“偏小”“无影响”)化学键
C-H
C-O
H-O
H-H
键能/kJ/ml
406
351
465
436
实验操作
实验现象
实验结论
A
向锌和稀硫酸反应的试管中滴加几滴CuSO4溶液
气泡生成速率加快
CuSO4是该反应的催化剂
B
向含有酚酞的溶液中滴入溶液,观察溶液颜色的变化
溶液颜色变浅
证明溶液中存在水解平衡
C
取溶液,先后滴加3滴溶液和5滴溶液,观察沉淀情况
先生成白色沉淀,后变为黄色沉淀
>
D
已知H3BO3:Ka =5.8×10-10
H2CO3:K a1=4.5×10-7 K a2=4.7×10-11向饱和硼酸溶液中滴加碳酸钠溶液
无明显现象
H3BO3与碳酸钠不反应
t/min
21
50
80
100
120
160
220
∞
c/(ml/L)
0.024
0.050
0.071
0.081
0.090
0.104
0.116
0.132
时间/min
0
10
20
30
40
+∞
压强/MPa
20
17
15
13.2
11
11
金属离子
Fe3+
Al3+
Fe2+
Mn2+
开始沉淀pH
1.5
3.3
6.5
8.3
完全沉淀pH
3.7
5.2
9.7
10.0
辽宁省六校协作体2021-2022学年高三下学期期初考试化学试题(含答案): 这是一份辽宁省六校协作体2021-2022学年高三下学期期初考试化学试题(含答案),文件包含辽宁省六校协作体2021-2022学年高三下学期期初考试化学试题docx、化学答案docx等2份试卷配套教学资源,其中试卷共12页, 欢迎下载使用。
辽宁省六校协作体2021-2022学年高一下学期期初考试化学试题含答案: 这是一份辽宁省六校协作体2021-2022学年高一下学期期初考试化学试题含答案,文件包含辽宁省六校协作体2021-2022学年高一下学期期初考试化学试题无答案doc、化学答案doc等2份试卷配套教学资源,其中试卷共10页, 欢迎下载使用。
辽宁省六校协作体2021-2022学年高一下学期期初考试化学试题PDF版含答案: 这是一份辽宁省六校协作体2021-2022学年高一下学期期初考试化学试题PDF版含答案,文件包含辽宁省六校协作体2021-2022学年高一下学期期初考试化学试题PDF版无答案pdf、化学答案doc等2份试卷配套教学资源,其中试卷共8页, 欢迎下载使用。











