
【精准狂刷09】专题09化学反应速率与化学平衡
展开 专题09化学反应速率与化学平衡
类题1
化学反应速率的综合考查
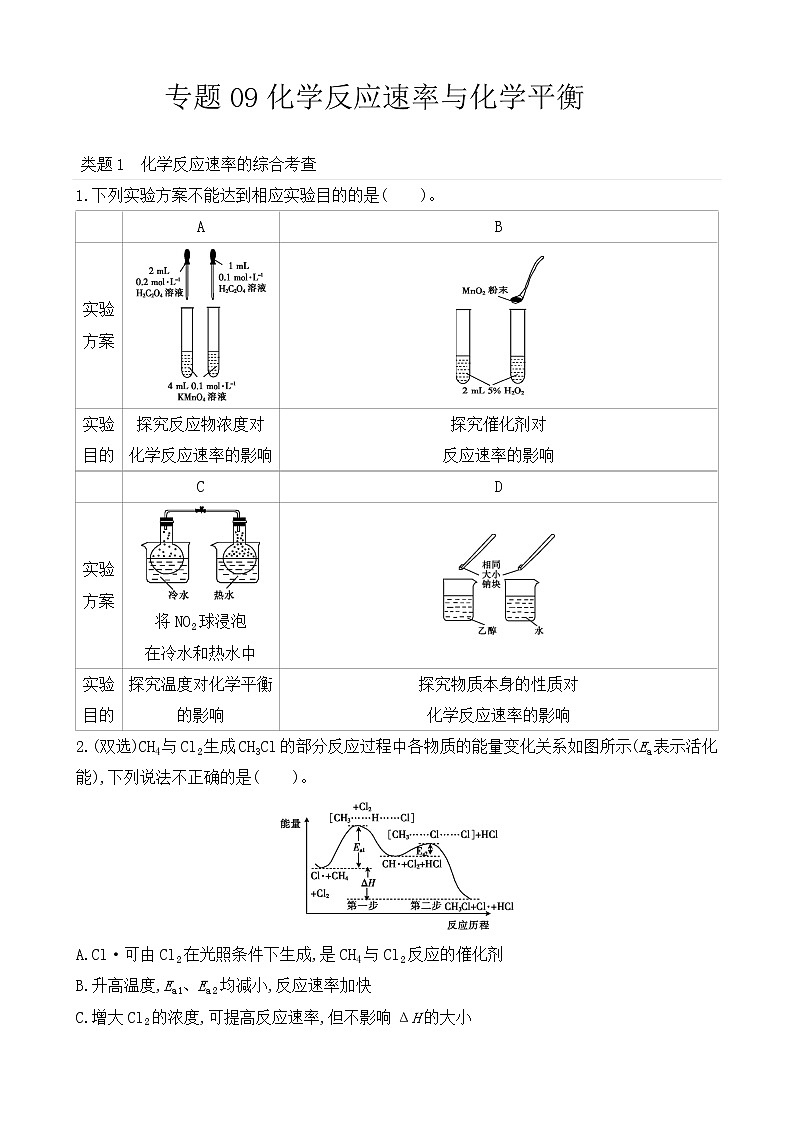
1.下列实验方案不能达到相应实验目的的是( )。
A
B
实验
方案
实验
目的
探究反应物浓度对
化学反应速率的影响
探究催化剂对
反应速率的影响
C
D
实验
方案
将NO2球浸泡
在冷水和热水中
实验
目的
探究温度对化学平衡的影响
探究物质本身的性质对
化学反应速率的影响
2.(双选)CH4与Cl2生成CH3Cl的部分反应过程中各物质的能量变化关系如图所示(Ea表示活化能),下列说法不正确的是( )。
A.Cl·可由Cl2在光照条件下生成,是CH4与Cl2反应的催化剂
B.升高温度,Ea1、Ea2均减小,反应速率加快
C.增大Cl2的浓度,可提高反应速率,但不影响ΔH的大小
D.第一步反应的速率小于第二步反应
类题2
化学平衡状态和化学平衡移动
3.可逆反应:2A(s)B(g)+C(g),在一定条件下的绝热刚性密闭容器中,起始时加入一定量的A。下列能判断此反应达到平衡状态的有( )。
①单位时间内生成2 mol A的同时生成1 mol B ②v(B)∶v(C)=1∶1 ③密闭容器中混合气体的平均摩尔质量不变 ④体系温度不再改变 ⑤B的体积分数不再改变 ⑥混合气体的压强不再改变
A.3个 B.4个 C.5个 D.6个
4.下列变化一定会引起平衡移动的是( )。
①反应速率的变化 ②浓度的变化 ③各组分百分含量的变化 ④平均相对分子质量的变化 ⑤颜色的变化 ⑥混合气体密度的变化 ⑦转化率的变化⑧温度的变化
A.①②⑥⑦⑧ B.②④⑤⑥⑧
C.②④⑤⑥⑦ D.③④⑦⑧
5.在催化剂作用下,用乙醇制乙烯,乙醇转化率和乙烯选择性(生成乙烯的物质的量与乙醇转化的物质的量的比值)随温度、乙醇进料量(单位:mL·min-1)的变化关系如图所示(保持其他条件相同)。
在410~440 ℃内,下列说法正确的是( )。
A.温度一定时,随着乙醇进料量的增大,乙醇转化率增大
B.温度一定时,随着乙醇进料量的增大,乙烯选择性增大
C.乙醇进料量一定时,随温度的升高,乙烯选择性一定增大
D.在一定条件下选择适当的催化剂,可大幅提高乙烯的产率
类题3
有关反应速率和平衡的图像
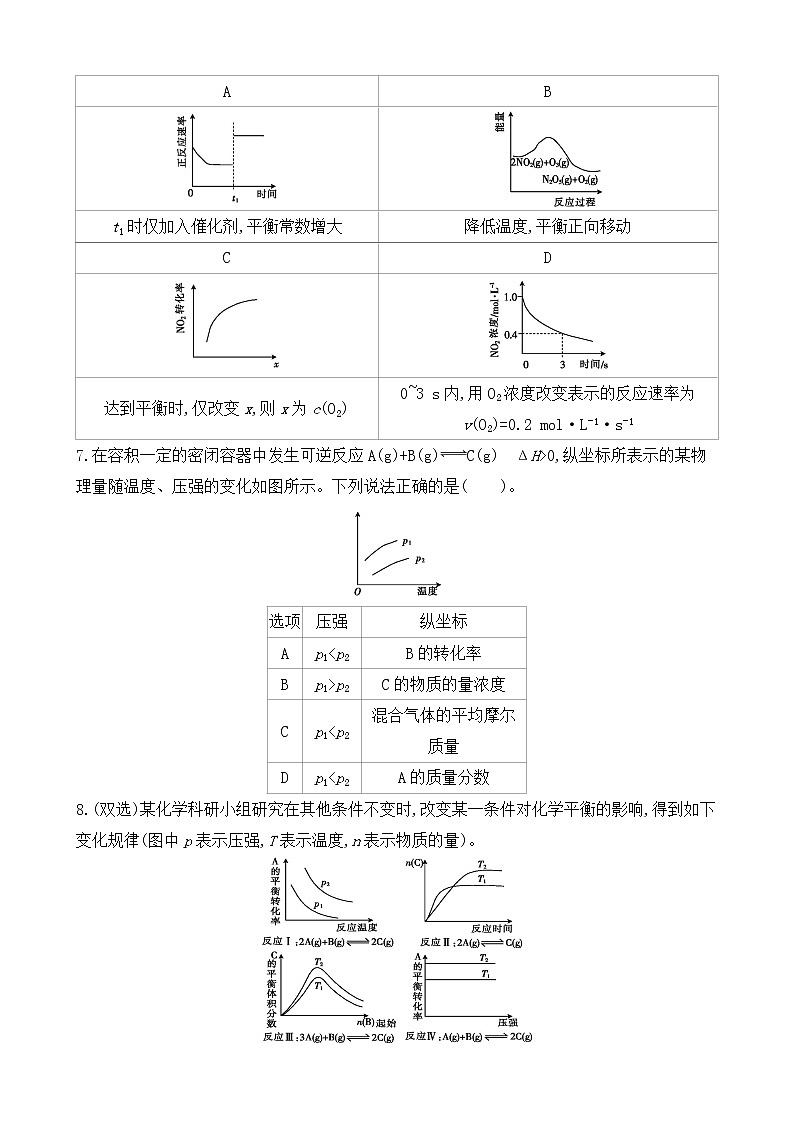
6. 臭氧具有仅次于氟的强氧化性,是理想的烟气脱硝试剂。在恒容密闭容器中,发生脱硝反应2NO2(g)+O3(g)N2O5(g)+O2(g)。下列相关图像的判断正确的是( )。
A
B
t1时仅加入催化剂,平衡常数增大
降低温度,平衡正向移动
C
D
达到平衡时,仅改变x,则x为c(O2)
0~3 s内,用O2浓度改变表示的反应速率为
v(O2)=0.2 mol·L-1·s-1
7.在容积一定的密闭容器中发生可逆反应A(g)+B(g)C(g) ΔH>0,纵坐标所表示的某物理量随温度、压强的变化如图所示。下列说法正确的是( )。
选项
压强
纵坐标
A
p1
B
p1>p2
C的物质的量浓度
C
p1
D
p1
8.(双选)某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量)。
根据以上规律判断,下列结论不正确的是( )。
A.反应Ⅰ:ΔH<0,p2
a b
c d
A.a图表示该反应为放热反应,随着反应的进行,K逐渐减小
B.b图中t1时刻,由于v(CO2)=v(NO),因此反应达到平衡
C.c图中若t1时刻纵坐标为13 ,则该温度下反应的平衡常数为19
D.d图表示当CO与NO的转化率之比为1∶2时,反应刚好平衡
类题4
与速率、平衡有关的计算
10.某兴趣小组模拟汽车尾气处理原理2NO(g)+2CO(g) N2(g)+2CO2(g),在一个1 L的密闭容器中设计两组实验。测得不同温度下CO2的平衡浓度如图所示,下列说法正确的是( )。
实验
Ⅰ
Ⅱ
起始NO加入量
0.1 mol
0.2 mol
起始CO加入量
0.1 mol
0.2 mol
A.该反应的正反应为吸热反应
B.相同温度下,实验Ⅰ的反应物转化率比实验Ⅱ的大
C.b点容器内的压强大于c点的2倍
D.a点温度下该反应的平衡常数为1600
11.某温度时,两个恒容密闭容器中仅发生反应2NO2(g) 2NO(g)+O2(g) ΔH > 0。实验测得:v正(NO2)=k正c2(NO2),v逆(NO)=k逆c2(NO)·c(O2),k正、k逆为化学反应速率常数,只受温度影响。
容器编号
起始浓度(mol·L-1)
平衡浓度(mol·L-1)
c(NO2)
c(NO)
c(O2)
c(O2)
Ⅰ
0.6
0
0
0.2
Ⅱ
0.6
0.1
0
下列说法正确的是( )。
A.Ⅰ中平衡时NO2的体积分数为20%
B.Ⅱ中达到平衡状态时,c(O2)=0.2 mol·L-1
C.该反应的化学平衡常数可表示为K=k正k逆
D.升高温度,该反应的化学平衡常数减小
12.(双选)已知:N2(g)+3H2(g)2NH3(g) ΔH<0。某温度下,向初始体积为2 L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中分别加入1 mol N2和2.8 mol H2,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示。下列说法不正确的是( )。
A.图中曲线c表示该反应在恒容绝热容器中进行
B.曲线b条件下该反应的平衡常数K=400
C.b容器中M点,v(正)>v(逆)
D催化剂能改变正、逆反应的活化能
13.向温度为300 ℃的2 L密闭容器中充入2 mol SO2和1 mol O2发生反应:2SO2(g)+O2(g)2SO3(g) ΔH<0,体系达到平衡状态后SO2的浓度为0.1 mol·L-1。下列说法正确的是( )。
A.该温度下反应的平衡常数K=1620
B.SO2和O2的平衡转化率之比为2∶1
C.平衡后保持温度和容器体积不变再充入SO3(g),平衡逆向移动且平衡常数减小
D.若不再向容器中加入任何物质,改变条件不可能使SO2的浓度达到1 mol·L-1
类题5
化学反应速率和平衡的综合应用
14. 一定温度下,在3个体积均为1.0 L的恒容密闭容器中发生反应:X(g)+3Y(g) 2Z(g),达到平衡时,测得数据如下。下列说法正确的是( )。
容器
温度/K
物质的起始浓度/mol·L-1
物质的平衡浓度/mol·L-1
c(X)
c(Y)
c(Z)
c(Z)
Ⅰ
200
0.10
0.30
0
0.020
Ⅱ
500
0.00
0.00
0.20
0.017
Ⅲ
200
0.20
0.60
0
A.该反应的正反应ΔH>0
B.达到平衡时,容器Ⅰ中反应物的转化率比容器Ⅲ中的大
C.达到平衡时,容器Ⅲ中c(X)小于容器Ⅱ中c(X)的两倍
D.达到平衡,容器Ⅱ所需时间比容器Ⅰ中的长
15.(双选)工业上制备合成气的工艺主要是水蒸气重整甲烷: CH4(g)+H2O(g)CO(g)+3H2(g)ΔH>0。在一定条件下,向体积为1 L的密闭容器中充入1 mol CH4(g)和1 mol H2O(g),测得 H2O(g)和 H2(g)的浓度随时间的变化曲线如图所示。下列说法不正确的是( )。
A.达到平衡时,CH4的转化率为75%
B.0~10 min内,v(CO)=0.025 mol·L-1·min -1
C.该反应的化学平衡常数K=0.1875
D.当CH4的消耗速率与H2的消耗速率相等时,反应达到平衡
16.工业合成氨反应:N2(g)+3H2(g) 2NH3(g)
ΔH=-92.0 kJ·mol-1。恒容时,体系中各物质浓度随时间的变化曲线如图所示。下列说法不正确的是( )。
A.25 min时采取的措施是降低温度或增大压强
B.将0.5 mol氮气、1.5 mol氢气置于1 L密闭容器中发生反应,放出的热量小于46 kJ
C.Ⅰ、Ⅱ、Ⅲ三个时间段平衡时平衡常数:KⅢ >KⅠ=KⅡ
D.为了增大合成氨的产率,可以通过将原料循环使用的同时及时分离出氨气来实现
【解析版】
类题1
化学反应速率的综合考查
1.下列实验方案不能达到相应实验目的的是( )。
A
B
实验
方案
实验
目的
探究反应物浓度对
化学反应速率的影响
探究催化剂对
反应速率的影响
C
D
实验
方案
将NO2球浸泡
在冷水和热水中
实验
目的
探究温度对化学平衡的影响
探究物质本身的性质对
化学反应速率的影响
【答案】A
【解析】两试管中加入H2C2O4溶液的体积不相同,A项错误;二氧化锰为反应的催化剂,可增大反应速率,达到实验目的,B项正确;存在平衡2NO2N2O4,NO2为红棕色气体,冷水和热水中NO2球中气体的颜色深浅不同,则该实验可探究温度对化学平衡的影响,C项正确;Na与水反应比Na与乙醇反应剧烈,则可比较物质本身性质对化学反应速率的影响,D项正确。
2.(双选)CH4与Cl2生成CH3Cl的部分反应过程中各物质的能量变化关系如图所示(Ea表示活化能),下列说法不正确的是( )。
A.Cl·可由Cl2在光照条件下生成,是CH4与Cl2反应的催化剂
B.升高温度,Ea1、Ea2均减小,反应速率加快
C.增大Cl2的浓度,可提高反应速率,但不影响ΔH的大小
D.第一步反应的速率小于第二步反应
【答案】AB
【解析】Cl·由Cl2在光照条件下生成,是CH4与Cl2反应的“中间体”,A项错误;Ea1、Ea2分别为第一步反应、第二步反应所需活化能,升高温度,反应所需活化能不变,即Ea1、Ea2不变,B项错误;Cl2是该反应的反应物,增大反应物的浓度,反应速率增大,但增大氯气的浓度不影响ΔH的大小,C项正确;第一步反应所需活化能Ea1大于第二步反应所需活化能Ea2,第一步反应单位体积内活化分子百分数低于第二步反应,故第二步反应速率更大,D项正确。
类题2
化学平衡状态和化学平衡移动
3.可逆反应:2A(s)B(g)+C(g),在一定条件下的绝热刚性密闭容器中,起始时加入一定量的A。下列能判断此反应达到平衡状态的有( )。
①单位时间内生成2 mol A的同时生成1 mol B ②v(B)∶v(C)=1∶1 ③密闭容器中混合气体的平均摩尔质量不变 ④体系温度不再改变 ⑤B的体积分数不再改变 ⑥混合气体的压强不再改变
A.3个 B.4个 C.5个 D.6个
【答案】A
【解析】①单位时间内生成2 mol A的同时生成1 mol B,说明正反应速率和逆反应速率相等,说明反应达到平衡;②v(B)∶ v(C)=1∶1,不能说明正逆反应速率相等,故不能说明反应达到平衡;③该反应中只有生成物是气体,且按方程式的比例生成,所以该混合气体的平均摩尔质量始终不变,故当密闭容器中混合气体的平均摩尔质量不变时不能说明反应达到平衡;④温度不变,能够判断反应达到平衡状态;⑤B的体积分数不再改变不能说明反应达到平衡;⑥混合气体的压强不再改变说明体系中气体的物质的量不变,能够判断反应达到平衡。
4.下列变化一定会引起平衡移动的是( )。
①反应速率的变化 ②浓度的变化 ③各组分百分含量的变化 ④平均相对分子质量的变化 ⑤颜色的变化 ⑥混合气体密度的变化 ⑦转化率的变化⑧温度的变化
A.①②⑥⑦⑧ B.②④⑤⑥⑧
C.②④⑤⑥⑦ D.③④⑦⑧
【答案】D
【解析】引起平衡移动的根本原因是化学反应速率的变化,但反应速率变化,平衡也可能不移动,主要看v正与v逆是否相等,若两者不相等,平衡肯定移动,如果v正、v逆同时改变,但始终保持相等,则平衡不移动,所以①不一定引起平衡移动;对于反应前后气体分子数不变的反应,缩小容器体积或增大压强,各气体浓度均增大,但平衡不移动,所以②不一定引起平衡移动;对于反应前后分子数不变的反应,颜色变化,平衡不一定发生移动,所以⑤不一定引起平衡移动;对于反应前后气体分子数不变的气体反应,缩小容器体积或者增大压强,混合气体密度增大,但平衡不移动,所以⑥不一定引起平衡移动;各组分百分含量的变化、平均相对分子质量的变化、转化率的变化、温度的变化都一定会引起平衡的移动,所以③④⑦⑧一定引起平衡的移动,D项正确。
5.在催化剂作用下,用乙醇制乙烯,乙醇转化率和乙烯选择性(生成乙烯的物质的量与乙醇转化的物质的量的比值)随温度、乙醇进料量(单位:mL·min-1)的变化关系如图所示(保持其他条件相同)。
在410~440 ℃内,下列说法正确的是( )。
A.温度一定时,随着乙醇进料量的增大,乙醇转化率增大
B.温度一定时,随着乙醇进料量的增大,乙烯选择性增大
C.乙醇进料量一定时,随温度的升高,乙烯选择性一定增大
D.在一定条件下选择适当的催化剂,可大幅提高乙烯的产率
【答案】B
【解析】根据图中曲线可知,当温度为410 ℃时,乙醇进料量为0.4 mL·min-1时,乙醇转化率为0.9,乙醇进料量为1.2 mL·min-1时,乙醇转化率为0.7,即随乙醇进料量的增大,乙醇转化率减小,A项错误。根据图中曲线可知,当温度为410 ℃时,乙醇进料量为0.4 mL·min-1时乙烯的选择性约为0.96,乙醇进料量为1.2 mL·min-1时乙烯的选择性为0.99,即随乙醇进料量增大,乙烯选择性增大,B项正确。根据图中曲线可知,乙醇进料量为0.4 mL·min-1且温度高于430 ℃时,乙烯选择性降低;乙醇进料量为1.2 mL·min-1且温度高于420 ℃时,乙烯选择性降低,C项错误。催化剂不改变产率,D项错误。
类题3
有关反应速率和平衡的图像
6. 臭氧具有仅次于氟的强氧化性,是理想的烟气脱硝试剂。在恒容密闭容器中,发生脱硝反应2NO2(g)+O3(g)N2O5(g)+O2(g)。下列相关图像的判断正确的是( )。
A
B
t1时仅加入催化剂,平衡常数增大
降低温度,平衡正向移动
C
D
达到平衡时,仅改变x,则x为c(O2)
0~3 s内,用O2浓度改变
表示的反应速率为
v(O2)=0.2 mol·L-1·s-1
【答案】B
【解析】催化剂会同等程度地改变正、逆反应速率,所以加入催化剂,平衡不移动,平衡常数也不变,A项错误;从能量变化的图像分析,该反应为放热反应,降低温度,平衡正向移动,B项正确;增大c(O2),平衡逆向移动,NO2的转化率降低,C项错误;v(NO2)=(1.0-0.4)mol·L-13 s=0.2 mol·L-1·s-1,v(O2)=v(NO2)/2=0.1 mol·L-1·s-1,D项错误。
7.在容积一定的密闭容器中发生可逆反应A(g)+B(g)C(g) ΔH>0,纵坐标所表示的某物理量随温度、压强的变化如图所示。下列说法正确的是( )。
选项
压强
纵坐标
A
p1
B
p1>p2
C的物质的量浓度
C
p1
D
p1
【答案】B
【解析】根据图像知,纵坐标所代表的物理量随温度的升高而增大,结合题述反应知,温度升高平衡向正反应方向移动,所以增大的物理量有B的转化率、C的物质的量浓度和混合气体的平均摩尔质量。p1
根据以上规律判断,下列结论不正确的是( )。
A.反应Ⅰ:ΔH<0,p2
【解析】由图分析可知,反应Ⅰ升温,A的平衡转化率降低,平衡逆向移动,而升温,平衡向吸热方向移动,所以反应是放热反应,ΔH<0;因为反应Ⅰ是体积减小的可逆反应,即压强越大,反应物的转化率越高,p2>p1, A项错误。反应Ⅱ中,根据先拐先平衡,数值大可知,T1>T2,B项错误。反应Ⅲ中,如果ΔH>0,T2>T1,则升高温度平衡向正反应方向移动,C的体积分数增大,如果ΔH<0,T2
a b
c d
A.a图表示该反应为放热反应,随着反应的进行,K逐渐减小
B.b图中t1时刻,由于v(CO2)=v(NO),因此反应达到平衡
C.c图中若t1时刻纵坐标为13 ,则该温度下反应的平衡常数为19
D.d图表示当CO与NO的转化率之比为1∶2时,反应刚好平衡
【答案】C
【解析】平衡常数只受温度影响,温度不变,K不变,A项错误;t1时刻二者浓度相等,但是浓度仍继续改变,故反应没有达到平衡状态,B项错误;由图c可知,t1时刻反应已达到平衡状态,根据纵坐标为13,设反应的NO物质的量为x mol,得(1-x)/(2-x)=1/3,求出x=0.5,将各物质的平衡浓度代入平衡常数表达式,得出K=(0.25×0.52)÷(1.52×0.52)=19,C项正确;根据反应的比例关系可知,二者的转化率之比一直为1∶2,D项错误。
类题4
与速率、平衡有关的计算
10.某兴趣小组模拟汽车尾气处理原理2NO(g)+2CO(g) N2(g)+2CO2(g),在一个1 L的密闭容器中设计两组实验。测得不同温度下CO2的平衡浓度如图所示,下列说法正确的是( )。
实验
Ⅰ
Ⅱ
起始NO加入量
0.1 mol
0.2 mol
起始CO加入量
0.1 mol
0.2 mol
A.该反应的正反应为吸热反应
B.相同温度下,实验Ⅰ的反应物转化率比实验Ⅱ的大
C.b点容器内的压强大于c点的2倍
D.a点温度下该反应的平衡常数为1600
【答案】D
【解析】由图可知,温度升高,二氧化碳的物质的量浓度减小,平衡逆向进行,说明2NO(g)+2CO(g) N2(g)+2CO2(g)的正反应为放热反应,A项错误;相同温度下,实验Ⅱ起始添加量是实验Ⅰ的2倍,压强大,加压平衡正向移动,转化率增大,B项错误;反应Ⅱ起始气体的物质的量为反应Ⅰ气体物质的量的2倍,反应Ⅱ可以看作在反应Ⅰ基础上起始量增大一倍,压强增大,平衡正向进行,b点容器内的压强小于c点的2倍,C项错误;a点时二氧化碳的平衡浓度为0.08 mol·L-1,则
2NO(g)+2CO(g)N2(g)+2CO2(g)
起始浓度(mol·L-1) 0.1 0.1 0 0
变化浓度(mol·L-1) 0.08 0.08 0.04 0.08
平衡浓度(mol·L-1) 0.02 0.02 0.04 0.08
K=0.082×0.040.022×0.022=1600,D项正确。
11.某温度时,两个恒容密闭容器中仅发生反应2NO2(g) 2NO(g)+O2(g) ΔH > 0。实验测得:v正(NO2)=k正c2(NO2),v逆(NO)=k逆c2(NO)·c(O2),k正、k逆为化学反应速率常数,只受温度影响。
容器编号
起始浓度(mol·L-1)
平衡浓度(mol·L-1)
c(NO2)
c(NO)
c(O2)
c(O2)
Ⅰ
0.6
0
0
0.2
Ⅱ
0.6
0.1
0
下列说法正确的是( )。
A.Ⅰ中平衡时NO2的体积分数为20%
B.Ⅱ中达到平衡状态时,c(O2)=0.2 mol·L-1
C.该反应的化学平衡常数可表示为K=k正k逆
D.升高温度,该反应的化学平衡常数减小
【答案】C
【解析】先用三段式法计算出实验Ⅰ中各组分的改变浓度和平衡浓度:
2NO22NO+O2
c(始)/mol·L-1 0.6 0 0
c(变)/mol·L-1 0.4 0.40.2
c(平)/mol·L-1 0.2 0.40.2
而实验Ⅱ相当于在实验Ⅰ基础上再加入NO,平衡会逆向移动,再判断各量的变化。由上述分析可知,Ⅰ中NO2的体积分数为25%,A项错误;实验Ⅰ中平衡时c(O2)=0.2 mol·L-1,实验Ⅱ相当于在实验Ⅰ基础上再加入NO,平衡会逆向移动,c(O2)<0.2 mol·L-1,B项错误;平衡时v正(NO2)=v逆(NO),即k正c2(NO2)=k逆c2(NO)·c(O2),得k正k逆=c2NO·cO2c2NO2=K,C项正确;该反应为吸热反应,升高温度,K增大,D项错误。
12.(双选)已知:N2(g)+3H2(g)2NH3(g) ΔH<0。某温度下,向初始体积为2 L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中分别加入1 mol N2和2.8 mol H2,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示。下列说法不正确的是( )。
A.图中曲线c表示该反应在恒容绝热容器中进行
B.曲线b条件下该反应的平衡常数K=400
C.b容器中M点,v(正)>v(逆)
D催化剂能改变正、逆反应的活化能
【答案】BC
【解析】以恒温恒容下该反应的平衡状态为参照物,恒温恒压下,相当于在此基础上增大压强,平衡向正反应方向移动,N2的转化率增大,恒容绝热相当于在参照物的基础上升温,即温度升高,平衡向吸热反应方向移动,即向逆反应方向移动,N2的转化率降低,所以a曲线代表恒温恒压,b曲线代表恒温恒容,c曲线代表恒容绝热,A项正确;b曲线N2的转化率为80%,平衡时N2、H2、NH3的物质的量分别为0.2 mol、0.4 mol、1.6 mol,容器的体积为2 L,该条件下该反应的平衡常数K=0.820.1×0.23=800,B项错误;b容器中M点时不是平衡状态,要达到平衡状态N2的转化率要降低,即平衡逆向移动,所以v正
A.该温度下反应的平衡常数K=1620
B.SO2和O2的平衡转化率之比为2∶1
C.平衡后保持温度和容器体积不变再充入SO3(g),平衡逆向移动且平衡常数减小
D.若不再向容器中加入任何物质,改变条件不可能使SO2的浓度达到1 mol·L-1
【答案】A
【解析】根据题中数据可算出SO2、O2、SO3的平衡浓度依次为0.1 mol·L-1、0.05 mol·L-1、0.9 mol·L-1,因此平衡常数K=0.920.12×0.05=1620,A项正确;SO2和O2的起始物质的量之比等于化学计量数之比,因此平衡转化率相等,B项错误;恒温、恒容下增大生成物浓度,平衡逆向移动,温度不变,因此平衡常数不变,C项错误;不加入任何物质的情况下压缩容器可能使SO2的浓度达到1 mol·L-1,D项错误。
类题5
化学反应速率和平衡的综合应用
14. 一定温度下,在3个体积均为1.0 L的恒容密闭容器中发生反应:X(g)+3Y(g) 2Z(g),达到平衡时,测得数据如下。下列说法正确的是( )。
容器
温度/K
物质的起始浓度/mol·L-1
物质的平衡浓度/mol·L-1
c(X)
c(Y)
c(Z)
c(Z)
Ⅰ
200
0.10
0.30
0
0.020
Ⅱ
500
0.00
0.00
0.20
0.017
Ⅲ
200
0.20
0.60
0
A.该反应的正反应ΔH>0
B.达到平衡时,容器Ⅰ中反应物的转化率比容器Ⅲ中的大
C.达到平衡时,容器Ⅲ中c(X)小于容器Ⅱ中c(X)的两倍
D.达到平衡,容器Ⅱ所需时间比容器Ⅰ中的长
【答案】C
【解析】分析Ⅰ和Ⅱ,对比数据知,反应开始时Ⅰ中加入的X、Y与Ⅱ中加入Z的物质的量相当,平衡时Z的浓度:Ⅰ>Ⅱ,且温度:Ⅰ<Ⅱ,即升高温度平衡逆向移动,该反应的正反应为放热反应,A项错误;Ⅲ相当于将两个容器Ⅰ的体积压缩在一起,该反应的正反应为气体体积减小的反应,增大压强平衡正向移动,达到平衡时,容器Ⅰ中反应物的转化率比容器Ⅲ中的小,B项错误;Ⅰ和Ⅲ对比,Ⅲ相当于增大压强,平衡正向移动,则Ⅲ中c(X)的浓度小于Ⅰ中的2倍,Ⅱ和Ⅰ对比,升温平衡逆向移动,c(X)浓度增大,故达到平衡时,容器Ⅲ中c(X)小于容器Ⅱ中c(X)的两倍,C项正确;温度:Ⅱ>Ⅰ,当其他条件不变时,升高温度反应速率加快,故达到平衡所需时间短,D项错误。
15.(双选)工业上制备合成气的工艺主要是水蒸气重整甲烷: CH4(g)+H2O(g)CO(g)+3H2(g)ΔH>0。在一定条件下,向体积为1 L的密闭容器中充入1 mol CH4(g)和1 mol H2O(g),测得 H2O(g)和 H2(g)的浓度随时间的变化曲线如图所示。下列说法不正确的是( )。
A.达到平衡时,CH4的转化率为75%
B.0~10 min内,v(CO)=0.025 mol·L-1·min -1
C.该反应的化学平衡常数K=0.1875
D.当CH4的消耗速率与H2的消耗速率相等时,反应达到平衡
【答案】AD
【解析】由图可知,10 min时反应达到平衡,平衡时水、氢气的浓度均为0.75 mol·L-1,则:
平衡时,甲烷的转化率为0.25mol·L-11mol·L-1×100%=25%,A项错误;0~10 min内,v(CO)=0.25mol·L-110min=0.025 mol·L-1·min-1,B项正确;平衡常数K=cCO·c3H2cCH4·cH2O=0.25×0.7530.75×0.75=0.1875,C项正确;同一物质的消耗速率与其生成速率相等时,反应达到平衡,由方程式可知当CH4(g)的消耗速率与H2(g)的消耗速率为1∶3时,反应达到平衡,D项错误。
16.工业合成氨反应:N2(g)+3H2(g) 2NH3(g)
ΔH=-92.0 kJ·mol-1。恒容时,体系中各物质浓度随时间的变化曲线如图所示。下列说法不正确的是( )。
A.25 min时采取的措施是降低温度或增大压强
B.将0.5 mol氮气、1.5 mol氢气置于1 L密闭容器中发生反应,放出的热量小于46 kJ
C.Ⅰ、Ⅱ、Ⅲ三个时间段平衡时平衡常数:KⅢ >KⅠ=KⅡ
D.为了增大合成氨的产率,可以通过将原料循环使用的同时及时分离出氨气来实现
【答案】A
【解析】25 min时N2和H2浓度降低,NH3浓度突然降低,采取的措施是将NH3从体系中分离,A项错误;该反应为可逆反应,物质不能100%转化,0.5 mol氮气、1.5 mol氢气置于1 L密闭容器中发生反应,放出的热量小于46 kJ,B项正确;25 min时改变的条件为将NH3从体系中分离,45 min时,组分浓度没有改变,之后N2和H2浓度降低,NH3浓度增大,说明反应向正反应方向移动,改变的条件是降温,平衡常数与温度相关,Ⅰ、Ⅱ温度相同,则KⅠ=KⅡ,该反应为放热反应,温度降低K增大,Ⅲ的平衡常数大,故KⅢ>KⅠ=KⅡ,C项正确;原料循环使用,可以提高利用率,分离出氨气,可提高反应物的转化率,D项正确。
【精准狂刷11】专题11化学实验: 这是一份【精准狂刷11】专题11化学实验,共19页。试卷主要包含了进行化学实验操作必须注意安全,下述实验方案能达到实验目的的是,已知等内容,欢迎下载使用。
【精准狂刷13】专题13有机化学基础: 这是一份【精准狂刷13】专题13有机化学基础,共14页。试卷主要包含了下列说法正确的是,下列关于有机物的叙述正确的是,下列说法不正确的是等内容,欢迎下载使用。
【精准狂刷07】专题07反应热: 这是一份【精准狂刷07】专题07反应热,共18页。试卷主要包含了下列叙述不正确的是,5 ml O2的总能量等内容,欢迎下载使用。













