



2022届高考化学二轮复习新高考非选择题的特征分析和备考建议-化学工艺流程课件
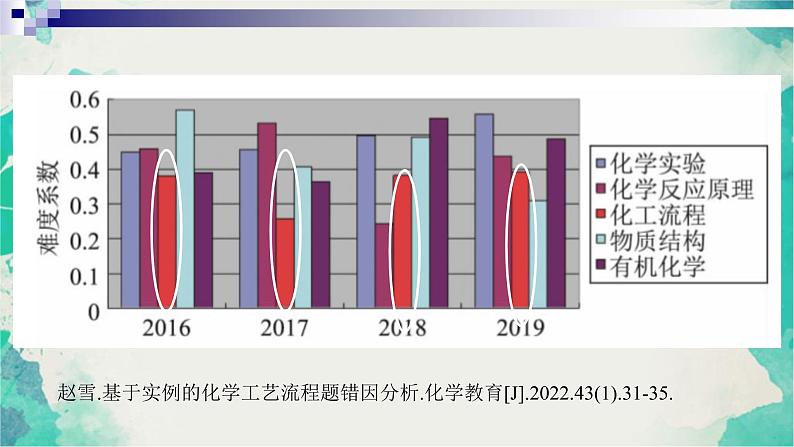
展开赵雪.基于实例的化学工艺流程题错因分析.化学教育[J](1).31-35.
化工流程试题的复习策略
2021湖北新高考特征分析
高考典型化工流程试题特征分析
2、充分尊重工业生产真实流程(形式、内容)
3、从元素化合物知识记忆转变为 元素化合物思维应用
4、综合性强对学生要求极高, 有利于实现高考的选拔性
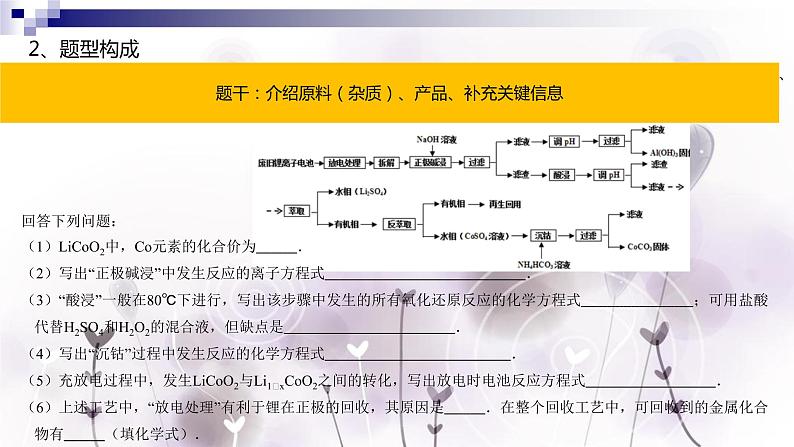
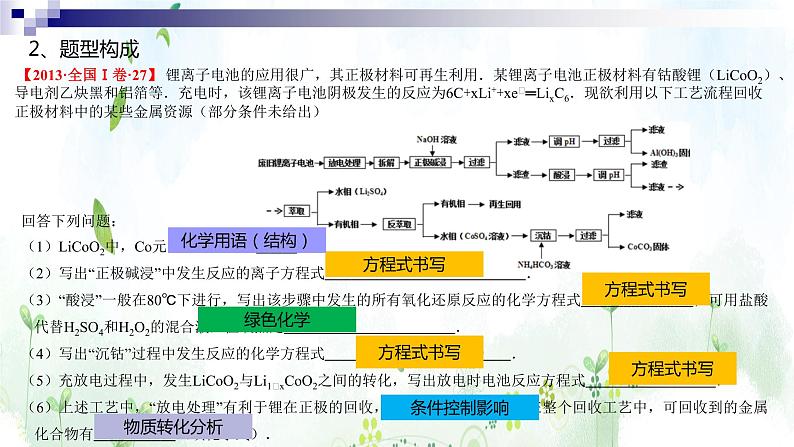
【2013·全国Ⅰ卷·27】 锂离子电池的应用很广,其正极材料可再生利用.某锂离子电池正极材料有钴酸锂(LiCO2)、导电剂乙炔黑和铝箔等.充电时,该锂离子电池阴极发生的反应为6C+xLi++xe﹣═LixC6.现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)
回答下列问题:(1)LiCO2中,C元素的化合价为 .(2)写出“正极碱浸”中发生反应的离子方程式 .(3)“酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式 ;可用盐酸代替H2SO4和H2O2的混合液,但缺点是 .(4)写出“沉钴”过程中发生反应的化学方程式 .(5)充放电过程中,发生LiCO2与Li1﹣xCO2之间的转化,写出放电时电池反应方程式 .(6)上述工艺中,“放电处理”有利于锂在正极的回收,其原因是 .在整个回收工艺中,可回收到的金属化合物有 (填化学式).
题干:介绍原料(杂质)、产品、补充关键信息
流程图:呈现核心过程、反应物产物、实验操作
回答下列问题:(1)LiCO2中,C元素的化合价为 .(2)写出“正极碱浸”中发生反应的离子方程式 .(3)“酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式 ;可用盐酸代替H2SO4和H2O2的混合液,但缺点是 .(4)写出“沉钴”过程中发生反应的化学方程式 .(5)充放电过程中,发生LiCO2与Li1﹣xCO2之间的转化,写出放电时电池反应方程式 .(6)上述工艺中,“放电处理”有利于锂在正极的回收,其原因是 .在整个回收工艺中,可回收到的金属化合物有 (填化学式).
(3)“酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式 ;可用盐酸代替H2SO4和H2O2的混合液,但缺点是 .
粉碎 灼烧 调pH 控温 浸取 过滤 萃取 结晶 电解…
方程式的书写杂质的去除产物的确定
原料循环纯度计算流程评价
基础实验热力学(程度)动力学(快慢)
实验操作条件控制化学计算
【2021·湖北省模拟·19】某化学兴趣小组通过查阅文献,设计了从某厂阳极泥(成分为Cu、Ag2Se、Au、Pt)中回收贵重金属的工艺,其流程如下图所示。
回答下列问题:(1)写出“焙烧”时,生成SeO2的化学反应方程式_____________________。(2)“滤液”中的金属阳离子有_____________ ;“酸浸氧化”中通入氧气的目的是_______、________。(3)“酸浸”时Pt、Au分别转化为[PtCl6]2-、[AuCl4]-,写出Au溶解的离子方程式____________________。(4)可从“有机层”回收的金属是___________。实验室“萃取分液”的玻璃仪器有_____、______。
(5)电解NH4[Au(SO3)2]溶液回收Au的阴极反应式为__________。
回答下列问题:(1)写出“焙烧”时,生成SeO2的化学反应方程式_____________________。(2)“滤液”中的金属阳离子有_______;“酸浸氧化”中通入氧气的目的是_______、________。(3)“酸浸”时Pt、Au分别转化为[PtCl6]2-、[AuCl4]-,写出Au溶解的离子方程式_____。(4)可从“有机层”回收的金属是____________。实验室“萃取分液”的玻璃仪器有_____、______。
回答下列问题:(1)写出“焙烧”时,生成SeO2的化学反应方程式_____________________。(2)“滤液”中的金属阳离子有_______;“酸浸氧化”中通入氧气的目的是_______、________。(3)“酸浸”时Pt、Au分别转化为[PtCl6]2-、[AuCl4]-,写出Au溶解的离子方程式_____。(4)可从“有机层”回收的金属是____。实验室“萃取分液”的玻璃仪器有_____、______。
回答下列问题:(1)写出“焙烧”时,生成SeO2的化学反应方程式_____________________。(2)“滤液”中的金属阳离子有_______;“酸浸氧化”中通入氧气的目的是_______、________。(3)“酸浸”时Pt、Au分别转化为[PtCl6]2-、[AuCl4]-,写出Au溶解的离子方程式_____。(4)可从“有机层”回收的金属是___________。实验室“萃取分液”的玻璃仪器有_____、______。
(2)“酸浸氧化”中通入氧气的目的是_____________________、_______________
姜艳秋 . 化学教学中提升高中生 SOLO 认知层次的研究 [D]. 苏州 : 苏州大学 ,2017.
SOLO分类评价理论指导下的化学学科能力水平划分参考标准
(2)“酸浸氧化”中通入氧气的目的是__________、__________
提高硝酸利用率避免NO污染环境
【2021·湖北省高考·16】废旧太阳能电池CIGS具有较高的回收利用价值,其主要组成为。某探究小组回收处理流程如下:
(1)硒(Se)与硫为同族元素,Se的最外层电子数为_____________;镓(Ga)和铟(In)位于周期表第三主族,中Cu的化合价为___________________。(2)“酸浸氧化”发生的主要氧化还原反应的化学方程式为_______________。
(4)“滤渣”与SOCl2混合前需要洗涤、干燥,检验滤渣中SO42- 是否洗净的试剂是____________________;“回流过滤”中SOCl2的作用是将氢氧化物转化为氯化物和____________________。(5)“高温气相沉积”过程中发生的化学反应方程式为_____________________。
基于高考评价体系的分析
Kb(NH3·H2O) Ksp[Ga(OH)3]
2021年湖北化工流程试题命题特点
方程式书写物质转化分析条件控制化学计算绿色化学
素养要求更高(证据意识)
化工流程试题的复习建议
样本数:286786份
针对学生困惑的复习建议
元素化合物化学原理实验操作
模型认知证据推理科学态度
1、强化教材化工生产过程的理解
【2019-全国Ⅰ-26】硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:
(3)将溶液pH调节到3.5,目的是_________________________________________
2、建立条件控制类“思维模型”
【2015-全国Ⅰ-27】硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5•H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:
(3)“净化除杂”需先加H2O2溶液,作用是 。然后在调节溶液的pH约为5,目的是 。
【2020-全国Ⅲ-26】某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):
(4) 如果“转化”后的溶液中Ni2+浓度为1.0 ml·L−1,则“调pH”应控制的pH范围是______________。
【2021-山东卷-17】工业上以铬铁矿(FeCr2O4,含Al、Si氧化物等杂质)为主要原料制备红矾钠(Na2Cr2O7•2H2O)的工艺流程如图。回答下列问题
(2)中和时pH的理论范围为___________________;酸化的目的是______
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
【2021-山东卷-17】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 ml·L−1]形成氢氧化物沉淀的pH范围如下:
【2021-全国乙-26】磁选后的炼铁高钛炉渣,主要成分有TiO2 、 SiO2 、 Al2O3 、 MgO 、 CaO以及少量Fe2O3 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
(4)“水浸渣”在160℃“酸溶”最适合的酸是____________________________
回答下列问题:(3)“酸浸” 可用盐酸代替H2SO4和H2O2的混合液,但缺点是___________________
主要成分,量多形成饱和溶液
杂质,量少形成不饱和溶液
蒸发结晶(至有大量晶体析出)趁热过滤、洗涤、干燥
案例:物质的分离与提纯-结晶
蒸发浓缩(至有晶膜出现)冷却结晶、过滤、洗涤、干燥
苯甲酸(多)难溶A(少)易溶B(少)
苯甲酸(大)杂质(较小)
MgCl2·6H2O晶体
边滴加浓盐酸边蒸发浓缩,冷却结晶,过滤
34 ℃以上蒸发结晶、趁热过滤
34 ℃以下蒸发浓缩、冷却结晶
NH4ClO4(主)NaCl(次)
NH4ClO4溶解度随温度变化大
蒸发浓缩、冷却结晶过滤、冰水洗涤
3、认识陌生反应的思维模型
(1)元素化合物价态类别认识模型
【2016-全国Ⅰ-28】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下
(1)NaClO2中Cl的化合价为 。(2)写出“反应”步骤中生成ClO2的化学方程式 。(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为 、 。“电解”中阴极反应的主要产物是 。(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2.此吸收反应中,氧化剂与还原剂的物质的量之比为 ,该反应中氧化产物是 。(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为 。(计算结果保留两位小数)
【2018-全国卷Ⅰ-26】焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。回答下列问题:(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式__________。(2)利用烟道气中的SO2生产Na2S2O5的工艺为:
①pH=4.1时,Ⅰ中为__________溶液(写化学式)。②工艺中加入Na2CO3固体、并再次充入SO2的目的是__________。(3)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。阳极的电极反应式为_____________。电解后,__________室的NaHSO3浓度增加。将该室溶液进行结晶脱水,可得到Na2S2O5。
(4)Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.01000 ml·L−1的碘标准液滴定至终点,消耗10.00 mL。滴定反应的离子方程式为_____________,该样品中Na2S2O5的残留量为____________g·L−1(以SO2计)。
类比SO2与I2的反应结果
【2021-辽宁卷-16】
【2021-全国卷乙-26】
【2021-湖北适应-16】
三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:(1)SiHCl3在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成(HSiO)2O等,写出该反应的化学方程式________。
【2018-全国卷Ⅲ-28】
Mg3(OH)4Cl2
【2019-全国卷Ⅰ-26】硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工业。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下
NH4++AlO2-+H2O===NH3↑+Al(OH) 3↓
(3)酸浸时,磷精矿中Ca5(PO4)3F所含氟转化为HF,并进一步转化为SiF4除去。写出生成HF的化学方程式:__________________________。
【2018-北京-9】磷精矿湿法制备磷酸的一种工艺流程如下:
【2018-全国Ⅰ-27】硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5 · H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示
(1)写出Mg2B2O5 · H2O与硫酸反应的化学方程式_______________________________
【2018-全国Ⅰ-27】硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5•H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示
【2013-全国Ⅰ-26】
【2019-全国Ⅲ-26】
【2019-全国Ⅰ-26】
(III)Ca2++2ClO-+ CO2+ H2O=2HClO+CaCO3↓
试通过相关常数计算,说明分别向Ca(ClO)2、NaClO溶液通入少量CO2的离子反应方程式
(II)2ClO-+ CO2+ H2O=2HClO+CO32 -
(I)ClO-+ CO2+ H2O=HClO+HCO3 -
①Fe2O3、Al2O3 会溶解
除去过量酸,更方便Mg2+沉淀
【2015-全国卷Ⅰ-27】硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5 · H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:
回答下列问题:(1)写出Mg2B2O5 · H2O与硫酸反应的化学方程式 。为提高浸出速率,除适当增加硫酸浓度外,还可采 取的措施有 (写出两条)。(2)利用 的磁性,可将其从“浸渣”中分离。
H2V10O28 4- (aq)
R4H2V10O28 (s)
H2V10O284- (aq)
解构文献,整理素材,整理优化
方程式的书写除杂原理产物的确定
《普通高中化学课程标准》 (2017年版) 《化学教学中提升高中生 SOLO 认知层次的研究 》姜艳秋,苏州大学 ,2017.《高考化学工艺流程题命题探讨》——《测量评价》2019.10《高考化学工艺流程题统计分析及教学策略研究》——湖南师范大学硕士论文 2019.5 《基于化学核心素养的高中学业水平考试命题策略》——《课程 教材 教法》2018.5《真实情景的高考化学命题理论与实践》——《中学化学教学参考》2019.5《基于高考评价体系的化学试题研究_以2019年高考化学试题为例》——考试与招生 2020.2
化学教学研究永远在路上,我只是一个成长中的小学生
2024届高三化学高考备考一轮复习专题 化工流程题大题分析及备考建议课件: 这是一份2024届高三化学高考备考一轮复习专题 化工流程题大题分析及备考建议课件,共3页。PPT课件主要包含了注重基础,图像推理分析能力,备考策略等内容,欢迎下载使用。
2024届高三化学高考备考一轮复习工艺流程专题课件: 这是一份2024届高三化学高考备考一轮复习工艺流程专题课件,共3页。PPT课件主要包含了思维模型和方法模型,真题演练,产品分离提纯,蒸发浓缩趁热过滤,条件控制,温度控制,高考真题·导向等内容,欢迎下载使用。
2024届高三化学一轮复习 2023年高考试题分析与备考策略——化学工艺流程模块课件: 这是一份2024届高三化学一轮复习 2023年高考试题分析与备考策略——化学工艺流程模块课件,共3页。PPT课件主要包含了命题内容,命题角度,考什么,真题示例,试题结构,结构模型,思维模型,三条思维主线,思维建模,工业流程等内容,欢迎下载使用。












