






必修 第一册第3节 氮的循环示范课课件ppt
展开玻尔是丹麦著名的物理学家,曾获得过诺贝尔奖。第二次世界大战中,玻尔被迫离开将要被德国占领的祖国。为了表示他一定要返回祖国的决心,他决定将诺贝尔金质奖章溶解在王水里,装于玻璃瓶中。后来,纳粹分子窜进玻尔的住宅,那瓶溶有奖章的溶液就在眼皮底下,他们却一无所知。战争结束后,玻尔又从溶液中还原提取出金,并重新铸成奖章。你知道王水的成分吗?硝酸能将金质奖章溶解吗?
1. 结合真实情境并通过实验探究,了解硝酸的主要性质,认识硝酸在工业和农业生产中的重要意义。2.结合真实情境,认识氮的化合物在农业生产中的应用和对生态环境的影响。
1.宏观辩识与微观探析:能从物质类别和化合价角度预测硝酸的性质及转化。2.科学探究与创新意识:能根据教材中给出的硝酸的性质的探究问题,设计简单的实验方案,完成操作,观察现象,对实验现象做出解释。3.科学态度与社会责任:能主动关心与氮的氧化物有关的环境保护等社会热点问题.形成与环境和谐共处,合理利用自然资源的观念。
(1)纯硝酸是无色、易挥发、有刺激性气味的液体。(2)硝酸能以任意比溶于水。(3)质量分数为69%的硝酸为浓硝酸;质量分数为95%以上的硝酸为发烟硝酸。
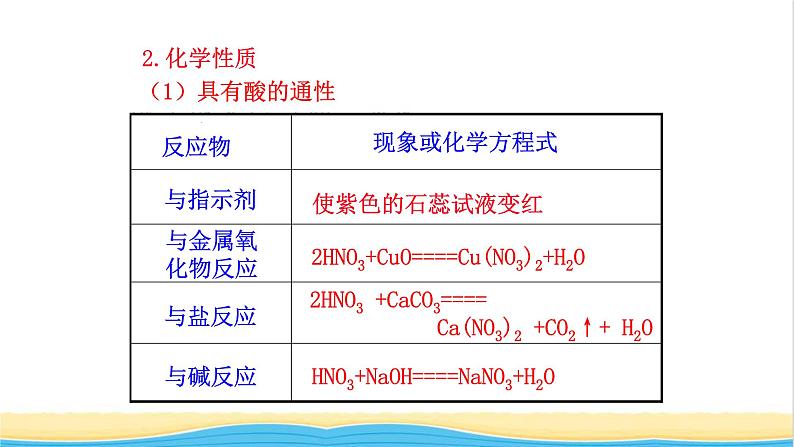
2HNO3+CuO====Cu(NO3)2+H2O
2HNO3 +CaCO3==== Ca(NO3)2 +CO2↑+ H2O
HNO3+NaOH====NaNO3+H2O
1.浓硝酸为什么常呈黄色?
阴凉、避光(棕色试剂瓶)
硝酸分解产生的二氧化氮气体溶于硝酸而使硝酸呈黄色
(3)强氧化性: ①与金属反应(除Au和Pt外)
3Cu +8HNO3(稀)==== 3Cu(NO3)2+2NO↑+4H2OCu +4HNO3(浓)==== Cu(NO3)2+2NO2↑+2H2O
现象:浓硝酸与铜常温下即能反应,生成红棕色气体和蓝色溶液。稀硝酸与铜反应,生成无色气体和蓝色溶液;生成的气体与空气接触后,变为红棕色气体。
2.实验室能否用硝酸与活泼的金属制取氢气?
活泼金属不能与氧化性酸(硝酸)反应来制取氢气
1.试写出铜与浓、稀硝酸反应的离子方程式
Cu +4H++2NO3-(浓)==== Cu2++2NO2↑+2H2O3Cu +8H++2NO3-(稀)==== 3Cu2++2NO↑+4H2O
【问题探究】一定量的浓硝酸里加入过量铜会发生 哪些变化?
反应停止后,如果在溶液中再加入足量稀盐酸会出现什么情况?
溶液中存在NO3-,它遇到H+后,会继续氧化铜,当然此时NO3-/H+的溶度较稀。
3Cu + 8H+ + 2NO3- ==== 3Cu2+ +2NO↑+4H2O
将1.92g铜粉与一定量浓硝酸反应,当铜粉完全作用时,收集到气体为1.12L(标准状况)则所消耗的硝酸的物质的量是( )
3Cu+8HNO3(稀)== 3Cu(NO3)2+2NO↑+4H2O
Cu+4HNO3(浓)== Cu(NO3)2+2NO2↑+2H2O
n(HNO3)=4×0.0225ml+8/3×0.0075ml=0.11ml
1.92g铜粉 n(Cu)=0.03ml,气体为1.12L n(气体)=0.05ml
元素守恒法:n(HNO3)=0.05ml+0.06ml=0.11ml
1.92g铜粉,气体为1.12L
Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)== 3Cu(NO3)2+2NO↑+4H2O
n (HNO3)== n(氧化性) + n(酸性)
n(氧化性)= 1.12L/22.4L·ml-1=0.05ml
n(酸性) = 2×1.92g/64g·ml =0.06ml
【方法总结】关于硝酸与金属反应的计算方法(1)电子守恒法硝酸与金属反应属于氧化还原反应,氮原子得到的电子总数等于金属原子失去的电子总数。(2)原子守恒法硝酸与金属反应时,反应前HNO3中的NO3-部分仍以NO3-的形式存在,一部分转化为还原产物,这两部分中N的物质的量之和与反应消耗的HNO3中N的物质的量相等。(3)利用离子方程式计算硝酸与硫酸混合液跟金属的反应,当金属足量时,不能用HNO3与金属反应的化学方程式计算,应用离子方程式计算,因为生成的硝酸盐中的NO3-与硫酸电离出的H+仍能继续与金属反应,如:3Cu+8H++2NO3-===3Cu2++2NO↑+4H2O。
③钝化常温下,浓硝酸能使Fe、Al表面形成致密的氧化膜而钝化。
④与还原性化合物反应如与S2-、H2S、SO2、SO32-、Fe2+、I- 等反应。
二、人类活动对氮循环和环境的影响
水体富营养化——含氮、磷化合物的排放
1.我国清代《本草纲目拾遗》中记载无机药物335种,其中“强水”条目下写道:“性最烈,能蚀五金……其水甚强,五金八石皆能穿滴,惟玻璃可盛。”这里的“强水”是指 ( )A.氨水 B.硝酸 C.醋 D.卤水
2.下列对于硝酸的认识,正确的是( )A.硝酸露置于空气中,溶液浓度会增大B.铜与硝酸的反应属于置换反应C.硝酸可氧化Fe2+ D.铁或铝与浓硝酸不反应
4.下列与氮循环无关的生态环境问题是( )A.光化学烟雾 B.白色污染C.水体富营养化 D.酸雨
3.长期放置的浓硝酸常显黄色,消除其黄色最好的方法是( )A.在光亮处放置 B.通入适量的空气C.加入足量水 D.加入漂白粉
5.(双选)将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是( )A.反应速率:两者相同B.消耗硝酸的物质的量:前者多,后者少C.反应生成气体的颜色:前者深,后者浅D.反应中转移的电子总数:前者多,后者少
6.等质量的下列物质与足量稀硝酸反应,放出NO物质的量最多的是( )A.FeO B.Fe2O3 C.FeSO4 D.Fe3O4
7.(2019·江苏高考节选)N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。 (1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为———————————————————。 (2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为:NO+NO2+2OH-==2NO2-+H2O;2NO2+2OH-==NO2-+NO3-+H2O。 吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是 (填化学式);吸收后排放的尾气中含量较高的氮氧化物是 (填化学式)。 (3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气。
2NH3+2O2 N2O + 3H2O
必修 第一册第3节 氮的循环多媒体教学课件ppt: 这是一份必修 第一册第3节 氮的循环多媒体教学课件ppt,共58页。PPT课件主要包含了分点突破1,硝酸的性质,分点突破2,分点突破3等内容,欢迎下载使用。
2021学年第3章 物质的性质与转化第3节 氮的循环习题ppt课件: 这是一份2021学年第3章 物质的性质与转化第3节 氮的循环习题ppt课件,文件包含鲁科版高中化学必修第一册第3章物质的性质与转化第3节氮的循环第3课时硝酸人类活动对氮循环和环境的影响课件ppt、鲁科版高中化学必修第一册第3章物质的性质与转化第3节氮的循环第3课时硝酸人类活动对氮循环和环境的影响课后习题含答案doc等2份课件配套教学资源,其中PPT共40页, 欢迎下载使用。
鲁科版 (2019)必修 第一册第3节 氮的循环教学演示ppt课件: 这是一份鲁科版 (2019)必修 第一册第3节 氮的循环教学演示ppt课件,共60页。PPT课件主要包含了NO1,光化学烟雾,NO2,学习任务1学习任务2,NO3等内容,欢迎下载使用。













