

所属成套资源:2022届高考化学一轮复习常考题型练习含解析
2022届高考化学一轮复习常考题型28陌生情景下金属化合物制备流程题含解析
展开这是一份2022届高考化学一轮复习常考题型28陌生情景下金属化合物制备流程题含解析,共24页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
一、单选题(共20题)
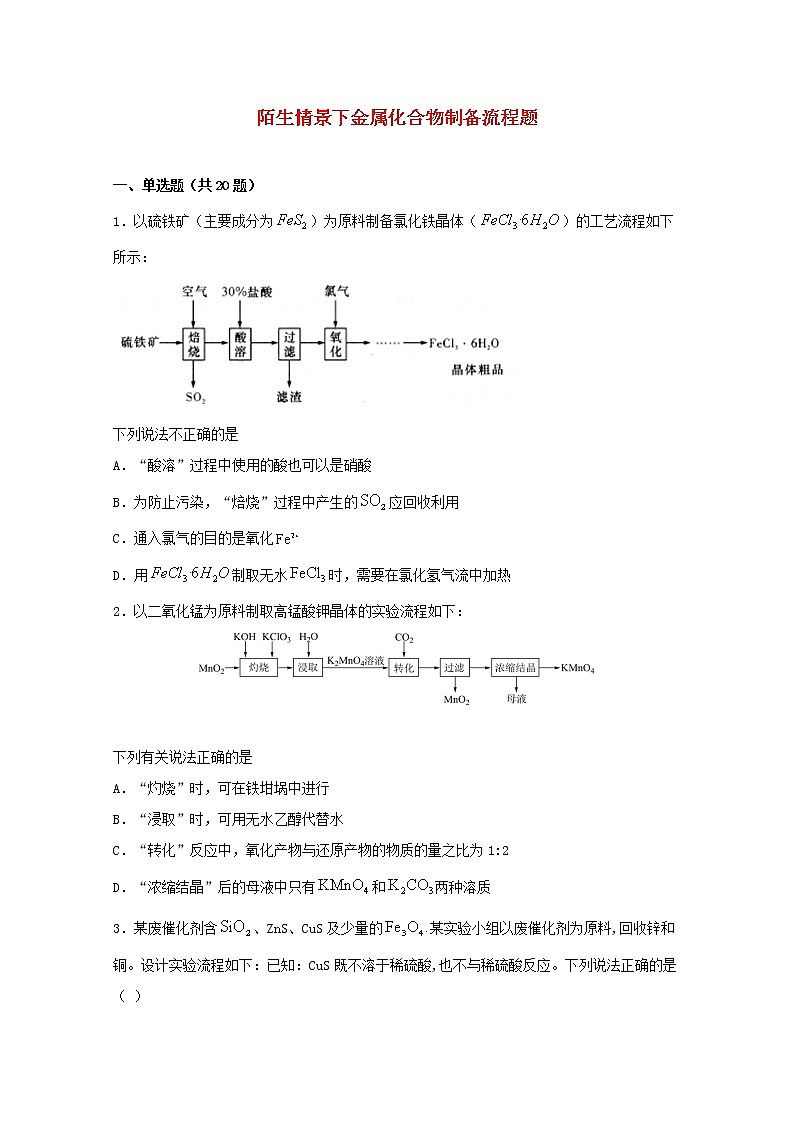
1.以硫铁矿(主要成分为)为原料制备氯化铁晶体()的工艺流程如下所示:
下列说法不正确的是
A.“酸溶”过程中使用的酸也可以是硝酸
B.为防止污染,“焙烧”过程中产生的应回收利用
C.通入氯气的目的是氧化
D.用制取无水时,需要在氯化氢气流中加热
2.以二氧化锰为原料制取高锰酸钾晶体的实验流程如下:
下列有关说法正确的是
A.“灼烧”时,可在铁坩埚中进行
B.“浸取”时,可用无水乙醇代替水
C.“转化”反应中,氧化产物与还原产物的物质的量之比为1:2
D.“浓缩结晶”后的母液中只有和两种溶质
3.某废催化剂含、ZnS、CuS及少量的某实验小组以废催化剂为原料,回收锌和铜。设计实验流程如下:已知:CuS既不溶于稀硫酸,也不与稀硫酸反应。下列说法正确的是( )
A.滤液1中是否含有,可以选用KSCN和新制的氯水检验
B.步骤②操作中,先加 ,在不断搅拌下,再加入
C.滤渣1成分是和CuS,滤渣2成分一定是
D.步骤①操作中,生成的气体需用NaOH溶液或溶液吸收
4.工业上以软锰矿(主要成分是MnO2,还含有少量SiO2、Fe2O3)为主要原料制备高性能的磁性材料碳酸猛(MnCO3)。其工业流程如图所示,下列说法错误的是
A.滤渣I可用于制造光导纤维、滤渣II可用于制作颜料
B.“浸锰”过程MnO2参与反应的化学方程式为MnO2十SO2=MnSO4
C.“沉锰”时,反应体系的温度越高,越有利于生成MnCO3
D.检验高纯碳酸锰是否洗涤干净,可选用BaCl2溶液和盐酸试剂
5.某工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为减少污染并变废为宝,工厂计划从该废水中回收FeSO4和金属Cu。根据流程图,下列说法不正确的是
A.①②操作均为过滤,但D、E溶液成分不完全相同
B.C可以为稀硫酸,也可以是稀盐酸
C.操作③采用冷却结晶,说明硫酸亚铁晶体的溶解度随温度变化有一定变化
D.A为足量铁粉,其反应的离子方程式为:Fe+Cu2+=Fe2++Cu
6.式硫酸铁[]是用于污水处理的新型高效絮凝剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图。下列叙述错误的是
A.沉淀A为
B.合理处理废铁屑有利于保护环境和资源再利用
C.加入的作用是将溶液中的转化为
D.溶液B的pH越大越好,有利于碱式硫酸铁的生成
7.工业上制备过碳酸钠(2Na2CO3·3H2O2)的一种流程如下:
下列说法不正确的是
A.可以用MnO2作稳定剂
B.“结晶”时,加入NaCl的主要作用是增大产品的产率
C.“分离”所用的主要玻璃仪器为烧杯、漏斗、玻璃棒
D.2Na2CO3·3H2O2受热分解属于氧化还原反应
8.对下列流程有关判断正确的是
A.流程中涉及的反应均为非氧化还原反应
B.反应②产生的阴离子主要为CO32-
C.实验室中完成反应③应在蒸发皿中进行
D.反应①中发生的主要反应为:Al2O3+2OH-=2AlO2-+H2O
9.氮及其化合物在生产中应用广泛。工业上以氨为原料制硝酸,氨催化氧化的热化学方程式为。硝酸工业尾气中的、等大气污染物,可用碱性溶液吸收处理。实验室模拟工业上纯碱溶液吸收,并制备亚硝酸钠(原理为),流程如下图所示。下列说法不正确的是
A.用铜粉替代铜片可加快“制气”速率
B.控制的通入速率,可提高“吸收”效率
C.“结晶”后的操作通常是过滤、洗涤、干燥
D.利用“焰色反应”可检验中是否含
10.碲被誉为现代工业的维生素,主要用于石油裂化的催化剂,还可添加到钢材中增加其延展性等。某工艺从精炼铜的阳极泥(含有Cu2Te、Au、Ag等)中回收碲和贵重金属的流程如下所示:
已知:①TeO2是两性氧化物,微溶于水,易溶于较浓的强酸和强碱分别生成Te4+和TeO。
②在1000℃时,Ag才能O2发生明显的反应,常温下在空气中几乎不反应。
下列说法错误的是
A.“焙烧”时,主要反应的方程式为Cu2Te+2O22CuO+TeO2
B.“滤液①”中分批加入双氧水,提高H2O2利用率
C.“酸浸①”用稀硫酸浸取,“酸浸②”用稀硝酸浸取
D.“热还原”时,先加H2C2O4,再加足量硫酸,提高反应速率
11.高纯石墨是生产氧化石墨、石墨烯的原料。利用石墨精矿(含SiO2、Fe2O3、Al2O3、MgO、CaO等杂质)制备高纯石墨的工艺流程如下:
下列说法错误的是
A.“碱熔”的目的是使难溶的SiO2、Al2O3转化为易溶的盐
B.“水浸”过程中可能发生化学变化
C.“酸浸”过程中的反应之一为
D.“操作”步骤在实验室中使用的仪器有玻璃棒、烧杯、漏斗、酒精灯
12.某课题组以铬铁矿粉[主要成分为Fe(CrO2)2,还含有Al2O3、SiO2等杂质]为主要原料制备Cr2O3,有关实验流程如图所示。
下列说法错误的是
A.过滤时需要的玻璃仪器有漏斗、烧杯、玻璃棒
B.“反应Ⅲ”每消耗32g硫黄,能产生2mlCr(OH)3
C.图中“滤渣”成分是Al(OH)3和H2SiO3
D.“焙烧”时Fe(CrO2)2发生反应:4Fe(CrO2)2+8Na2CO3+7O22Fe2O3+8Na2CrO4+8CO2
13.由于化石燃料的长期大量消耗,传统能源逐渐枯竭,而人类对能源的需求量越来越高,氢能源和化学电源的开发与利用成为全球发展的重要问题。以含钴废渣主要成分为CO和,含少量和为原料制备锂电池的电极材料的工艺流程如图,下列说法错误的是
A.通入发生反应的离子方程式:
B.加入适量调节pH是利用几种氢氧化物的不同除铝
C.若萃取剂的总量一定,则分多次加入萃取比一次加入萃取效果更好
D.将含的溶液缓慢滴加到溶液中沉钴,以提高的产率
14.现今手机等电子产品产业蓬勃发展,推动了高纯硅的生产与应用。工业上用“西门子法”。以硅石(SiO2) 为原料制备冶金级高纯硅的工艺流程如下图所示。下列说法不正确的是
已知:SiHCl3室温下为易挥发、易水解的无色液体。
A.“还原”过程需要在高温条件下,该反应的主要还原产物为Si
B.为最大程度节约成本,上述 生产工艺中能循环使用的物质只有H2
C.为防止SiHCl3水解而损失、氢气爆炸,“氧化”、“分离”与“热解”的过程均需要在无水、无氧的条件下进行
D.“氧化”过程反应的化学方程式为Si+3HC1SiHCl3+H2
15.铬酸铅(PbCrO4)通常用作着色剂,一种以CrCl3·6H2O和Pb(NO3)2等为原料制备铬酸铅的流程如下。
已知Cr(OH)3不溶于水,与Al(OH)3类似,具有两性,绿色溶液的主要成分为NaCrO2;Cr2O(橙色)+H2O2H++2CrO(黄色);碱性条件下Pb2+可形成Pb(OH)2沉淀。下列说法错误的是
A.在实验室进行溶解、过滤操作时,均需要用到的玻璃仪器为烧杯、玻璃棒
B.第①步发生反应的离子方程式为Cr3++4OH-=CrO+2H2O
C.第②步中溶液变为黄色后,仍须煮沸溶液一段时间,其目的为除去过量的H2O2
D.第③步中加入醋酸溶液的目的是使溶液中的CrO转化为Cr2O
16.实验室用软锰矿(主要成分为MnO2,含少量SiO2和Fe2O3)吸收SO2制取MnSO4的工艺流程如图:
下列说法错误的是
A.“还原”时需用到的硅酸盐质实验仪器为蒸发皿和酒精灯
B.实验室可用Na2SO3和浓硫酸制取少量SO2气体
C.“吸收”过程中既有复分解反应,又有氧化还原反应
D.“过滤2”的滤液经浓缩结晶、过滤、洗涤及干燥得到MnSO4·xH2O
17.连二亚硫酸钠(Na2S2O4)俗称保险粉,有强还原性,在空气中极易被氧化。用NaHSO3还原法制备保险粉的流程如下:
下列说法错误的是
A.反应1说明酸性:H2SO3>H2CO3
B.反应1结束后,可用盐酸酸化的 BaCl2溶液检验NaHSO3是否被氧化
C.反应2中消耗的氧化剂和还原剂的物质的量之比为1∶2
D.反应2最好在无氧条件下进行
18.高纯轻质CaCO3广泛应用于橡胶、塑料、油漆等行业。一种以磷石膏(主要成分为CaSO4,含少量SiO2和Al2O3)为原料制备轻质高纯CaCO3的流程如图:
下列说法错误的是( )
A.“转化”时发生反应的离子方程式为CaSO4+2NH3+CO2+H2O=CaCO3+2NH4++SO42-
B.“转化”时应先通入CO2,再通入NH3
C.实验室“过滤”时用到的玻璃仪器有玻璃棒、漏斗、烧杯
D.“浸取”过程中会有NH3生成
19.某同学采用废铁屑(主要成分为Fe2O3、Fe,少量碳) 制取碳酸亚铁(FeCO3) ,设计了如下流程:
根据以上流程图,下列说法不正确的是( )
A.工业废铁屑往往附着有油脂,可通过热饱和碳酸钠溶液洗涤除去
B.反应2的离子方程式:Fe2++HCO3- = FeCO3↓+H+
C.操作I为过滤,洗涤操作,一系列操作II为过滤,洗涤,干燥
D.为避免硫酸溶解时Fe2+被空气氧化,废铁屑应适当过量
20.以高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量 FeS2)为原料,生产氧化铝并获得 Fe3O4的部分工艺流程如图,下列叙述错误的是
A.烧渣分离可以选择用磁铁将烧渣中的 Fe3O4 分离出来
B.隔绝空气焙烧时理论上反应消耗的 n(FeS2)∶n(Fe2O3)=1∶6
C.向滤液中通入过量CO2、过滤、洗涤、灼烧沉淀可制得 Al2O3
D.加入 CaO 可以减少 SO2 的排放同时生成建筑材料 CaSO4
二、非选择题(共3题)
21.碘酸钙[Ca(IO3)2]是重要的食品添加剂。实验室制取Ca(IO3)2·H2O的实验流程如下:
已知:碘酸是易溶于水的强酸,不溶于有机溶剂。
(1)转化步骤是为了制得碘酸,该过程在图1所示的装置中进行。
①当观察到___________现象时,停止通入氯气。
②转化时发生反应的离子方程式为___________。
(2)除去HIO3水溶液中少量I2单质的实验操作为___________。直至用淀粉溶液检验不出碘单质的存在。
已知:①Ca(IO3)2·6H2O是一种难溶于水的白色固体,在碱性条件下不稳定。Ca(IO3)2·6H2O加热升温过程中固体的质量变化如图2所示
(3)Ca(IO)3·6H2O在100~160℃条件下加热得到的物质成分是___________。
(4)下列说法正确的是___________。
A.转化过程中CCl4的作用只是增大I2的溶解量,提高I2的利用率
B.为增大转化过程的反应速率,可适当加快通Cl2的速度
C.以除碘后的水层为原料,加入过量的Ca(OH)2溶液,过滤,洗涤可得到Ca(IO3)2·6H2O
D.对已除碘后的水层为原料得到的沉淀Ca(IO3)2·6H2O进行洗涤,洗涤沉淀至洗涤后滤液滴加AgNO3溶液不再有沉淀产生
22.用霞石岩(主要成份Na2O、K2O、Al2O3、SiO2)制碳酸钠、碳酸钾和氧化铝的工艺流程如下:
已知:NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12。
溶解过滤工序产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中。部分物质的溶解度见图,根据题意回答下列问题:
(1)固体M的化学式是__________, X物质是___________。
(2)实验室进行煅烧操作时盛放固体物质的实验仪器是 __________,滤液W中主要含有的离子有__________________。
(3)碳酸化Ⅰ中发生主要反应的离子方程式是_______________________________________。
(4)操作Ⅰ是_________(填写名称),操作Ⅱ是 _______(选填编号)。
a.趁热过滤 b.冷却过滤 c.蒸馏 d.灼烧
(5)碳酸化Ⅱ调整pH=8的目的是____________________,产品K2CO3中最可能含有的杂质是________(写化学式)。
(6)实验室用下面流程测定产品碳酸钾的纯度,为提高实验精度,T试剂最好是____________;操作Ⅲ的名称是_______________。
23.氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。
请回答下列问题:
(1).氯化铁有多种用途,请用离子方程式表示下列用途的原理。
①氯化铁做净水剂______________________;
②用FeCl3溶液(32%~35%)腐蚀铜印刷线路板____________________________。
(2).吸收剂X的化学式为__________________;氧化剂Y的化学式为________________。
(3).碱性条件下反应①的离子方程式为____________________________________。
(4).过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为
2KOH+Na2FeO4→K2FeO4+2NaOH,请根据复分解反应原理分析反应发生的原因_________。
(5).K2FeO4在水溶液中易发生反应:4FeO42+10H2O4Fe(OH)3+8OH+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用______(填序号)。
A.H2O B.稀KOH溶液、异丙醇
C.NH4Cl溶液、异丙醇 D.Fe(NO3)3溶液、异丙醇
(6).可用滴定分析法测定粗K2FeO4的纯度,有关反应离子方程式为:
①FeO42-+CrO2-+2H2O→CrO42-+Fe(OH)3↓+OH-
②2CrO42-+2H+→Cr2O72-+H2O
③Cr2O72-+6Fe2++14H+→2Cr3++6Fe3++7H2O
现称取1.980 g粗高铁酸钾样品溶于适量氢氧化钾溶液中,加入稍过量的KCrO2,充分反应后过滤,滤液定容于250 mL容量瓶中。每次取25.00 mL加入稀硫酸酸化,用0.1000 ml/L的(NH4)2Fe(SO4)2标准溶液滴定,三次滴定消耗标准溶液的平均体积为18.93 mL。则上述样品中高铁酸钾的质量分数为____________。(答案用小数表示,保留3位小数)
参考答案
1.A
【分析】
由流程图可知,硫铁矿通入空气煅烧生成的铁的氧化物,铁的氧化物加入盐酸溶解,过滤得到滤液为氯化铁和氯化亚铁混合液,通入氯气氧化亚铁离子,通过蒸发浓缩冷却结晶过滤洗涤得到FeCl3·6H2O晶体。
【详解】
“酸溶”过程中使用的酸如果是硝酸,回引入硝酸根离子,导致产品不纯,A错误;二氧化硫有毒,会污染环境,为防止污染,“焙烧”过程中产生的SO2可以用于制硫酸,B正确;通入氯气的目的是将Fe2+氧化为Fe3+,C正确;FeCl3·6H2O制取无水FeCl3时,应在氯化氢气流中加热,防止水解FeCl3,D正确。
故选A。
【点睛】
本题考查了化学工艺流程,涉及了氧化还原反应、废气处理、盐类水解等知识,正确分析流程,依据物质性质分析问题是解题关键。
2.A
【详解】
A.“灼烧”时,KOH可以与SiO2反应,所以使用铁坩锅,故选A;
B.“浸取”时,不能用无水乙醇代替水,因不易溶于乙醇,故B错;
C.由,氧化产物为,还原产物为,氧化产物与还原产物的物质的量之比为,故C错;
D选项“浓缩结晶”后的母液中有、和等溶质,若二氧化碳过量还可能存在碳酸氢钾,故D错;
答案选A。
3.D
【分析】
废催化剂加入稀硫酸,第一次浸出主要发生反应、,过滤后滤液中ZnSO4、FeSO4、Fe2(SO4)3,浓缩结晶得到粗ZnSO4⋅7H2O,滤渣1含有SiO2、CuS,向盛有滤渣1的反应器中加H2SO4和H2O2溶液,发生氧化还原反应,生成硫酸铜、硫,滤渣2含有硫和二氧化硅,滤液含有硫酸铜,经结晶可得到硫酸铜晶体;
【详解】
A. 滤液1中还含有Fe3+,选用KSCN和新制的氯水不能检验是否含有Fe2+,故A错误;
B. 过氧化氢在酸性条件下可氧化CuS,应先加入稀硫酸,再加入过氧化氢,故B错误;
C. 滤渣2含有硫和二氧化硅,故C错误;
D. 步骤①操作中生成的气体为硫化氢,需用NaOH溶液或CuSO4溶液吸收,故D正确;
答案选D。
4.C
【详解】
A.分析流程可知,滤渣I为二氧化硅,可用于制造光导纤维、滤渣II为氢氧化铁,氢氧化铁受热分解生成三氧化二铁,三氧化二铁可用于制作颜料,A正确;
B.软锰矿浆中通入足量的二氧化硫,二氧化锰与二氧化硫发生氧化还原反应生成硫酸锰,反应方程式为MnO2十SO2=MnSO4,B正确;
C.“沉锰”时,反应体系的温度越高,碳酸氢铵越容易分解,碳酸氢铵的原料利用率越低,C错误;
D.生成的碳酸锰沉淀需经充分洗涤,若未洗涤干净,洗涤液中含有硫酸根离子,故检验洗涤液中是否含有硫酸根离子即可,方法为:取1~2mL最后一次洗涤液与试管中,滴加盐酸酸化,无明显现象,在滴加氯化钡溶液,若无白色沉淀产生,则洗涤干净,D正确;
答案选C。
5.B
【分析】
工业废水中含大量硫酸亚铁、Cu2+和少量的Na+,从该废水中回收硫酸亚铁和金属铜,结合流程可知,试剂A为Fe,操作①为过滤,则E中主要含硫酸亚铁,B中含Cu、Fe,加入试剂C为H2SO4,操作②为过滤,得到Cu,D中主要含FeSO4,操作③为蒸发、浓缩、结晶、过滤,可得到FeSO4.7H2O,以此解答该题。
【详解】
A、由上述分析①②操作均为过滤,E中主要为FeSO4,含有少量的Na+,D溶液中主要含FeSO4,还含有少量的H2SO4,成分不完全相同,故A不符合题意;
B、因最终制备物质为FeSO4.7H2O,若加入的C物质为稀盐酸,则会导致制备物质纯度较低,故加入的物质C只能为稀硫酸,故B符合题意;
C、冷却结晶的原理是是根据物质在不同温度下溶解度不同(一般是高温下溶解度大,低温时溶解度小),而分离或提纯固体物质的一种方法,由此可知硫酸亚铁晶体的溶解度随温度变化有一定变化,故C不符合题意;
D、由上述分析可知,试剂A为铁粉,工业废水中含有Cu2+,其反应的离子方程式为:Fe+Cu2+=Fe2++Cu,故D不符合题意;
故选B。
6.D
【详解】
A.酸浸液中有和,加入少量的目的是调节pH,使溶液中的形成沉淀,A项正确;
B.废铁屑扔掉会污染环境、浪费资源,故合理处理废铁屑有利于保护环境和资源再利用,B项正确;
C.溶液A中含,加入的作用是将溶液中的转化为,再水解形成碱式硫酸铁,C项正确;
D.溶液B的pH必须控制在一定的范围内,pH偏小时水解程度较弱,当pH偏大时,会水解变成氢氧化铁沉淀,得不到碱式硫酸铁,D项错误;
答案选D。
7.A
【解析】A. MnO2能够催化双氧水分解,不能作为反应的稳定剂,故A错误;B. 结晶过程中加入氯化钠、搅拌,能降低过碳酸钠的溶解度,有利于过碳酸钠析出,从而增大产品的产率,故B正确;C. “分离”所选用的操作为过滤,过滤主要用到的玻璃仪器为烧杯、漏斗、玻璃棒,故C正确;D. 2Na2CO3·3H2O2受热分解生成碳酸钠、水和氧气,有元素的化合价发生变化,属于氧化还原反应,故D正确;故选A。
8.D
【解析】
【详解】
A. 电解熔融Al2O3的反应属于氧化还原反应,反应的方程式为2Al2O3(熔融)4Al+3O2↑,A错误;
B. NaAlO2在溶液中与过量的CO2生成Al(OH)3和NaHCO3,产生的阴离子主要为HCO3-, B错误;
C. 反应③是灼烧固体氢氧化铝,实验室中灼烧固体用坩埚,C错误;
D. 反应①是Al2O3与NaOH发生反应产生NaAlO2和H2O,发生的主要反应为:Al2O3+2OH-=2AlO2-+H2O,D正确;
故合理选项是D。
9.D
【分析】
硝酸和铜反应生成硝酸铜、水和氮氧化合物,氮氧化合物被碳酸钠溶液吸收,然后结晶生成亚硝酸钠,据此解答。
【详解】
A.用铜粉替代铜片可增大反应物的接触面积,加快“制气”速率,A正确;
B.控制的通入速率,可使气体被充分吸收,从而提高“吸收”效率,B正确;
C.“结晶”后得到晶体,其操作通常是过滤、洗涤、干燥,C正确;
D.亚硝酸钠和碳酸氢钠的焰色试验均是黄色的,不能利用“焰色反应”检验中是否含,D错误;
答案选D。
10.D
【分析】
阳极泥中含有Cu2Te、Au、Ag;根据题中信息可知,在“焙烧”过程中,主要是Cu2Te被氧化,且生成CuO、TeO2;经过“碱浸”,TeO2变为而留在“滤液①”,而“滤渣①”主要含有CuO、Ag、Au;“滤渣①”经过两次酸浸,逐步将Cu、Ag两种元素从“滤渣①”分离出,得到Au的同时,也将Cu、Ag分开,以更好地回收贵重金属,则“酸浸①”可以使用H2SO4,“酸浸②”可以使用HNO3;向“滤液①”中加入双氧水,将氧化为,再经过“加热浓缩”得到Na2TeO4浓溶液,再经过“热还原”得到碲粉。
【详解】
A.根据题中信息可知,阳极泥在“焙烧”过程中,主要是Cu2Te被氧化,且生成CuO、TeO2,反应的化学方程式为:,A正确;
B.H2O2易分解,向“滤液①”中分批加入双氧水,可以降低H2O2分解率,提高H2O2的利用率,B正确;
C.“滤渣①”主要含有CuO、Ag、Au;“酸浸①”使用H2SO4可以分离出Cu元素,“酸浸②”使用HNO3可以分离出Ag元素,从而将三种金属元素分离,以更好地回收金属,C正确;
D. “热还原”时,发生的化学反应为Na2TeO4+H2SO4+3H2C2O4=Na2SO4+6CO2↑+Te↓+4H2O,由此可知该反应需要强酸性环境,若先加入H2C2O4,再加足量H2SO4,不能提高反应速率,应该先加入足量H2SO4,再加入H2C2O4,D错误;
故选D。
11.D
【分析】
石墨精矿中SiO2为酸性氧化物,碱熔时,SiO2与NaOH反应生成硅酸钠和水,Al2O3与NaOH反应生成偏铝酸钠和水;水浸时,硅酸钠、偏铝酸钠溶于水,则滤液I中含有硅酸钠、偏铝酸钠和未反应的NaOH;滤渣为石墨烯、Fe2O3、MgO、CaO,加入盐酸,Fe2O3、MgO、CaO溶于盐酸,形成相应的盐,过滤、洗涤得到高纯石墨,
【详解】
A.“碱熔”时,含Si元素为SiO2,SiO2为酸性氧化物,Al2O3为两性氧化物,SiO2、Al2O3与NaOH反应生成可溶性钠盐和水,A正确;
B.“水浸”过程中CaO和水反应生成Ca(OH)2,可能发生化学变化,B正确;
C.“酸浸”过程是金属氧化物Fe2O3、MgO和酸反应生成盐和水,其中的反应之一为,C正确;
D.“操作”是过滤,使用的仪器有玻璃棒、烧杯、漏斗,不需要酒精灯,D错误;
故选:D。
12.B
【分析】
铬铁矿为原料制备重铬酸钠,铬铁矿(主要成份为Fe(CrO2)2,还含有Al2O3、SiO2等杂质),铬铁矿经加入纯碱、空气和辅料氧化煅烧、主反应:4Fe(CrO2)2+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2,副反应:SiO2+Na2CO3Na2SiO3+CO2↑、Al2O3+Na2CO32NaAlO2+CO2↑,水浸之后除去生成的氧化铁,加入稀硫酸调节pH,除去溶液中的AlO、SiO,经酸化、蒸发结晶后可生成重铬酸钠,加入硫磺,发生氧化还原反应生成Cr(OH)3,分解生成Cr2O3,以此解答该题。
【详解】
A.过滤时需要的仪器有带铁圈的铁架台、漏斗、滤纸、烧杯、玻璃棒,其中玻璃仪器有漏斗、烧杯、玻璃棒,A正确;
B.“反应Ⅲ”每消耗32g(1ml)硫黄,转移2ml电子,能产生mlCr(OH)3,B错误;
C.加入稀硫酸调节pH,除去溶液中的AlO、SiO,所以“滤渣”成分应该有Al(OH)3和H2SiO3,C正确;
D.分析可知,“焙烧”时Fe(CrO2)2发生反应:4Fe(CrO2)2+8Na2CO3+7O22Fe2O3+8Na2CrO4+8CO2,D正确;
答案为B。
13.D
【分析】
含钴废渣主要成分CO、,含少量、ZnO,由流程可知,加入稀硫酸酸浸,发生反应:、、、,同时通入,被还原为,发生,得到的溶液主要含有的金属离子有、、,加入溶液调节pH与发生反应:,过滤,除去,加入萃取剂,萃取,分液后向有机层中加入适量的硫酸溶液充分振荡,得到溶液,向水层中缓慢加入,得到,以此来解答。
【详解】
A.通入时被还原为,则反应的离子方程式:,故A正确;
B.加入溶液调节pH与发生反应:,可除去铝,故B正确;
C.萃取剂的总量一定,则分多次加入萃取比一次加入萃取分离更彻底,效果更好,故C正确;
D.“沉钴”时为使沉淀完全,溶液需稍过量且缓慢滴加,则滴加顺序不合理,故D错误;
故选D。
14.B
【分析】
二氧化硅和金属镁在高温下反应生成氧化镁和硅,加入稀硫酸除去氧化镁,过滤得到硅,通入氯化氢在200~300℃下反应生成SiHCl3,与最后与氢气反应生成Si。
【详解】
A.二氧化硅和金属镁在高温下反应生成氧化镁和硅,还原产物为硅,镁和硅反应可生成Mg2Si,故A正确;
B.流程中H2、HCl 既是反应物也是生成物,则可循环使用,故B错误;
C.“氧化”、“分离”与“热解”的过程均需要在无水、无氧的条件下进行,可防止SiHCl3水解而损失、氢气爆炸,故C正确;
D.由流程可知,通入氯化氢在200~300℃下反应生成SiHCl3,反应的化学方程式为Si+3HClSiHCl3+H2,故D正确;
故选B。
15.D
【分析】
根据流程,向CrCl3·6H2O中加入过量的NaOH溶液,因Cr(OH)3与Al(OH)3类似,因此过量的NaOH溶液可以将Cr3+转化为CrO,随后向绿色溶液中加入浓H2O2将CrO转化为CrO,随后加入煮沸除去多余的H2O2,用醋酸调节溶液pH将CrO转化为Cr2O,最后加入Pb(NO3)2溶液得到PbCrO4沉淀,据此分析。
【详解】
A.在实验室进行溶解操作时需要用到烧杯、玻璃棒,进行过滤操作时需要用到烧杯、玻璃棒、漏斗等,A项正确;
B.类比Al与OH-的反应,结合已知信息可知Cr3+与过量OH-反应的离子方程式为Cr3++4OH-=CrO+2H2O,B项正确;
C.过氧化氢作为一种常见的氧化剂,第②步中加入浓H2O2溶液是为了把+3价的铬氧化为+6价,溶液变为黄色时已经完全反应,再煮沸一段时间是为了让过量的H2O2分解,避免干扰后续反应,C项正确;
D.pH过高时,Pb2+易形成Pb(OH)2沉淀,第③步中加入醋酸溶液的目的是防止加入Pb(NO3)2溶液后产生氢氧化铅沉淀,D项错误;
故答案选D。
16.A
【详解】
A.“还原”的过程是将焦炭粉和软锰矿粉混合灼烧,该过程要使用坩埚,且酒精灯的温度达不到850℃,A错误;
B.实验室可以使用Na2SO3固体和70%的浓硫酸制取少量SO2气体,B正确;
C.“吸收”时发生的反应为MnO+H2SO4=MnSO4+H2O,,这两个反应分别为复分解反应和氧化还原反应,C正确;
D.“过滤2”所得滤液主要是MnSO4溶液,经浓缩结晶、过滤、洗涤及干燥可得MnSO4∙xH2O,D正确;
故选A。
17.C
【详解】
A.反应1为二氧化硫通入碳酸钠溶液生成亚硫酸氢钠和二氧化碳,则说明酸性:H2SO3>H2CO3,A正确;
B. 反应1结束后,溶液中为亚硫酸氢钠溶液,不与氯化钡反应,若加入可用盐酸酸化的 BaCl2溶液,出现白色沉淀,则沉淀为硫酸钡,可证明NaHSO3被氧化,B正确;
C. 反应2为 ,亚硫酸氢钠中硫化合价从+4下降到+3,还原剂是锌,化合价从0升高到+2价,消耗的氧化剂和还原剂的物质的量之比为2:1,C错误;
D.连二亚硫酸钠(Na2S2O4)俗称保险粉,有强还原性,在空气中极易被氧化,反应2最好在无氧条件下进行,D正确;
答案选C。
18.B
【分析】
磷石膏氨水的浆料中通入氨气和二氧化碳可生成碳酸盐或碳酸氢盐,过滤后滤液为硫酸铵、氨水,滤渣含有碳酸钙、SiO2、Al2O3等,高温煅烧生成硅酸钙、偏铝酸钙等,加入氯化铵溶液充分浸取,可生成硅酸、氢氧化铝、氯化钙等,氯化钙最终可生成碳酸钙,结合分析解答。
【详解】
A.根据流程中反应物和产物综合判断,“转化”时发生反应的离子方程式为CaSO4+2NH3+CO2+H2O=CaCO3+2NH4++SO42−,故A正确;
B.由于CO2溶解度小,NH3溶解度大,所以“转化”时应先通入NH3,再通入CO2,故B错误;
C.实验室“过滤“时用到的玻璃仪器有玻璃棒、漏斗、烧杯,故C正确;
D.“浸取”过程中主要是CaO与NH4Cl溶液反应,会有NH3生成,故D正确;
答案选B。
19.B
【分析】
“溶解”阶段,Fe2O3和硫酸反应生成Fe2(SO4)3和水,Fe和Fe2(SO4)3反应FeSO4,Fe和H2SO4反应生成FeSO4和氢气,Fe元素以Fe2+存在于溶液中。操作Ⅰ为过滤,除去未反应的C,滤液1中加NaHCO3,HCO3-和Fe2+反应产生FeCO3沉淀,通过过滤、洗涤、干燥等一系列操作得到FeCO3,据此解答。
【详解】
A.碳酸钠水解呈碱性,油脂在碱性环境下水解,温度升高,水解程度增大,故工业废铁屑往往附着有油脂,可通过热饱和碳酸钠溶液洗涤除去,A正确;
B.结合电荷守恒可得反应2的离子方程式为:Fe2++2HCO3-=FeCO3↓+H2O+CO2↑,B错误;
C.操作I为过滤除去C,为减少Fe2+的损失,进行洗涤操作,为得到纯净的FeCO3,一系列操作II为过滤、洗涤、干燥,C正确;
D.Fe2+易被空气中的氧气氧化,故为避免硫酸溶解时Fe2+被空气氧化,废铁屑应适当过量,D正确。
答案选B。
20.B
【分析】
由流程可知,高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量FeS2)为原料,通入空气焙烧时,因为含有少量FeS2,会产生SO2,加入氧化钙达到吸收SO2的目的,防止SO2排放污染空气,焙烧产物经过NaOH溶液碱浸,Al2O3与氢氧化钠反应生成偏铝酸钠,过滤后,滤液中通入过量CO2,偏铝酸根与CO2、水反应生成氢氧化铝沉淀,洗涤后灼烧氢氧化铝即可生产Al2O3;碱浸过程中,Fe2O3不与NaOH反应,过滤后留在滤渣中,加入FeS2与Fe2O3在隔绝空气的条件下反应生成SO2和Fe3O4,利用Fe3O4的磁性实现其与烧渣的分离,以此来解答。
【详解】
A.Fe3O4有磁性,可以用磁铁将Fe3O4从烧渣中分离出来,故A正确;
B.隔绝空气焙烧,FeS2与Fe2O3反应,生成SO2和Fe3O4,反应方程式为FeS2+16Fe2O311Fe3O4+2SO2↑,由方程式可知n(FeS2):n(Fe2O3)=1:16,故B错误;
C.滤液中含有AlO2−,通入过量CO2,发生反应:AlO2−+CO2+2H2O=Al(OH)3↓+HCO3−,生成Al(OH)3沉淀,经过过滤、洗涤后得到Al(OH)3,再灼烧Al(OH)3,反应为:2 Al(OH)3Al2O3+3H2O,即可制得Al2O3,故C正确;
D.铝土矿中含有FeS2,FeS2焙烧生成SO2,CaO与SO2、O2发生反应:2CaO+2SO2+O2=2CaSO4,CaSO4可用于建筑材料,故D正确;
故答案选B。
21.反应液中紫红色接近褪去 I2+5Cl2+6H2O=2IO+10Cl-+12H+ 将HIO3水溶液用CCl4多次萃取,分液 Ca(IO3)2·H2O BD
【分析】
转化步骤是为了制得碘酸,I2的CCl4溶液在转化过程中与Cl2反应生成碘酸,CCl4难溶于水经过分液除去;以除碘后的水层为原料,加入Ca(OH)2粉末,边加边搅拌至溶液pH约为7,过滤,洗涤沉淀至洗涤后滤液滴加AgNO3溶液不再有沉淀产生,将滤渣在100∼160℃条件下加热至恒重即可制得Ca(IO3)2·H2O,据此分析。
【详解】
(1)①转化步骤是为了制得碘酸,I2的CCl4溶液呈紫红色,当观察到反应液中紫红色接近褪去现象时,则I2基本反应完,故可停止通入氯气;
②转化时发生反应的离子方程式为I2+5Cl2+6H2O=2IO+10Cl-+12H+;
(2)互不相溶的液体混合物分离应使用分液操作,HIO3可溶于水,但碘单质在水中溶解度较小,可进行萃取分离,操作为将HIO3水溶液用CCl4多次萃取,分液,直至用淀粉溶液检验不出碘单质的存在;
(3)Ca(IO3)2·6H2O的相对分子质量为498,Ca(IO3)2·H2O的相对分子质量为408,故在100~160℃条件下加热得到的物质成分为Ca(IO3)2·H2O;
(4)A.转化过程中CCl4可增大I2的溶解量,提高I2的利用率,且可除去HIO3中的I2,A错误;
B.适当加快通Cl2的速度,即增大反应物浓度,可增大转化过程的反应速率,B正确;
C.已知Ca(IO3)2·6H2O在碱性条件下不能稳定存在,故以除碘后的水层为原料,加入过量的Ca(OH)2溶液,调节溶液pH为7,过滤,洗涤可得到Ca(IO3)2·6H2O,C错误;
D.对已除碘后的水层为原料得到的沉淀Ca(IO3)2·6H2O进行洗涤,洗涤沉淀至洗涤后滤液滴加AgNO3溶液不再有沉淀产生,在加热至恒重即可,D正确;
综上所诉,答案为BD。
22.Al2O3 CO2 坩埚 Na+、K+、HCO3− 2AlO2−+ CO2+ 3H2O →2Al(OH)3↓+ CO32− 蒸发 a 碳酸根转化为碳酸氢根离子,利于KHCO3结晶析出 Na2CO3 足量BaCl2(或CaCl2)溶液 恒重操作
【分析】
(1)碳酸钙可以和盐酸反应生成二氧化碳气体,氢氧化铝受热分解为氧化铝和水;
(2)固体灼烧应该在坩埚中进行,碳酸钠和碳酸钾可以和二氧化碳反应得到碳酸氢盐;
(3)偏铝酸盐可以和少量的二氧化碳发生反应生成氢氧化铝和碳酸盐;
(4)制备碳酸盐可以采用蒸发浓缩的方法;
(5)在一定的碱性环境下,碳酸根可以转化为碳酸氢根离子;
(6)测定产品碳酸钾的纯度,则应该把碳酸钾转化为碳酸盐沉淀,根据所得沉淀的质量来确定碳酸钾的量,计算纯度。
【详解】
(1)在高温下矿石、石灰石、煤混合反应生成的X可以进行碳酸的酸化,实验X一定是CO2气体.溶解过滤工序产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中,所以通入CO2后一定生成氢氧化铝沉淀,灼烧则得到氧化铝,即M是氧化铝,故答案为:Al2O3、CO2;
(2)固体灼烧应该在坩埚中进行,滤液W可以循环使用,原来制备碳酸钠和碳酸钾,所以其中主要含有的离子有Na+、K+、HCO3-,故答案为:坩埚;Na+、K+、HCO3-;
(3)碳酸化Ⅰ的目的是制备氢氧化铝,又因为溶液的pH=11,所以生成的是碳酸盐,而不是碳酸氢盐,即该反应的离子方程式应该是2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,故答案为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-;
(4)操作Ⅰ的目的是制备碳酸盐,所以应该是蒸发浓缩,然后趁热过滤即可,故答案为:蒸发;a.
(5)碳酸氢钾灼烧生成碳酸钾,所以碳酸化Ⅱ调整pH=8的目的是碳酸根转化为碳酸氢根离子,利于KHCO3结晶析出.由于溶液中还含有碳酸氢钠,所以产品K2CO3中最可能含有的杂质是碳酸钠,故答案为:碳酸根转化为碳酸氢根离子,利于KHCO3结晶析出;Na2CO3;
(6)要测定测定产品碳酸钾的纯度,则应该把碳酸钾转化为碳酸盐沉淀,由于碳酸钡比碳酸钙难溶,所以T试剂最好是足量BaCl2溶液,为了防止误差,应该重复干燥称量操作,所以操作Ⅲ的名称是恒重操作,故答案为:足量BaCl2溶液;恒重操作(重复干燥称量操作)。
23.Fe3++ 3H2OFe(OH)3+ 3H+ 2Fe3++ Cu=2Fe2++ Cu2+ FeCl2 NaClO 2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O K2FeO4溶解度小,析出晶体,促进反应进行 B 0.631
【详解】
(1).①氯化铁是强酸弱碱盐,Fe3+发生水解反应:Fe3++ 3H2OFe(OH)3+ 3H+,产生Fe(OH)3胶体,表面积大,吸附力强,可以吸附水中悬浮的固体,使之形成沉淀,从而使水得到净化。②用FeCl3溶液(32%~35%)腐蚀铜印刷线路板,是由于Fe3+有氧化性,与Cu会发生氧化还原反应,离子方程式是:2Fe3++ Cu=2Fe2++ Cu2+;
(2).氯气有毒会污染大气,因此应该进行尾气处理,由于X吸收氯气后可以产生FeCl3溶液,所以吸收剂X的化学式为FeCl2,二者反应的离子方程式是:2Fe2++Cl2=2Fe3++2Cl-,NaOH溶液与Cl2发生反应:2NaOH+ Cl2=NaCl+NaClO+H2O。氧化产物是NaClO,NaClO与FeCl3溶液在碱性条件下发生反应,形成Na2FeO4,因此氧化剂是NaClO;
(3).在碱性条件下反应①的离子方程式为2Fe3++3ClO-+10OH-→2FeO42-+ 3Cl-+5H2O;(4).过程②中Na2FeO4与KOH溶液发生复分解反应,将将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为Na2FeO4+2KOH=K2FeO4↓+2NaOH;该反应之所以可以发生,是由于K2FeO4溶解度小,析出晶体,促进反应进行;
(5).K2FeO4在水溶液中易发生反应:4FeO42+10H2O4Fe(OH)3+8OH+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,为了防止K2FeO4在水中反应反应消耗,同时不引入杂质离子,则洗涤剂最好选用稀KOH溶液、异丙醇,代号是B;
(6).根据三个反应方程式可得关系式:2FeO42-—2CrO42-—Cr2O72-—6Fe2+,n(Fe2+)=0.1000 ml/L×18.93 ×10-3L×10=1.893 ×10-2ml,所以n(FeO42-)= n(Fe2+)=×1.893 ×10-2ml=6.31×10-3ml,纯净的K2FeO4的质量是:=0.631。
相关试卷
这是一份2022届高三化学一轮复习实验专题题型必练27陌生有机物制备实验流程题含解析,共20页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
这是一份2022届高三化学一轮复习实验专题题型必练26陌生情景下工艺流程题含解析,共26页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
这是一份2022届高三化学一轮复习实验专题题型必练27陌生有机物制备实验流程题含解析,共20页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。












