
化学选择性必修1第4节 金属的腐蚀与防护巩固练习
展开第四节金属的腐蚀与防护(二)
一、单选题,共15小题
1.下列关于如图装置说法中正确的是
A.保护铁时,a极为铁片,b极为锌片
B.电镀铜时,a极为镀件,b极为铜
C.精炼铜时,a极为粗铜,b极为精铜
D.惰性电极电解饱和食盐水时,b极有黄绿色气体产生
2.下列有关金属腐蚀与防护的说法正确的是
A.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阴极的阳极保护法
B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.纯银器表面在空气中因化学腐蚀渐渐变暗
D.海水中船体的腐蚀为析氢腐蚀
3.下列化学电池属于高效、环境友好电池的是
A.镍镉电池 B.锌锰电池
C.铅蓄电池 D.氢氧燃料电池
4.在盛有稀H2SO4的烧杯中放入用导线连接锌片和铜片,下列叙述正确的是
A.正极附近的SO42―离子浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.正极有O2逸出
D.铜片上有H2逸出
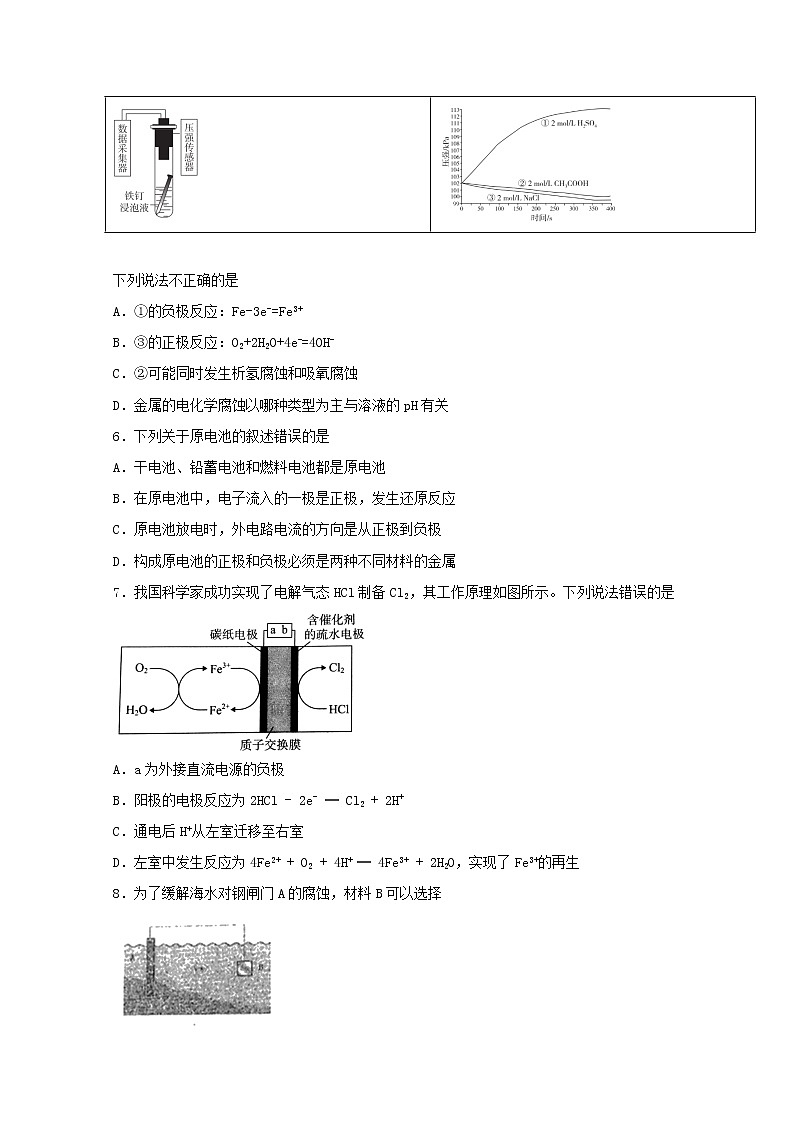
5.探究铁钉在不同溶液中的腐蚀情况。实验装置与数据如下:
实验装置 | 实验数据 |
下列说法不正确的是
A.①的负极反应:Fe-3e-=Fe3+
B.③的正极反应:O2+2H2O+4e-=4OH-
C.②可能同时发生析氢腐蚀和吸氧腐蚀
D.金属的电化学腐蚀以哪种类型为主与溶液的pH有关
6.下列关于原电池的叙述错误的是
A.干电池、铅蓄电池和燃料电池都是原电池
B.在原电池中,电子流入的一极是正极,发生还原反应
C.原电池放电时,外电路电流的方向是从正极到负极
D.构成原电池的正极和负极必须是两种不同材料的金属
7.我国科学家成功实现了电解气态HCl制备Cl2,其工作原理如图所示。下列说法错误的是
A.a为外接直流电源的负极
B.阳极的电极反应为2HCl - 2e- ═ Cl2 + 2H+
C.通电后H+从左室迁移至右室
D.左室中发生反应为4Fe2+ + O2 + 4H+ ═ 4Fe3+ + 2H2O,实现了Fe3+的再生
8.为了缓解海水对钢闸门A的腐蚀,材料B可以选择
A.碳 B.锌 C.铜 D.钠
9.研究金属腐蚀及防护的装置如图所示。
下列有关说法不正确的是
A.图1:a点溶液变红
B.图1:a点的铁比b点的铁腐蚀严重
C.图2:若d为锌,则铁不易被腐蚀
D.图2:正极的电极反应式为O2+4e- +2H2O =4OH-
10.化学与生产、生活、社会密切相关,下列说法中不正确的是( )
A.合金材料中可能含有非金属元素
B.铁在潮湿的空气中放置,易发生化学腐蚀而生锈
C.马口铁(镀锡)的表面一旦破损,铁腐蚀加快
D.神舟10号飞船所用太阳能电池板可将光能转换为电能,所用转换材料是单晶硅
11.最近,科学家研发了“全氢电池”,其工作原理如图所示。下列有关该电池工作时的说法,正确的是( )
A.电解质溶液中,Na+向左移动
B.该电池的总反应为H+ + OH- = H2O
C.电子由N电极经导线流向M电极
D.导线上通过1mole-,装置内H2总量减少0.5mol
12.下列说法正确的是
A.用镀锡铁做罐头盒,当镀层破坏后锡能对铁提供保护
B.用铜作电极电解稀硫酸,发生反应:Cu+H2SO4 CuSO4+H2↑
C.某原电池的电极材料分别为Mg和Al,则Mg一定做负极
D.某可逆反应升高温度,活化能大的方向化学反应速率增大程度小
13.将炭粉和铁粉均匀混合,撒入内壁分别用氯化钠溶液和稀醋酸溶液润湿过的具支试管中,并按下图装置好仪器,观察下图,示意正确的是( )
A. B. C. D.
14.下列相关实验的说法中不正确的是( )
A.镀锌铁皮锌层厚度测定时,当反应速率突然变慢时,表明铁皮表面的的锌层已反应完全
B.可用纸层析法分离微量的Fe3+离子与Cu2+离子形成的混合物
C.分液时,先将上层液体从上口倒出,然后再将下层液体从下口放出
D.可用白纸鉴别浓硫酸和稀硫酸
15.如图,电解质溶液是NaCl的水溶液,通电一段时间后发现d极附近有黄绿色气体产生,以下说法正确的是
A.a是电源的正极
B.电子流动的方向:d→b
C.c极发生氧化反应
D.如果将c、d两电极互换,则c上也会生成黄绿色气体
二、非选择题,共5小题
16.如图,甲是氢氧燃料电池示意图,a为正极;乙是惰性电极电解足量CuSO4溶液的示意图,电解时c电极上有红色固体物质析出。
回答下列问题:
(1)图甲中,从A口通入的气体是___,b电极的电极反应式为___。
(2)图乙中,c电极通过导线与电源的___极相连;理论上当c电极析出3.20g红色固体时,则d电极表面产生的气体在标准状况下的体积为___mL。
17.如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的____________棒,乙池中的____________棒。
②乙池中阳极的电极反应式是___________________。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式_________________ 。
②甲池中碳极上电极反应式是_____________________,
③将湿润的KI淀粉试纸放在乙池碳极附近,发现试纸变蓝,反应的离子方程式为_____________。
④若乙池转移0.02 mol e-后停止实验,池中溶液体积是200 mL,则溶液混合匀后的pH=____。
18.按要求填空:
(1)向含Mg(OH)2固体的饱和溶液中加入适量NH4Cl固体,沉淀溶解平衡__(填“正向移动”“逆向移动”或“不移动”),C(Mg2+)__(填“增大”“减小”“不变”),其Ksp__(填“增大”“减小”“不变”)
(2)用金属Mg和Al作电极材料插入NaOH溶液中,__为负极,该电极的离子方程式为__。
(3)轮船外壳上常镶嵌锌块以防腐蚀,该方法称为___。
19.将锌片和铜片插入某种电解质溶液中,锌片和铜片用导线相连,形成原电池装置。
(1)若电解质溶液是稀硫酸,则发生氧化反应的是______ 极(“锌”、“铜”),铜极发生的电极反应式是____,该电池的总反应方程式是 _____。
(2)若电解质溶液是硫酸铜溶液,在导线中电子是由____极流向______极(填化学式),铜极上反应的电极反应方程式是 ____,该电池总反应方程式是_____。
20.某反应中的反应物和生成物有FeCl3、FeCl2、Cu、CuCl2。有人将上述反应设计成原电池。
(1)则该电池负极材料为:__________________,负极反应式为________________;
(2)正极材料为:_____________,该电池总的化学反应式为_______________;
(3)一段时间后负极质量减轻m g,则下列说法正确的是:________(填写序号)。
A.电路中通过的电子为m/32 mol
B.正极质量增加56m/64 g
C.原电池工作过程中电子由正极经导线流向负极
D.原电池工作过程中Cl−向负极移动
参考答案
1.C
【解析】
【详解】
A.保护铁时,Fe为阴极,则b极为铁片,a极为锌片,选项A错误;
B.电镀铜时,Cu为阳极,则b极为镀件,a与正极相连,a极为铜,选项B错误;
C.精炼铜时,粗铜为阳极,纯铜为阴极,a与正极相连,则a极为粗铜,b极为精铜,选项C正确;
D.惰性电极电解饱和食盐水时,阳极上生成氯气,则a极有黄绿色气体产生,选项D错误;
答案选C。
2.C
【详解】
A. 海轮外壳连接锌块,锌为负极,保护外壳不受腐蚀,为牺牲阳极的阴极保护法,选项A不正确;
B.铁比锡活泼,当镀锡铁制品的镀层破损时,相对比较活泼的铁先被腐蚀,镀层不能对铁制品再起保护作用,选项B错误;
C. 不纯的金属或合金易发生电化学腐蚀,纯银器主要发生化学腐蚀使其表面变暗,选项C正确;
D. 海水的酸碱性接近中性,在海水中船体受到的腐蚀主要为吸氧腐蚀,只有在酸性较强的溶液中,钢铁才会发生析氢腐蚀,选项D错误;
故合理选项是C。
3.D
【详解】
A.镍镉电池中含有镍镉重金属,对环境有污染,故A错误;
B.锌锰电池中含有锌、锰元素,对环境有污染,故B错误;
C.铅蓄电池中含有铅重金属,对环境有污染,故C错误;
D.氢氧燃料电池最终生成水,水对环境无污染,故D正确;
故选:D。
4.D
【详解】
相对活泼的锌做负极,失去的电子经导线流向正极,溶液中的氢离子在正极得电子逸出氢气;负极极反应:Zn -2e-=Zn2+; 正极极反应:2H++2e-=H2↑;阳离子移向原电池的正极,阴离子移向负极,所以负极附近的SO42-离子浓度逐渐增大;
故选D。
5.A
【分析】
铁钉在强酸性环境下发生析氢腐蚀,生成氢气,装置压强增大;在弱酸性、中性或碱性环境下发生吸氧腐蚀,消耗氧气,装置内气压下降。
【详解】
A. ①发生析氢腐蚀,负极反应:Fe-3e-=Fe2+,A错误;
B. ③发生吸氧腐蚀,正极氧气放电,反应:O2+2H2O+4e-=4OH-,B正确;
C. 相比于中性和强酸性环境,②的压强变化介于两者之间,故可能同时发生析氢腐蚀和吸氧腐蚀,C正确;
D. 据表可知,金属的电化学腐蚀以哪种类型为主与溶液的pH有关,D正确。
答案为A。
6.D
【详解】
A.干电池、铅蓄电池和燃料电池都能够将化学能转化为电能,都是原电池,故A正确;
B.原电池中电子由负极流向正极,则电子流出的一极是负极,负极发生氧化反应,电子流入的一极是正极,正极发生还原反应,故B正确;
C.原电池中外电路中的电流由正极流向负极,故C正确;
D.构成原电池的正负极可能都是非金属或金属和非金属,如Zn、石墨和稀硫酸构成的原电池,以石墨为电极的氢氧燃料电池等,故D错误;
故选D。
7.C
【详解】
A. 右侧氯化氢失去电子转化为氯气,因此右侧电极是阳极,则a为外接直流电源的负极,b为外接直流电源的正极,A正确;
B. 阳极发生失去电子的氧化反应,电极反应为2HCl-2e-=Cl2+2H+,B正确;
C. 电解池中阳离子向阴极移动,因此通电后H+从右室迁移至左室,C错误;
D. 根据装置图可判断左室中发生反应为4Fe2++O2+4H+=4Fe3++2H2O,实现了Fe3+的再生,D正确;
答案选C。
8.B
【详解】
A.碳与铁连接在一起容易发生电化学腐蚀,铁作负极,加快腐蚀,A不选;
B.锌的金属性强于铁,与铁连接在一起,形成原电池,铁作正极,被保护,B选;
C.铜的金属性弱于铁,与铁连接在一起容易发生电化学腐蚀,铁作负极,加快腐蚀,C不选;
D.钠是活泼的金属极易和水反应生成氢氧化钠和氢气,不能形成原电池,起不到保护铁的作用,D不选;
答案选B。
9.B
【详解】
A. 图1:a点氧气得电子产生氢氧根离子,溶液呈碱性,遇酚酞溶液变红,选项A正确;
B. 图1:a点为正极得电子, b点为负极铁失电子产生亚铁离子,b点铁腐蚀严重,选项B不正确;
C. 图2:若d为锌为负极失电子,则铁为正极,不易被腐蚀,选项C正确;
D. 图2:正极氧气得电子产生氢氧根离子,电极反应式为O2+4e- +2H2O =4OH-,选项D正确;
答案选B。
10.B
【解析】
【详解】
A、合金由金属与金属或金属与非金属熔合而成,则合金含有非金属,如生铁含有碳元素,选项A正确;
B、铁在潮湿的环境中易发生电化学腐蚀,选项B不正确;
C、马口铁(镀锡)的表面一旦破损,构成原电池,铁做负极,铁的腐蚀加快,选项C正确;
D、硅是良好的半导体材料,用于制造太阳能电池,选项D正确;
答案选B。
11.B
【分析】
由图可知,N电极上H+得电子被还原成H2,M电极上H2失电子发生氧化反应生成H2O,则左边M电极是负极,右边N电极是正极。
【详解】
A. 根据以上分析,左边M电极是负极,右边N电极是正极,则电解质溶液中,由于阳离子向正极移动,所以Na+向右移动,故A错误;
B. 负极的电极反应式为H2-2e-+2OH-=2H2O,正极的电极反应式为2H++2e-=H2↑,所以总反应为H+ + OH- = H2O,故B正确;
C. 根据以上分析,左边M电极是负极,右边N电极是正极,所以电子由M电极经导线流向N电极,故C错误;
D. 由电池的总反应H+ + OH- = H2O可知,负极消耗的氢气等于正极产生的氢气,故D错误。
答案选B。
【点睛】
本题考查原电池工作原理,明确电极上得失电子及反应是解本题关键,注意掌握原电池两极及总反应式的书写方法,试题培养了学生的分析能力及灵活应用能力。
12.B
【解析】
试题分析:A、用镀锡铁做罐头盒,当镀层破坏后,铁是负极不能被保护,A项错误;B、用铜作电极电解稀硫酸,发生反应:Cu+H2SO4 CuSO4+H2↑,B项正确;C、电极材料分别为Mg和Al,电解质溶液是氢氧化钠时铝作负极,C项错误;D、某可逆反应升高温度,活化能大的方向化学反应速率增大程度大,D项错误;答案选B。
考点:考查化学反应与能量
13.B
【详解】
A.将炭粉和铁粉均匀混合,撒入内壁用稀醋酸溶液润湿过的具支试管中,发生析氢腐蚀,可以观察到右边试管中导气管口有气泡,A错误;
B.将炭粉和铁粉均匀混合,撒入内壁用氯化钠溶液润湿过的具支试管,发生吸氧腐蚀,具支试管中气体压强减小,可观察到导气管中形成一段水柱,B正确;
C. 将炭粉和铁粉均匀混合,撒入内壁用氯化钠溶液润湿过的具支试管,发生吸氧腐蚀,具支试管中气体压强减小,可观察到导气管中形成一段水柱,C错误;
D. 将炭粉和铁粉均匀混合,撒入内壁用稀醋酸溶液润湿过的具支试管中,发生析氢腐蚀,由于具支试管敞口,导气管中无明显现象,D错误;
答案选B。
14.C
【详解】
A.镀锌铁皮锌层厚度测定时,锌、铁和稀硫酸构成原电池,锌作负极,铁作正极,原电池能加快锌被腐蚀的速率。且只有铁时,不能构成原电池,反应速率会突然减小,所以,当反应速率突然减小,可以判断锌镀层已反应完全,A正确;
B.Fe3+是亲脂性强的成分,在流动相中分配的多一些,随流动相移动的速度快一些,而Cu2+是亲水性强的成分,在固定相中分配的多一些,随流动相移动的速度慢一些,从而使Fe3+和Cu2+得到分离,B正确;
C.分液时,如果先将上层液体从上口倒出,下层液体会和上层液体混合,应先将下层液体从下口放出,再将上层液体从上口倒出,C错误;
D.浓硫酸具有脱水性,可使白纸碳化而变黑,而稀硫酸不行,D正确。
答案选C。
15.B
【分析】
d极附近有黄绿色气体产生,说明Cl-在d极失电子得到Cl2,说明d极是阳极,b是正极,c是阴极,a是负极,据此解答。
【详解】
A.由分析可知,a是电源负极,A错误;
B.d极是阳极,阳极失电子,b极是电流的正极,正极得电子,所以电子流向是d→b,B正确;
C.c是阴极,得电子,化合价降低,发生还原反应,C错误;
D.c、d两电极互换,c电极为阳极,如果c是活性电极,则阳极材料失电子,Cl-不失电子,不产生黄绿色气体,D错误。
答案选B。
16.O2 H2-2e-+2OH-=2H2O 负 560
【分析】
甲是氢氧燃料电池,a为正极,则b为负极;乙装置是电解池,为惰性电极电解足量CuSO4溶液,电解时c电极上有红色固体物质析出,则c极为阴极,d极为阳极。
【详解】
(1)a为正极,b为负极,则从A口通入的气体是O2,B口通入的气体是氢气,b电极的电极反应式为H2-2e-+2OH-=2H2O;
(2)c极为阴极,则c电极通过导线与电源的负极相连;c电极发生反应,理论上当c电极析出3.20g红色固体时,即生成铜,d电极发生反应,由2Cu~O2,可得生成氧气物质的量0.025mol,则d电极表面产生的O2在标准状况下的体积为0.025mol×22.4L/mol=0.56L=560mL。
17. 碳 铁 4OH--4e-=2H2O+O2↑ 2Cl-+2H2OCl2↑+H2↑+2OH- 2H2O+O2+4e-=4OH- Cl2+2I- =I2+2Cl- 13
【解析】(1)①甲池为原电池,原电池中活泼金属做负极,发生氧化反应,碳棒做正极,有Cu析出,乙池为电解池,外电路电子流向电源正极,所以碳棒为阳极,放出氯气,阴极铁电极上发生还原反应有Cu析出,故答案为:碳;铁;
②乙为电解池,由电子流向可知,Fe为阴极,铜离子得到电子生成Cu,乙中阳极上氢氧根离子放电,电极反应为4OH--4e-=O2↑+2H2O,故答案为:4OH--4e-=O2↑+2H2O;
(2)①若电解质溶液为饱和氯化钠溶液,则乙池就是用惰性电极为阳极电解氯化钠溶液,方程式为:2Cl-+2H2OCl2↑+H2↑+2OH-,故答案为:2Cl-+2H2OCl2↑+H2↑+2OH-;
②甲池为铁的吸氧腐蚀,碳棒为正极,正极上氧气得电子发生还原反应,电极反应式为2H2O+O2+4e-=4OH-,故答案为:2H2O+O2+4e-=4OH-;
③将湿润的KI淀粉试纸放在乙池石墨电极附近,发现试纸变蓝,则石墨电极上氯离子失电子生成氯气,氯气和碘离子反应生成碘单质,碘遇淀粉试液变蓝色,反应的离子方程式为:Cl2+2I- =I2+2Cl-,故答案为:Cl2+2I- =I2+2Cl-;
④电解氯化钠溶液的方程式为:2NaCl+2H2OCl2↑+H2↑+2NaOH,乙池转移0.02mole-后,会生成0.02mol的氢氧化钠,所以所得NaOH溶液的物质的量浓度c===0.1mol/L,所以溶液中氢离子浓度==10-13mol/L,所以溶液的pH=13,故答案为:13。
点睛:本题考查了原电池和电解池原理,明确离子放电顺序是解本题的关键。本题的易错点为(2)②电极反应式的书写,要注意电解质溶液为饱和氯化钠溶液时,甲为铁的吸氧腐蚀。
18.正向移动 增大 不变 Al Al-3e-+4OH-=AlO2-+2H2O 牺牲阳极的阴极保护法
【分析】
(1)NH4Cl为强酸弱碱盐,其溶于水后,使溶液显酸性,可Mg(OH)2与电离出的氢氧根离子反应;温度未变,则Ksp不变;
(2)Al可与NaOH反应生成偏铝酸钠和氢气,而Mg不能,则Al作负极;
(3)锌比铁活泼,作原电池的负极。
【详解】
(1)NH4Cl为强酸弱碱盐,其溶于水后,使溶液显酸性,可Mg(OH)2与电离出的氢氧根离子反应,使Mg(OH)2的电离平衡正向移动;c(Mg2+)增大;温度未变,则Ksp不变;
(2)Al可与NaOH反应生成偏铝酸钠和氢气,而Mg不能,则Al作负极,则电极反应式为Al-3e-+4OH-=AlO2-+2H2O;
(3)锌比铁活泼,作原电池的负极,该保护方法为牺牲阳极的阴极保护法。
【点睛】
Ksp只与温度有关,温度未变,则Ksp不变。
19.锌 2H++2e-=H2↑ Zn+H2SO4=ZnSO4+H2↑ 锌 铜 Cu2++2e-=Cu CuSO4+Zn=ZnSO4+Cu
【详解】
(1)铜锌原电池,若稀硫酸做电解质溶液,锌较活泼作负极被氧化,所以发生氧化反应的是锌,铜极反应2H++2e-=H2↑,总反应:Zn+H2SO4=ZnSO4+H2↑。
(2)若电解质溶液为CuSO4,则电子由锌极流向铜极,铜极上反应为Cu2++2e-=Cu,电池总反应CuSO4+Zn=ZnSO4+Cu。
故答案为:(1)锌;2H++2e-=H2↑;Zn+H2SO4=ZnSO4+H2↑;(2)锌;铜;Cu2++2e-=Cu;CuSO4+Zn=ZnSO4+Cu。
20.Cu Pt(可填活泼性比铜弱的金属或导电的非金属材料) AD
【解析】
【分析】
原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,结合原电池的工作原理分析解答。
【详解】
(1)某反应中的反应物和生成物有FeCl3、FeCl2、Cu、CuCl2,则反应的方程式为2FeCl3+Cu=2FeCl2+CuCl2,反应中铜是还原剂,氯化铁是氧化剂,则该电池负极材料为Cu,负极反应式为Cu-2e-=Cu2+;
(2)正极材料应该是比铜不活泼的金属或能导电的非金属,可以为Pt等,该电池总的化学反应式为2FeCl3+Cu=2FeCl2+CuCl2;
(3)一段时间后负极质量减轻m g,即消耗铜是mg,则
A.消耗铜的物质的量是m/64 mol,铜失去2个电子,则电路中通过的电子为m/32 mol,A正确;
B.正极是铁离子得到电子转化为亚铁离子,正极质量不变,B错误;
C.原电池工作过程中电子由负极经导线流向正极,C错误;
D.原电池工作过程中阴离子Cl-向负极移动,D正确。
答案选AD。
鲁科版 (2019)选择性必修1第4节 金属的腐蚀与防护复习练习题: 这是一份鲁科版 (2019)选择性必修1第4节 金属的腐蚀与防护复习练习题,共14页。试卷主要包含了单选题,共15小题,非选择题,共5小题等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修1第4节 金属的腐蚀与防护同步练习题: 这是一份高中化学鲁科版 (2019)选择性必修1第4节 金属的腐蚀与防护同步练习题,共14页。试卷主要包含了单选题,共15小题,非选择题,共5小题等内容,欢迎下载使用。
化学选择性必修1第4节 金属的腐蚀与防护课后测评: 这是一份化学选择性必修1第4节 金属的腐蚀与防护课后测评,共16页。试卷主要包含了单选题,共15小题,非选择题,共5小题等内容,欢迎下载使用。













