
所属成套资源:2022届高三化学一轮复习实验专题强基练含解析
2022届高三化学一轮复习实验专题强基练27物质的检验新题速递含解析
展开
这是一份2022届高三化学一轮复习实验专题强基练27物质的检验新题速递含解析,共16页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。
物质的检验(新题速递)
一、单选题(共17题)
1.(2021·山东高三三模)实验室中下列做法正确的是
A.用无水CaCl2干燥NH3
B.用水鉴别苯和己烯
C.加热后的蒸发皿用坩埚钳移走
D.浓HNO3保存在带橡胶塞的棕色瓶中
2.(2021·广东高三一模)下列说法正确的是
A.将NH4Cl溶液蒸干制备NH4Cl固体
B.用KSCN溶液可检验FeCl3溶液中是否含FeCl2
C.酸式滴定管装标准溶液前,必须先用该溶液润洗
D.蒸馏实验中,沸腾前发现忘记加沸石,应立即补加
3.(2021·重庆高三二模)下列说法正确的是
A.金属氧化物均为碱性氧化物
B.用饱和溶液可鉴别乙酸乙酯、乙醇、乙酸
C.用红色石蕊试纸检测氨气时,试纸不能润湿
D.食醋清洗水垢的离子方程式为:
4.(2021·原阳县第三高级中学高二月考)检验下列物质所选用的试剂正确的是
待检验物质
所用试剂
A
食盐中的碘元素
淀粉溶液
B
Na2CO3溶液中的NaOH
酚酞溶液
C
有机废水中的酚类
FeCl3溶液
D
环己烯中的甲苯
酸性高锰酸钾溶液
A.A B.B C.C D.D
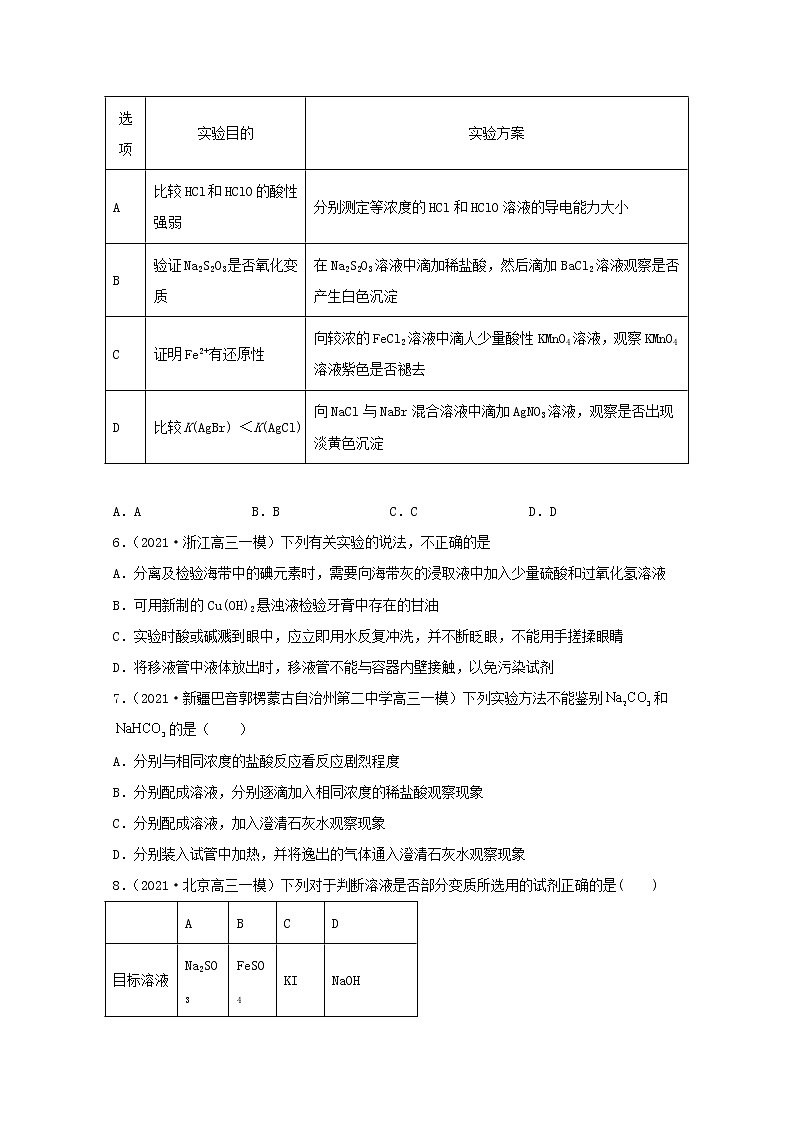
5.(2021·广西高三三模)下列实验方案中,能达到实验目的的是
选项
实验目的
实验方案
A
比较HCl和HClO的酸性强弱
分别测定等浓度的HCl和HClO溶液的导电能力大小
B
验证Na2S2O3是否氧化变质
在Na2S2O3溶液中滴加稀盐酸,然后滴加BaCl2溶液观察是否产生白色沉淀
C
证明Fe2+有还原性
向较浓的FeCl2溶液中滴人少量酸性KMnO4溶液,观察KMnO4溶液紫色是否褪去
D
比较K(AgBr) <K(AgCl)
向NaCl与NaBr混合溶液中滴加AgNO3溶液,观察是否出现淡黄色沉淀
A.A B.B C.C D.D
6.(2021·浙江高三一模)下列有关实验的说法,不正确的是
A.分离及检验海带中的碘元素时,需要向海带灰的浸取液中加入少量硫酸和过氧化氢溶液
B.可用新制的Cu(OH)2悬浊液检验牙膏中存在的甘油
C.实验时酸或碱溅到眼中,应立即用水反复冲洗,并不断眨眼,不能用手搓揉眼睛
D.将移液管中液体放出时,移液管不能与容器内壁接触,以免污染试剂
7.(2021·新疆巴音郭楞蒙古自治州第二中学高三一模)下列实验方法不能鉴别和的是( )
A.分别与相同浓度的盐酸反应看反应剧烈程度
B.分别配成溶液,分别逐滴加入相同浓度的稀盐酸观察现象
C.分别配成溶液,加入澄清石灰水观察现象
D.分别装入试管中加热,并将逸出的气体通入澄清石灰水观察现象
8.(2021·北京高三一模)下列对于判断溶液是否部分变质所选用的试剂正确的是( )
A
B
C
D
目标溶液
Na2SO3
FeSO4
KI
NaOH
选用试剂
BaCl2
KSCN
AgNO3
广泛pH试纸
A.A B.B C.C D.D
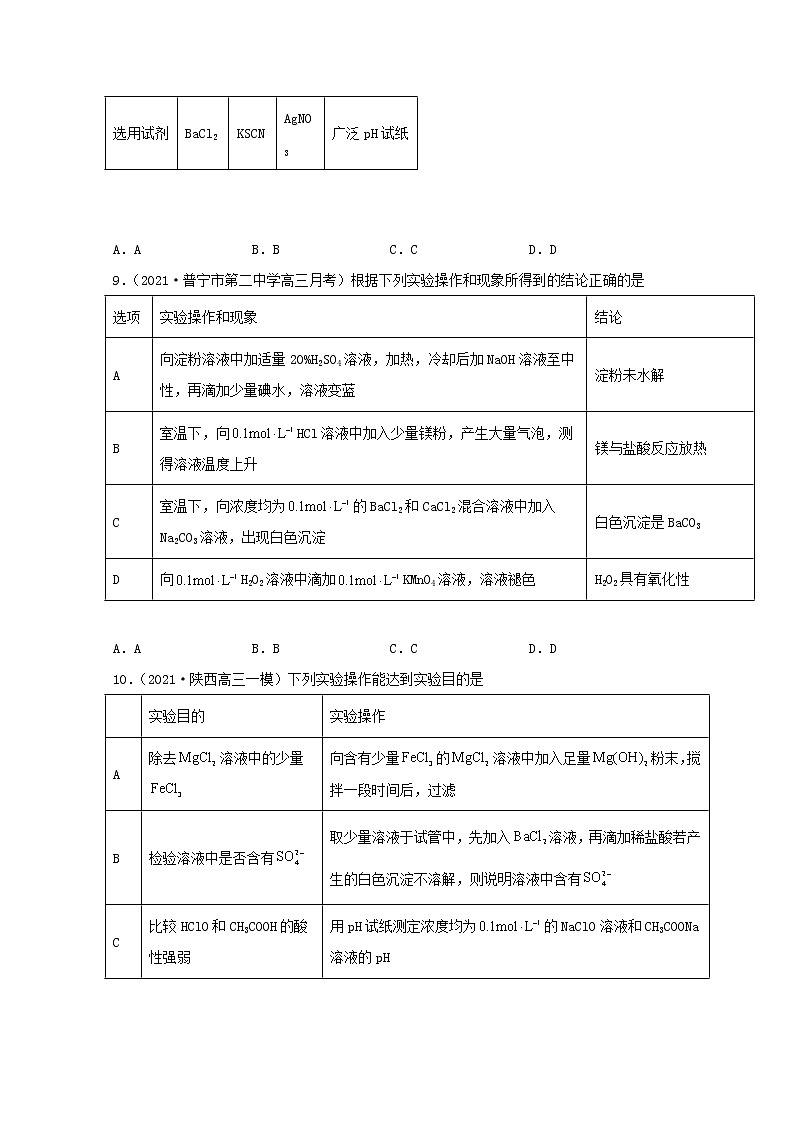
9.(2021·普宁市第二中学高三月考)根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
结论
A
向淀粉溶液中加适量20%H2SO4溶液,加热,冷却后加NaOH溶液至中性,再滴加少量碘水,溶液变蓝
淀粉未水解
B
室温下,向HCl溶液中加入少量镁粉,产生大量气泡,测得溶液温度上升
镁与盐酸反应放热
C
室温下,向浓度均为的BaCl2和CaCl2混合溶液中加入Na2CO3溶液,出现白色沉淀
白色沉淀是BaCO3
D
向H2O2溶液中滴加KMnO4溶液,溶液褪色
H2O2具有氧化性
A.A B.B C.C D.D
10.(2021·陕西高三一模)下列实验操作能达到实验目的是
实验目的
实验操作
A
除去溶液中的少量
向含有少量的溶液中加入足量粉末,搅拌一段时间后,过滤
B
检验溶液中是否含有
取少量溶液于试管中,先加入溶液,再滴加稀盐酸若产生的白色沉淀不溶解,则说明溶液中含有
C
比较HClO和CH3COOH的酸性强弱
用pH试纸测定浓度均为的NaClO溶液和CH3COONa溶液的pH
D
验证的氧化性比强
将硫酸酸化的滴入溶液,溶液变黄色
A.A B.B C.C D.D
11.(2021·河北石家庄二中高二其他模拟)使用哪组试剂,可鉴别在不同试剂瓶内的1-己烯、甲苯和丙醛
A.酸性KMnO4溶液和溴的CCl4溶液
B.银氨溶液和溴的CCl4溶液
C.FeCl3溶液和银氨溶液
D.银氨溶液和酸性KMnO4溶液
12.(2021·四川邻水实验学校高三开学考试)由下列实验操作及现象所得结论错误的是
实验操作及现象
结论
A
向酸性KMnO4溶液中滴加H2O2溶液,紫红色褪去
H2O2具有漂白性
B
向待测溶液中加入淀粉溶液,无明显变化,再加入新制氯水,变蓝
待测溶液中有I-存在
C
向Al2(SO4)3溶液中逐滴加入NaOH溶液至过量,先生成白色沉淀,后沉淀消失
Al(OH)3具有酸性
D
向AgCl悬浊液中,加入少量Na2S溶液,白色沉淀转化为黑色沉淀
Ag2S溶解度小于AgCl
A.A B.B C.C D.D
13.(2021·全国高三专题练习)下列实验操作、现象及结论均正确的是
选项
实验操作
现象
结论
A
向两支盛有溶液的试管中,分别滴加淀粉溶液和溶液
前者溶液变蓝,后者有黄色沉淀生成
溶液中含有和
B
将乙醇与浓硫酸的混合溶液加热,产生的气体直接通入酸性溶液中
溶液紫色逐渐褪去
产生的气体一定是乙烯
C
向溶液中滴加溶液
生成蓝色沉淀
的酸性比的强
D
将用稀硫酸酸化后的溶液滴入溶液中
溶液变黄
氧化性:
A.A B.B C.C D.D
14.(2021·上海高三一模)只使用待选试剂能完成元素检验的是
待检验元素
待选试剂
A
海带中的碘元素
淀粉溶液
B
CH3CH2Cl 中的氯元素
AgNO3 溶液
C
明矾中的铝元素
氢氧化钠溶液
D
FeSO4 中的铁元素
KSCN 溶液
A.A B.B C.C D.D
15.(2021·河北石家庄市·石家庄二中高一其他模拟)下列实验操作对应的现象和结论都正确的是
选项
实验操作
现象
结论
A
向某溶液中加入CaCl2溶液
产生白色沉淀
原溶液中一定含有
B
向某溶液中加入KSCN溶液
溶液变为血红色
原溶液中一定没有Fe2-
C
将氯水滴到红色纸条上
红色纸条褪色
氯水具有漂白性
D
向FeCl2溶液中滴入酸性KMnO4溶液
溶液褪色
Fe2+具有氧化性
A.A B.B C.C D.D
16.(2021·新疆高三其他模拟)下列由实验得出的结论正确的是
实验
结论
A
用小试管收集气体A做爆鸣实验,发现有爆鸣声
A一定是
B
某气体充入澄清石灰水中,有白色沉淀
气体一定是
C
对某溶液做焰色试验时,观察到黄色火焰
溶液中弈定含有,一定不含有
D
铁片投入到浓硫酸中,无现象
铁因钝化表面生成了氧化物保护膜
A.A B.B C.C D.D
17.(2021·辽宁高三其他模拟)常温下,溶液中可能含有下列离子中的若干种:、、、、、。现对X溶液进行如下实验,其现象和结果如图:
下列说法正确的是
A.X溶液的
B.X溶液中一定含有、、,不能确定是否含有
C.X溶液中一定含有,且为
D.向滤液中通入足量的气体,可得白色沉淀,将沉淀过滤、洗涤、灼烧至恒重,可得固体
二、填空题(共2题)
18.(2021·浙江高考真题)固体化合物X由3种元素组成,某学习小组开展如下探究实验。
其中,白色沉淀B能溶于NaOH溶液。请回答:
(1)白色固体C的化学式是_______,蓝色溶液D中含有的溶质是_______(用化学式表示)。
(2)化合物X的化学式是_______;化合物X的一价阴离子与CH4具有相同的空间结构,写出该阴离子的电子式_______。
(3)蓝色溶液A与作用,生成一种气体,溶液蓝色褪去,同时生成易溶于硝酸的白色沉淀。
①写出该反应的离子方程式_______。
②设计实验验证该白色沉淀的组成元素_______。
19.(2021·浙江高三其他模拟)为探究由三种短周期元素构成的化合物X(其中一种为金属元素)的组成和性质,某研究小组设计并完成了如下实验(步骤中所加试剂均过量)。
请回答下列问题:
(1)组成X的三种元素是___________,X的化学式是___________。
(2)X与足量NaOH溶液反应的化学方程式是___________。
(3)将溶液B加入到溶液A中会出现白色沉淀,该反应离子反应方程式为___________。
(4)常温下,将金属单质C投入到H2O2溶液中并加入少量稀H2SO4,观察到溶液变蓝色且一段时间后产生大量气泡,原因是___________。
(5)已知气体B中会混有另一物质C.请设计实验证明C的存在___________。
参考答案
1.C
【详解】
A.CaCl2能与氨分子结合成CaCl2∙8NH3,不能用氯化钙干燥氨气,故A错误;
B.苯和己烯均不与水反应,且均不溶于水,密度均比水小,加水后苯环己烯均在上层,不能用水鉴别,故B错误;
C.加热后的蒸发皿,因温度较高,需用坩埚钳移走置于石棉网上或者干燥器中进行干燥,故C正确;
D.浓硝酸具有强氧化性,能腐蚀橡胶,故不能用浓硝酸保存在棕色试剂瓶中,故D错误;
故选:C
2.C
【详解】
A. NH4Cl不稳定,将NH4Cl溶液蒸干,得不到NH4Cl固体,故A错误;
B. 用KSCN溶液可检验FeCl3溶液中是否含FeCl3,不能确定有无FeCl2,可滴加K3[Fe(CN)6]溶液,呈蓝色,故B错误;
C. 酸式滴定管装标准溶液前,必须先用该溶液润洗,确保所盛溶液浓度与标准溶液一致,故C正确;
D. 蒸馏实验中,沸腾前发现忘记加沸石,不能立即补加,防止液体已经达沸点而引起剧烈沸腾,冲出容器,应冷却到沸点以下,再加入沸石,故D错误;
故选C。
3.B
【详解】
A.有的金属氧化物是酸性氧化物,如七氧化锰是酸性氧化物,氧化铝是两性氧化物,A错误;
B.乙酸和碳酸钠反应生成气体,乙酸乙酯不溶于水饱和碳酸钠,分层,乙醇能溶于碳酸钠溶液,故现象不同,能鉴别,B正确;
C.氨气能使湿润的红色石蕊试纸变蓝,试纸必须湿润,C错误;
D.水垢是碳酸钙,不能拆成离子形式,D错误;
故选B。
4.C
【详解】
A.食盐中含碘元素的物质是KIO3,KIO3不能使淀粉变蓝,不能用淀粉检验食盐中的碘元素,故A错误;
B.Na2CO3、NaOH都能使酚酞溶液变红,不能用酚酞溶液检验Na2CO3溶液中的NaOH,故B错误;
C.酚类物质遇FeCl3溶液发生显色反应,可以用FeCl3溶液检验有机废水中的酚类,故C正确;
D.环己烯、甲苯都能使酸性高锰酸钾溶液褪色,不能用酸性高锰酸钾检验环己烯中的甲苯,故D错误;
答案选C。
5.A
【详解】
A.强酸、强碱属于强电解质,弱酸弱碱属于弱电解质,强电解质在溶液中完全电离,弱电解质在溶液中部分电离,等浓度的HCl和HClO溶液在溶液中的电离程度不同,电离程度大的,溶液中氢离子浓度大,导电能力强,酸性也就越强,则A能达到实验目的;
B.在Na2S2O3溶液中滴加盐酸会发生反应:Na2S2O3+2HCl═2NaCl+SO2↑+S↓+H2O,产生了大量的浅黄色浑浊,会对后续白色沉淀的观察产生影响,故B不能打到实验目的;
C.浓盐酸能与KMnO4反应,向较浓的FeCl2溶液加少量酸性KMnO4溶液,KMnO4溶液紫色褪去可能是与Cl-反应导致,无法证明Fe2+有还原性,故C不能打到实验目的;
D.向1L浓度均为0.1mol/LNaCl和NaBr混合溶液中滴加AgNO3溶液,先出现淡黄色沉淀,说明先生成了AgBr沉淀,即在浓度相同的前提下,溴离子优先于氯离子沉淀,所以Ksp(AgCl)>Ksp(AgBr),选项中未指明NaCl与NaBr浓度关系,不能比较二者Ksp,故D不能打到实验目的;
答案选A。
6.D
【详解】
A.在酸性条件下,双氧水能将碘离子氧化成单质碘,以便于分离或者检验,所以分离及检验海带中的碘元素时,需要向海带灰的浸取液中加入少量硫酸和过氧化氢溶液,故A不选;
B.新制的Cu(OH)2悬浊液可以于甘油反应形成绛蓝色溶液,故B不选;
C.实验时酸或碱溅到眼中,应立即用水反复冲洗,并不断眨眼,不能用手搓揉眼睛,以减小酸或碱对眼睛的伤害,故C不选;
D.将移液管中液体放出时,移液管应应该与管壁接触才可以放尽液体,故D错误。
答案选D。
7.C
【详解】
A.和与相同浓度的盐酸反应时,的反应更剧烈,可鉴别,A项正确;
B.分别配成溶液,滴加稀盐酸,马上产生气体的是溶液,过一会放出气体的为溶液,可以鉴别,B项正确;
C.分别配成和溶液,均能和澄清石灰水反应产生白色沉淀,故不能鉴别,C项错误;
D.加热分解放出,与澄清石灰水反应生成白色沉淀,加热不易分解,澄清石灰水不变浑浊,可以鉴别,D项正确;
故选C。
8.B
【详解】
A.Na2SO3、Na2SO4都能与BaCl2反应生成白色沉淀,BaCl2溶液不能判断Na2SO3溶液是否部分变质,故不选A;
B.KSCN 溶液遇Fe2+不变红,KSCN 溶液遇Fe3+变红,KSCN溶液能判断FeSO4溶液是否部分变质,故选B;
C.KI、I2都能与AgNO3溶液反应生成黄色AgI沉淀,AgNO3溶液不能判断KI溶液是否部分变质,故不选C;
D.NaOH、Na2CO3溶液都呈碱性,广泛pH试纸不能判断NaOH溶液是否部分变质,故不选D;
选B。
9.B
【详解】
A .加入碘水后,溶液呈蓝色,只能说明溶液中含有淀粉,并不能说明淀粉是否发生了水解反应,故A错误;
B.加入盐酸后,产生大量气泡,说明镁与盐酸发生化学反应,此时溶液温度上升,可证明镁与盐酸反应放热,故B正确;
C.BaCl2、CaCl2均能与Na2CO3反应,反应产生了白色沉淀,沉淀可能为BaCO3或CaCO3或二者混合物,故C错误;
D.向H2O2溶液中加入高锰酸钾后,发生化学反应2KMnO4+3H2O2=2MnO2+2KOH+2H2O+3O2↑等(中性条件),该反应中H2O2被氧化,体现出还原性,故D错误;
综上所述,故答案为:B。
【点睛】
淀粉在稀硫酸作催化剂下的水解程度确定试验较为典型,一般分三种考法:①淀粉未发生水解:向充分反应后的溶液中加入碘单质,溶液变蓝,然后加入过量氢氧化钠溶液使溶液呈碱性,然后加入新制氢氧化铜溶液并加热,未生成砖红色沉淀;②淀粉部分发生水解:向充分反应后的溶液中加入碘单质,溶液变蓝,然后加入过量氢氧化钠溶液使溶液呈碱性,然后加入新制氢氧化铜溶液并加热,生成砖红色沉淀;③向充分反应后的溶液中加入碘单质,溶液不变蓝,然后加入过量氢氧化钠溶液使溶液呈碱性,然后加入新制氢氧化铜溶液并加热,生成砖红色沉淀。此实验中需要注意:①碘单质需在加入氢氧化钠溶液之前加入,否则氢氧化钠与碘单质反应,不能完成淀粉的检验;②酸性水解后的溶液需要加入氢氧化钠溶液碱化,否则无法完成葡萄糖的检验;③利用新制氢氧化铜溶液或银氨溶液检验葡萄糖试验中,均需要加热,银镜反应一般为水浴加热。
10.A
【详解】
促进铁离子水解转化为沉淀,则反应后过滤可分离,故A正确;
B.先加入溶液,可生成AgCl沉淀或硫酸钡沉淀,不能确定是否含硫酸根离子,故B错误;
C.NaClO溶液具有漂白性,不能选pH试纸测定pH,故C错误;
D.酸性条件下亚铁离子、硝酸根离子发生氧化还原反应,不能说明的氧化性比强,故D错误;
答案选A。
11.B
【详解】
A.酸性KMnO4溶液与上述三种物质均发生反应而褪色,溴的CCl4溶液仅可鉴别出1-己烯,A项错误;
B.银氨溶液可鉴别出丙醛,而溴的CCl4溶液可鉴别出1-己烯,均不反应的为甲苯,B项正确;
C.只有银氨溶液可以鉴别出丙醛,C项错误;
D.用银氨溶液鉴别出丙醛后,另外两种均可与KMnO4酸性溶液反应,使其褪色,无法鉴别,D项错误;
选B。
12.A
【详解】
A.有机色质褪色为漂白,酸性KMnO4溶液和H2O2溶液发生氧化还原反应而使紫红色褪去,表明H2O2具有还原性,A错误;
B.碘分子与淀粉反应显蓝色,待测溶液中加入淀粉溶液,无明显变化,再加入新制氯水,变蓝,说明加入氯水后生成了碘单质,则原待测液中有I-存在,B正确;
C.向Al2(SO4)3溶液中逐滴加入NaOH溶液发生复分解反应生成了氢氧化铝白色沉淀,继续加过量氢氧化钠溶液,沉淀消失,则氢氧化铝和氢氧化钠溶液反应生成了偏铝酸钠和水,Al(OH)3具有酸性,C正确;
D.向AgCl悬浊液中,加入少量Na2S溶液,白色沉淀转化为黑色沉淀,即AgCl转变为Ag2S,可见 ,由于加入的Na2S少量,则可推测Ag2S溶解度小于AgCl ,D正确;
答案选A。
13.A
【详解】
A.碘单质遇淀粉溶液变蓝,溶液遇到碘离子有黄色沉淀碘化银生成,则溶液中含有和,A正确;
B.乙醇、乙烯均能使酸性溶液褪色,乙醇有挥发性,故不能说明使高锰酸钾溶液褪色的是乙烯,B错误;
C.向溶液中滴加溶液生成黑色沉淀硫化铜、因为硫化铜极难溶于水、不溶于酸,不能说明的酸性比的强,C错误;
D.硝酸根离子在酸溶液中有强氧化性,故不能说明亚铁离子被过氧化氢氧化成铁离子,不能证明氧化性:, D错误;
答案选A。
14.C
【详解】
A.碘单质与淀粉相遇,变为蓝色,碘离子不具有此性质,不能完成元素检验,故A不选;
B.一氯乙烷属于共价分子,不存在自由移动的氯离子,加入硝酸银溶液,不会有白色沉淀产生,不能完成元素检验,故B不选;
C.明矾中含有铝离子,逐滴加入氢氧化钠溶液直至过量,铝离子与氢氧化钠先生成氢氧化铝白色沉淀,碱过量,氢氧化铝溶于过量的强碱,变为溶液,看到的现象为:先有白色沉淀,后沉淀消失,可以检验铝元素的存在,故C可选;
D.铁离子与硫氰根离子反应生成血红色络合物,亚铁离子与硫氰根离子相遇没有此现象,不能完成铁元素的检验,故D不选;
故选C。
15.C
【详解】
A.原溶液可能含有银离子,A错误;
B.溶液中含有铁离子,不能确定是否含有亚铁离子,B错误;
C.氯水能使红色纸条褪色说明其具有漂白性,C正确;
D.实验说明亚铁离子或氯离子具有还原性,D错误;
故选C。
16.D
【详解】
A.有爆鸣声说明 是易燃易爆气体,除了H2,甲烷、乙烯等都是易燃易爆气体,在使用前都要验纯,A项不符合题意;
B.SO2是酸性氧化物,通入澄清石灰水中也能得到白色沉淀CaSO3,B项不符合题意;
C.K+的焰色试验需透过蓝色钴玻璃来观察,因为Na元素的黄色有遮盖作用,在该试验中,K+无法确定,C项不符合题意;
D.常温条件下,浓硫酸与Fe可以发生钝化,形成之谜的氧化物薄膜,阻止反应的进一步进行,D项符合题意;
故正确选项为D
17.C
【分析】
加入NaOH有刺激性气体生成,为NH3,说明X溶液中含有,n()=n(NH3)=V/Vm=0.224L/22.4L/mol=0.01mol,产生白色沉淀,则含有不含,n(Mg2+)=n(Mg(OH)2)=m/M=1.16g/58g/mol=0.02mol,由滤液稀释后氢氧根离子浓度,可知氢氧化钠有剩余,反应消耗NaOH为:0.025L×4.00mol/L-0.1L×0.1mol/L=0.09mol,则与Al3+反应的NaOH为0.09-0.01-0.02×2=0.04mol,则n(Al3+)=0.01mol;加入BaCl2产生白色沉淀,则含有,n()=n(BaSO4)=m/M=2.33g/233g/mol=0.01mol,由溶液呈电中性,n(+)=0.01×1+0.02×2+0.01×3=0.08mol,n(-)=0.01×2=0.02mol,则一定含有Cl-,且n(Cl-)=0.06mol;
【详解】
分析知,一定存在:、、Al3+、Cl-、,一定不存在:,
A.溶液中存在、Al3+发生水解而溶液呈酸性,即pH
相关试卷
这是一份2022届高三化学一轮复习实验专题强基练25物质的检验含解析,共18页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。
这是一份2022届高三化学一轮复习实验专题强基练3物质的性质实验探究新题快练含解析,共35页。试卷主要包含了亚硝酸钠是一种常见的食品添加剂等内容,欢迎下载使用。
这是一份2022届高三化学一轮复习实验专题强基练32物质的检验实验装置题含解析,共21页。试卷主要包含了单选题,实验题等内容,欢迎下载使用。









