






苏教版选修4 化学反应原理第四单元 沉淀溶解平衡集体备课ppt课件
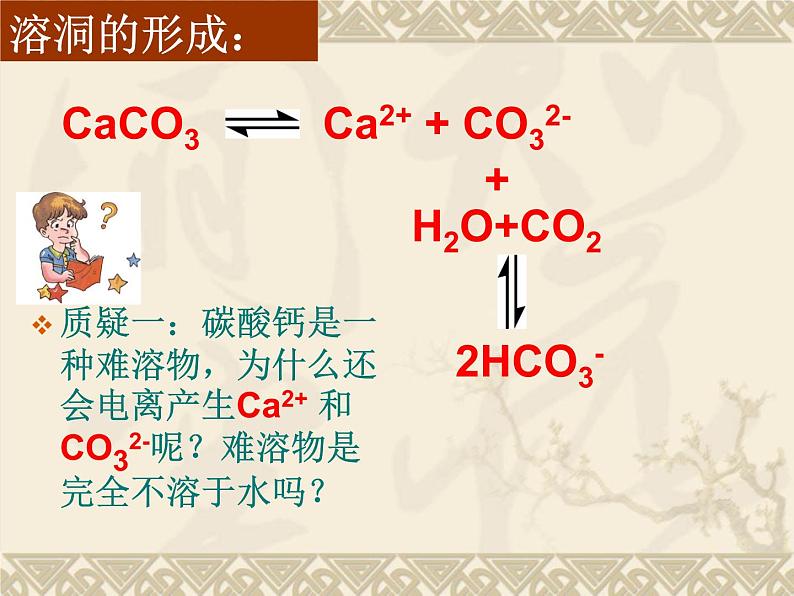
展开当我们外出旅游,沉醉于秀美的湖光山色时,一定会惊叹大自然的鬼斧神工。石灰石岩层在经历了数万年的岁月侵蚀之后,会形成各种奇形异状的溶洞。你知道它是如何形成的吗?
质疑一:碳酸钙是一种难溶物,为什么还会电离产生Ca2+ 和CO32-呢?难溶物是完全不溶于水吗?
大于10g,易溶1g~10g,可溶0.01g~1g,微溶小于0.01g,难溶
实验操作1.将少量PbI2加入盛有一定量水的50mL烧杯中,用玻璃棒充分搅拌,静置一段时间。2.取上层清液少量加入试管中,逐滴加入硝酸银溶液,振荡,观察现象。
质疑二:上述实验现象又为什么能发生呢?
25℃时,AgCl的溶解度为1.5×10-4g
1. 生成沉淀的离子反应能发生的原因?
AgCl溶解度虽然很小,但并不是绝对不溶,生成AgCl沉淀也有极少量的溶解。
思考以下问题(可与同桌讨论)
2. 沉淀是绝对不溶于水吗?
3、在上述可逆反应中,我们把正反应的速率(v正)看成AgCl的溶解过程,正反应速率(v逆)看成Ag+和Cl-结合成AgCl的过程,那么,请大家画出将AgCl固体投入水中后,v正和v逆随时间的变化曲线。(独立完成后展示)
试通过这个图像和课本上的内容,归纳总结出沉淀溶解平衡的形成过程。
一定温度下,将AgCl溶于水中,当v(溶解)=v(沉淀)时,得到饱和AgCl溶液,建立溶解平衡
外界条件一定,溶液中各粒子的浓度保持不变
外界条件改变,溶解平衡发生移动。
根据我们前面所学的知识,请同学们归纳出溶解平衡的特征 。(独立思考,自主回答。)
1、下列有关AgCl的说法正确的是( ) A. AgCl难溶于水,溶液中没有Ag+和Cl— B. 在AgCl饱和溶液中,AgCl没有再溶解了 C. AgCl是一种难溶物,所以是弱电解质 D.在AgCl饱和溶液中,AgCl生成和溶解不 断进行,但速率相等。
二、影响沉淀溶解平衡的条件
想一想:我们学过哪些因素能够影响化学平衡,其中哪一些会对沉淀溶解平衡有影响呢?
温度升高,多数溶解平衡向溶解方向移动。
加入相同的离子,向生成沉淀的方向移动
2.石灰乳中存在下列平衡:Ca(OH)2(s) Ca2+(aq)+2 OH― (aq),加入下列溶液,可使Ca(OH)2减少的是( )A. Na2CO3溶液 B. AlCl3溶液 C. NaOH溶液 D. CaCl2溶液
习惯上,把溶解度小于0.01g的电解质称作难溶电解质
难溶电解质与易溶电解质之间并无严格的界限。而且对于常量化学来说,0.01g已是个非常小的量。所以通常情况下,当离子之间反应生成难溶电解质,可以认为反应已经完全。
如:AgCl、AgBr、AgI、Ag2S、BaSO4、BaCO3、Fe(OH)3、Mg(OH)2等。
试模仿化学平衡常数写出该反应的平衡常数。
写出饱和CaCO3溶液中的溶解平衡表达式(独立完成后展示。)
1、定义:2、符号:3、意义:
用于描述难溶电解质在水中的沉淀溶解平衡的平衡常数。
反映了难溶电解质在水中的溶解能力;阴离子和阳离子个数比相同的物质, Ksp数值越大,难溶电解质在水中的溶解能力越强。
常见难溶电解质的浓度积常数和溶解度(25℃)
想一想:有人说Ksp越小,其物质的溶解度 就越小,你认为正确吗?
只与难溶电解质本身的性质和温度有关。与溶液浓度无关。
Ksp = cm(An+)cn(Bm-)
3、下列说法正确的是( ) A.在一定温度下AgCl水溶液中,Ag+和Cl-浓度的 乘积是一个常数; B.AgCl的Ksp=1.8×10-10 ml·L-1,在任何含 AgCl固体的溶液中,c(Ag+)=c(Cl-)且Ag+与Cl- 浓度的乘积等于1.8×10-10 ml·L-1; C.温度一定时,当溶液中Ag+和Cl-浓度的乘积等于 Ksp值时,此溶液为AgCl的饱和溶液; D.向饱和AgCl水溶液中加入盐酸,Ksp值变大。
利用Ksp判断深沉的溶解与生成(独立完成后与同桌交流)例1:将等体积4×10-3ml/L的AgNO3溶液和4×10-3ml/L的K2CrO4溶液混合,是否析出Ag2CrO4沉淀?[已Ksp(Ag2CrO4)=9.0×10-12]
答案:等体积混合后, c 2(Ag+) ×c(CrO42-)=[(4×10-3)/2 ]2×(4×10-3)/2 = 8×10-9 > 9.0×10-12 ,所以有析出Ag2CrO4沉淀。
溶度积规则利用Ksp判断深沉的溶解与生成 ①离子积
Q >Ksp 时,(2) Q = Ksp 时,(3)Q < Ksp 时,
沉淀从溶液中析出(溶液过饱和),体系中不断析出沉淀,直至达到平衡
溶液不饱和,若体系中有沉淀,则沉淀会溶解直至达到平衡。
4.在100mL 0.01ml/LKCl 溶液中,加入 1mL 0.01ml/L AgNO3 溶液,下列说法正确的是( ) (AgCl KSP=1.8×10-10) A.有AgCl沉淀析出 B. 无AgCl沉淀 C. 无法确定 D. 有沉淀但不是AgCl
5、下列情况下,有无CaCO3沉淀生成?(1)往盛有1.0 L纯水中加入0.1 mL浓度为0.01 ml /L 的CaCl2和Na2CO3;(2)改变CaCl2和Na2CO3的浓度为1.0 ml /L 呢?
[Ca2+] = [CO32-] = 0.110-3 0.01/1.0 = 10-6 ml /L Q= [Ca2+]×[CO32-] = 10-12 < Ksp,CaCO3=4.96 10-9 因此无 CaCO3沉淀生成。
[Ca2+]×[CO32-] = 10-4 ml /L Q = [Ca2+]×[CO32-] = 10-8 > Ksp,CaCO3 因此有CaCO3沉淀生成。
例2、已知Ksp,AgCl= 1.56 10-10, 试求AgCl溶解度(用g/L表示)
2.利用Ksp计算难溶物的溶解度
人教版 (2019)选择性必修1第四节 沉淀溶解平衡背景图ppt课件: 这是一份人教版 (2019)选择性必修1第四节 沉淀溶解平衡背景图ppt课件,共15页。
高中人教版 (2019)第三章 水溶液中的离子反应与平衡第四节 沉淀溶解平衡精品ppt课件: 这是一份高中人教版 (2019)第三章 水溶液中的离子反应与平衡第四节 沉淀溶解平衡精品ppt课件,共34页。PPT课件主要包含了温故知新,什么是饱和溶液,饱和NaCl溶液,思考得到什么启示,思考与讨论,离子浓度,随堂一练,溶度积常数等内容,欢迎下载使用。
2023届高中化学一轮复习课件:难溶电解质的沉淀溶解平衡: 这是一份2023届高中化学一轮复习课件:难溶电解质的沉淀溶解平衡,共49页。PPT课件主要包含了沉淀和溶解,沉淀溶解,生成沉淀,沉淀溶解平衡,考点溶度积及其应用,浓度幂,-4g,05×10-6等内容,欢迎下载使用。













