

2022年最新人教版九年级化学下册第九单元溶液期中考试卷【通用】
展开
这是一份2022年最新人教版九年级化学下册第九单元溶液期中考试卷【通用】,共13页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。
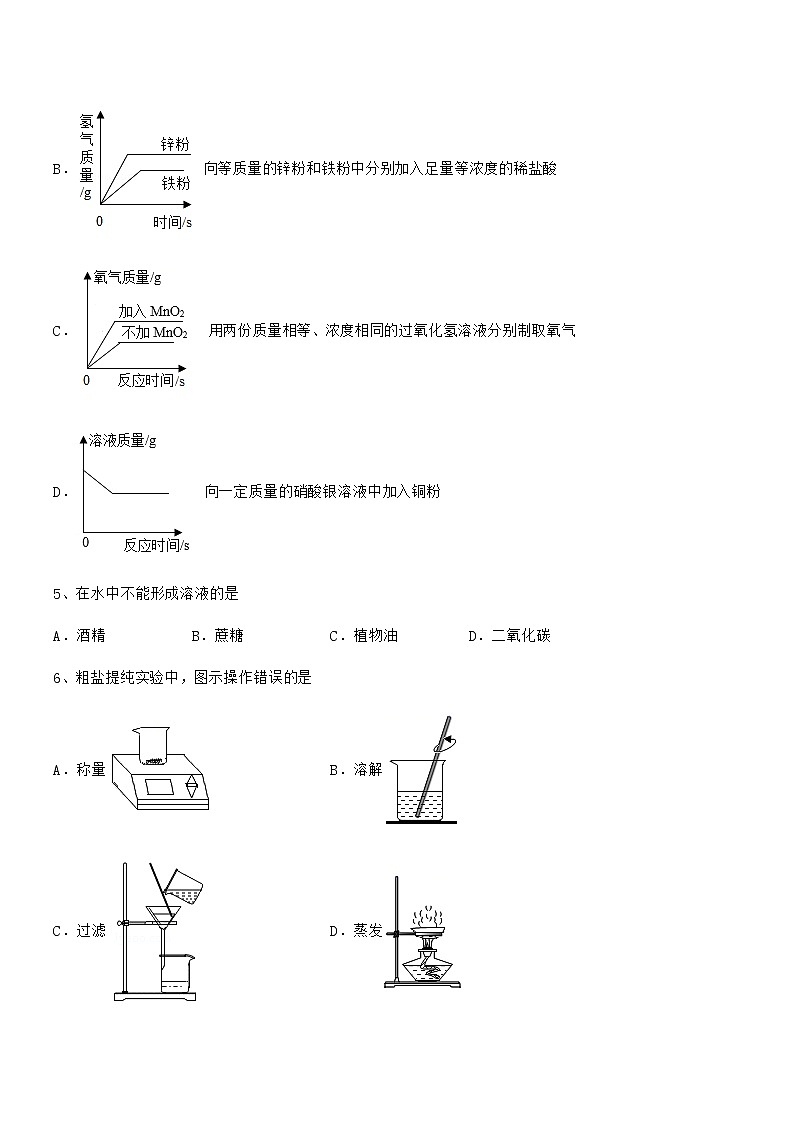
最新人教版九年级化学下册第九单元溶液期中考试卷【通用】(考试时间:90分钟,总分100分)班级:__________ 姓名:__________ 分数:__________一、单选题(每小题3分,共计24分)1、水是生活中常见的重要物质,下列说法正确的是A.实验必须:溶剂一定是水B.生活常识:油锅着火用水来扑灭C.人体必需:水是人体中含量最多的物质D.实验认识:电解水说明了水是由氢气和氧气组成的2、打卤面是山西的一种传统面食,调料“卤”的做法是将各种食材、调味品加入水中熬煮而成,下列物质加入水中,能得到溶液的是A.木耳 B.韭菜 C.鸡蛋 D.食盐3、某温度下有一杯饱和的硝酸钾溶液,欲使其溶质的质量分数发生改变,下列操作可行的是A.加入一定质量的硝酸钾晶体 B.升高温度C.降低温度 D.恒温蒸发溶剂4、下列反应或过程所对应的图像正确的是A. 电解一定质量的水B. 向等质量的锌粉和铁粉中分别加入足量等浓度的稀盐酸C. 用两份质量相等、浓度相同的过氧化氢溶液分别制取氧气D. 向一定质量的硝酸银溶液中加入铜粉5、在水中不能形成溶液的是A.酒精 B.蔗糖 C.植物油 D.二氧化碳6、粗盐提纯实验中,图示操作错误的是A.称量 B.溶解C.过滤 D.蒸发7、发生结晶现象的溶液,一定是A.浓溶液 B.稀溶液 C.饱和溶液 D.不饱和溶液8、如图是甲、乙、丙三种物质的溶解度曲线,下列叙述正确的是A.t1℃时,甲、乙、丙三种物质的溶解度大小顺序为:甲>乙>丙B.t2℃时,甲、丙溶液的溶质质量分数相同C.分别将三种物质的饱和溶液从t3℃降温至t2℃时,溶液仍然是饱和溶液D.采取向溶液中加入适量甲物质的方法,可将组成在N点的甲溶液转变为M点的甲溶液二、填空题(每小题4分,共计20分)1、下列是MgSO4和KC1的溶解度表及溶解度曲线。温度/℃2030405060708090溶解度/gMgSO433.738.944.550.654.655.852.952.2KC1.34.037.040.042.645.548.351.154.0请分析后回答下列问题:(1)代表KCl溶解度曲线的是__________(填“甲”或“乙”)。(2)t3℃时,等质量的两种物质饱和溶液,均降温到t1℃,析出晶体质量关系甲__________乙(填“>”“<”或“无法确定”).(3)t2℃的范围为 (填字母)。A.30-40 B.40-50 C.70-80 D.80-90(4)t3℃时MgSO4的饱和溶液降温到t1℃,溶液中溶质的质量分数的变化情况是 (填字母)。A.始终不变 B.先增大后减小 C.先减小后增大 D.先不变后减小 E.先不变后增大2、如图是A、B、C三种物质的溶解度随温度变化的曲线图,根据图示回答:(1)随温度升高,三种物质中溶解度变化最大的是______(填字母)。(2)t4℃时,A、B、C三种物质的溶解度由大到小的顺序是______。(3)t4℃时,从混有C物质的A溶液中得到A物质的结晶方法是______。(4)t4℃时,B的饱和溶液的质量分数为______。3、不小心新衣服上沾上了油污,也可以用汽油洗,原因______。可以用______清除掉油污,原理______。4、 “20℃ NaCl的溶解度为36g”的含义:(1)20℃时,100g水中最多可溶解NaCl___________。(2)20℃时,36g NaCl完全溶解___________需要___________水。(3)20℃时,36g NaCl和100g水恰好形成饱和溶液,其质量为___________。(4)20℃时,136g饱和NaCl溶液中含有NaCl___________,水___________。(5)36g NaCl和100g水形成饱和溶液时,温度为___________。5、如表是氯化钠和硝酸钾在不同温度下的溶解度,运用溶解度表与溶解度曲线回答下列问题:温度/℃10305060溶解度/g氯化钠35.836.337.037.3硝酸钾20.945.885.5110(1)图中能表示氯化钠的溶解度曲线是______(选填“A”或“B”),P点表示的含义是______。(2)据表格可知,氯化钠和硝酸钾两物质溶解度相等的温度范围在______℃之间。(3)60℃时,100g水中加入90g硝酸钾,充分溶解,所得溶液是______(填“饱和”或“不饱和”)溶液。将该溶液降温到10℃时,析出晶体的质量为______g。(4)60℃时,用等质量的氯化钠、硝酸钾分别配制两种饱和溶液,测得其质量依次为m1g和m2g,则m1______m2(填或“>”、“<”“=”)。三、计算题(每小题4分,共计36分)1、 “石头纸”是用沿海水产养殖中大量废弃贝壳制得的。为测定其中碳酸钙(杂质不溶于水也不与水反应)的含量,某同学进行了如下实验。取25.0 g样品粉碎放入烧杯中,加入一定质量分数的稀盐酸,所加稀盐酸的质量与生成气体的质量关系如图所示。(1)根据图示观察,生成气体的质量是______克。(2)计算“石头纸”中碳酸钙的质量分数。(3)此稀盐酸的溶质质量分数?(4)完全反应后烧杯内溶液的溶质质量分数是多少?(结果精确到0.1%)2、我国第一艘国产航母的许多电子元件使用了黄铜(假设合金中仅含铜,锌),兴趣小组同学向盛有30g黄铜样品的烧杯中逐渐加入稀硫酸,生成氢的质量与加入稀硫酸的质量关系如图所示,计算:(1)充分反应后生成氢气的质量为___________g。(2)硫酸溶液中溶质的质量分数。3、回答下列问题(1)800kg质量分数为0.5%的过氧乙酸消毒液中,过氧乙酸的质量为_____kg。(2)要配制800kg质量分数为0.5%的过氧乙酸消毒液,需质量分数为16%的过氧乙酸溶液的质量是多少?4、某化学兴趣小组取部分变质的 Ca(OH)2(含杂质 CaCO3)样品8.0g投入200.0g水中,充分搅拌,通入足量CO2,溶质质量与反应的 CO2质量的关系如图所示。[提示:CaCO3+H2O+CO2=Ca(HCO3)2,Ca(HCO3)2能溶于水](1)Ca(OH)2全部转化为CaCO3时消耗的CO2 质量为______g。(2)8.0g样品中杂质CaCO3 的质量为多少?(3)通入 m3g CO2时,溶液中溶质的质量为多少?5、根据所学知识回答下列问题:(1)要配置质量分数为4%的氯化钠溶液100g来选种,需要氯化钠的质量为___________,水的质量为___________。(2)如果对100g 4%的NaCl溶液进行如下处理,求所得溶液中溶质质量分数。(假设每次增加的溶质皆完全溶解。以下各题要求写出计算过程,结果精确到0.1%)①蒸发10g水,所得溶液的溶质质量分数是多少?___________②增加5g氯化钠后,所得溶液的溶质质量分数是多少?___________③增加5g氯化钠和5g水后,所得溶液的溶质质量分数是多少?___________6、化学课外活动小组为了测定黄铜中锌的含量(黄铜是铜锌合金),进行了如图所示实验。 请根据图示的实验过程和数据进行计算。(1)样品中锌的质量分数为 ___________。(2)生产氢气的质量。(3)恰好完全反应后所得溶液中溶质的质量分数。(精确到 0.1%)7、为测定一瓶久置过氧化氢溶液的溶质质量分数,实验操作如图1所示,电子天平示数如图2所示。请计算:(1)完全反应后生成氧气的质量为______。(2)该过氧化氢溶液中溶质的质量分数。8、为了测定石灰石中碳酸钙的质量分数(杂质不含钙元素,不溶于水,也不与其他物质发生反应),进行了如下实验。请回答下列问题。(1)上述实验过程中发生反应的化学方程式为_________。(2)此石灰石中碳酸钙的质量分数为__________。(3)若向反应后的滤液中加入 10.8g 水,则所得溶液中溶质的质量分数为__________。9、某化学兴趣小组为了测定某黄铜(铜、锌合金)样品中锌的组成,取黄铜样品50g放入锥形瓶中,向其中分5次共加入250克稀硫酸,测得数据记录如下表:1第1次第2次第3次第4次第5次累计加入稀硫酸的质量/g50100150200250累计产生气体的质量/g0.2m0.60.70.7(1)表中m=______g;(2)黄铜样品中铜的质量分数______;(3)求所用稀硫酸中溶质的质量分数?(写出计算过程)四、实验探究(每小题5分,共计20分)1、根据下列实验回答问题:(1)某化学兴趣小组欲配制49g20%的稀硫酸来进行实验,他们需要用到98%的浓硫酸的质量是 ___ g。(2)如图A所示,把配制好的溶液装入试剂瓶中,贴上标签,则标签上的空白处应填写的是 ___ 。(3)图B是稀释浓硫酸的操作,玻璃棒的作用是 ___ 。(4)图C是验证银(Ag)、铂(Pt)、钯(Pd)三种金属的活动顺序,一段时间后取出,发现只有银戒指表面有明显变化,通过该实验判断,银、铂、钯的金属活动性由强到弱顺序为 ___ ,其中发生反应的基本类型为 ___ 。2、氢氧化铜固体受热分解能得到两种氧化物,一种为固体,另一种是无色液体。某化学活动小组为确定这种固体产物是什么,进行了如下探究活动。《假设》:生成的固体产物 ①可能是氧化亚铜(Cu2O)(红色) ;②可能是 ___________ 。《设计实验》:小明用氢氧化钠溶液与硫酸铜溶液反应制得氢氧化铜,放入试管中,使其在加热条件下分解(如下图),观察到蓝色粉末逐渐变成黑色。请指出仪器名称:a ___________ ,b ___________ 。《推测结论》:猜想 ______ 成立。《形成结论》:写出氢氧化铜受热分解的化学方程式: _______________________________ 。《查阅资料》知:(1)此黑色固体可用氢气还原,则小明选择下列 ________ 装置进行实验;(2)已知Cu2O有如下性质:Cu2O+H2SO4=Cu+CuSO4+H2O ,在用氢气还原黑色固体后得到的铜中常混有少量Cu2O,取此Cu和Cu2O的混合物共10g放入足量的稀硫酸中充分反应, 过滤得9.5g固体,则此混合物中Cu2O的质量分数为 ________ 。《拓展与思考》:小华也用氢氧化钠溶液与硫酸铜溶液反应,但得到的沉淀不呈蓝色,而是浅绿色的;他又将此浊液加热直至沸腾,观察不到有分解变黑的迹象。为什么?小华查找资料得知,该浅绿色沉淀物是溶解度极小的碱式硫酸铜,其化学式为Cu4(OH)6SO4,同时还生成硫酸钠;此浅绿色沉淀能与酸反应,形成蓝色溶液。则碱式硫酸铜中铜元素的化合价为 ______ ,请帮小华写出生成浅绿色沉淀的有关反应的化学方程式: _________________ 。小华想设计一个实验,证明该浅绿色沉淀中含有硫酸根, 于是将沉淀过滤、洗涤,把沉淀再溶解在足量的无色溶液A中,取所得溶液滴加无色溶液B,若有大量白色沉淀生成,则表示原浅绿色沉淀中有SO,试推测:(1)无色溶液A的化学式是 _______ ,无色溶液B的化学式是 ____ ;(2)写出产生白色溶液的化学方程式 _______ 。3、某学习小组的三位同学为测定镀锌铁皮的锌镀层的厚度,提出了各自的设计方案。(忽略锌镀层的氧化)(1)甲同学的方案是先用盐酸将镀锌铁皮表面的锌反应掉,通过差量计算出锌的质量,然后再由锌的密度算出锌层的体积,最后由体积除以镀锌铁皮的面积计算得到锌层的厚度。在实际操作中,甲同学的方案存在一个很大的问题是_________。(2)乙同学是通过查阅资料,知道Zn(OH)2既可以与酸也可与碱反应,于是设计了如下方案:配制5%的盐酸1 L (ρ=1.025g/cm3),需取用36.5%(ρ=1.181g/cm3)的盐酸_______mL(保留一位小数)。配制过程中用到的玻璃仪器,除烧杯外,还有_____________。步骤③的操作是______。若使用的镀锌铁皮的质量为28.156 g,最后称得灼烧后固体的质量为40.000g,镀锌铁皮的长5.10cm,宽5.00cm,锌的密度为7.14 g/cm3,则锌层的厚度为____________。(3)丙同学的方案是通过如图所示装置,测量镀锌铁皮与强酸反应产生气体的质量来计算锌层的厚度。己知镀锌铁皮质量为18.200g,加入稀硫酸质量为140g,则稀硫酸的质量百分比浓度至少应大于__________。若改用浓盐酸,则测出锌的厚度会_______(填“偏大”、“偏小”、或“无影响”)。(4)实验后,将乙同学和丙同学的结果进行比较,发现他们对同种镀锌铁皮的测量结果差异很大,你认为谁的方案更加可靠呢?原因是__________。4、为探究过氧化氢的制取O2的反应,同学们进行了以下实验。 初步探究:探究影响过氧化氢制取O2速率的因素 序号烧杯1烧杯2烧杯3烧杯4实验操作 实验现象 立即冒大量气泡,烧杯内有 少量白雾出现。 5分钟后,有比较大量的气泡冒出。 立即冒大量气泡,烧杯内有白雾。 立即冒大量气泡,烧杯内有大量白雾。 继续探究:重复烧杯1、3、4实验,并分别伸入带火星木条,如图所示。 实验方案序号实验现象烧杯1木条复燃,燃烧很旺烧杯3木条复燃,之后火焰变微弱烧杯4木条复燃,之后立即熄灭(结论与解释) (1)过氧化氢的制取O2属于四种基本反应类型中的______。 (2)为证明MnO2和CuSO4能加快过氧化氢的分解速率,应增加的对比实验是______(填具体操作)。 (3)能证明过氧化氢溶液浓度影响其分解速率的实验是______(填烧杯的数字序号)。(4)烧杯内出现大量白雾的原因是______。(反思与评价) (5)实验室若用双氧水制取氧气来完成木炭燃烧的实验,应选择的试剂是______(填字母序号)。A5%过氧化氢溶液 B10%过氧化氢溶液C20%过氧化氢溶液 D二氧化锰(6)实验室取68g过氧化氢溶液和2g二氧化锰混合制取氧气,充分反应后,称量剩余溶液和滤渣为68.4g。则参加反应的过氧化氢溶液中溶质的质量分数为______。
相关试卷
这是一份2021年最新人教版九年级化学下册第九单元溶液期末考试卷【通用】,共16页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。
这是一份2022年最新人教版九年级化学下册第九单元溶液期中考试卷【最新】,共16页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。
这是一份2022年度最新人教版九年级化学下册第九单元溶液期中考试卷通用,共13页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。









