





- 河北省中考化学一轮复习第四讲溶液课件 课件 0 次下载
- 河北省中考化学一轮复习第五讲金属课件 课件 0 次下载
- 河北省中考化学一轮复习第七讲盐化肥课件 课件 0 次下载
- 河北省中考化学一轮复习第八讲物质的分类课件 课件 0 次下载
- 河北省中考化学一轮复习第九讲构成物质的微粒元素课件 课件 0 次下载
河北省中考化学一轮复习第六讲酸和碱课件
展开考点一 酸碱指示剂与pH [重点]命题角度 溶液酸碱性与pH的关系及pH的测定例1 (2018·北京)一些物质的pH范围如下,其中呈碱性的是( ) A.油污净(12~13) B.西瓜汁(5~6) C.洁厕灵(1~2) D.橘子汁(3~4)
1.实验室有A、B两种溶液,A能使紫色石蕊溶液变红色,B能使无色酚酞变红色。(1)A、B两种溶液显酸性的是____溶液,该溶液________(填“一定”或“不一定”)是酸溶液。
(2)A、B两种溶液的pH大小关系是A_______(填“大于”或“小于”)B。(3)测定pH最简单的方法是使用_________。测定时,用_________蘸取待测溶液,滴在_________上,然后再与_____________对照,得出该溶液的pH。
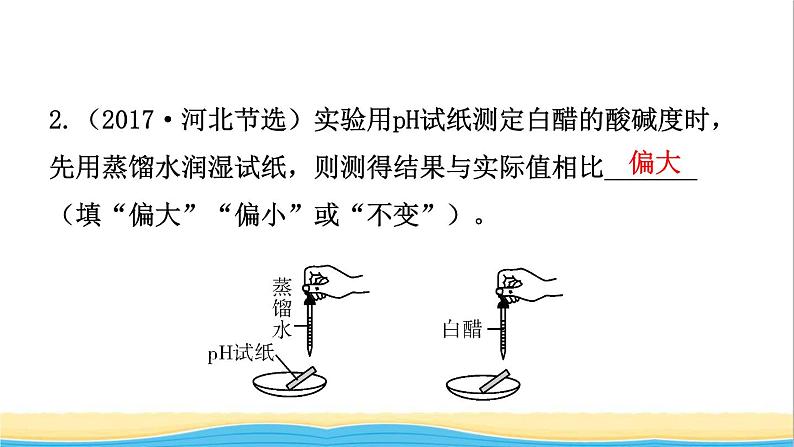
2.(2017·河北节选)实验用pH试纸测定白醋的酸碱度时,先用蒸馏水润湿试纸,则测得结果与实际值相比_______ (填“偏大”“偏小”或“不变”)。
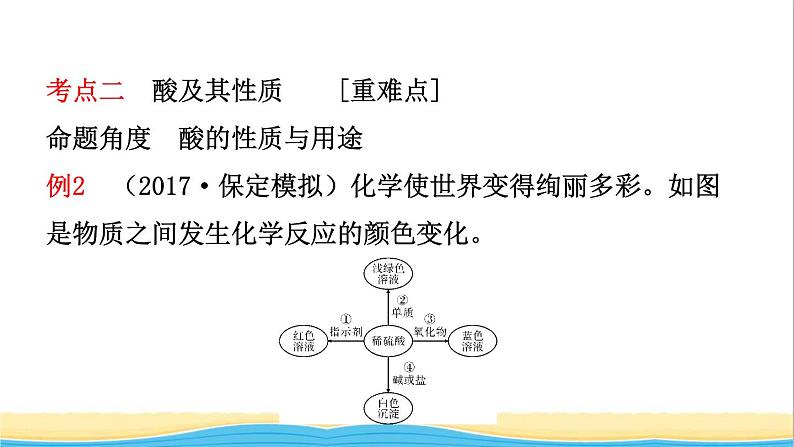
考点二 酸及其性质 [重难点]命题角度 酸的性质与用途例2 (2017·保定模拟)化学使世界变得绚丽多彩。如图是物质之间发生化学反应的颜色变化。
(1)请你在编号②③处各填入一种物质。②是 ;③是 。(2)根据上图可以总结出稀硫酸的五个化学性质。请你写出编号①稀硫酸的化学性质 。
【答案】 (1)铁(或Fe) 氧化铜(或CuO) (2)稀硫酸可使紫色石蕊溶液变红
3.(2018·常州)利用如图所示的实验探究物质的性质。下列叙述错误的是( )A.②处有气泡,③处无现象,则可判断锌、铜的金属活动性B.①②④⑤处有明显现象,则M可能为稀盐酸C.⑤处固体明显减少,则M可能为稀硫酸D.⑥处反应放热,则N可能是氢氧化钠溶液
考点三 碱及其性质 [重难点]命题角度1 碱的性质与用途例3 (2018·长春)为验证Ba(OH)2的化学性质做如图所示的四个实验:
(1)实验一中能够观察到的明显现象是 。(2)实验二、三验证了Ba(OH)2能和某些 (填物质类别)发生化学反应。(3)实验四中发生反应的化学方程式为 。
(4)将上述实验后四支试管中的所有物质倒入同一个烧杯,充分混合后过滤,得到白色固体和溶液A。取一定量溶液A,加入少量Ba(OH)2溶液,振荡后只得到无色溶液,综上分析,溶液A中除酚酞外,一定还含有的溶质是 。
【解析】 (1)酚酞遇碱变红色,所以实验一中能够观察到的明显现象是溶液变红色。(2)氯化镁、硫酸钠属于盐,与氢氧化钡反应分别生成白色的氢氧化镁沉淀和硫酸钡沉淀,所以实验二、三验证了Ba(OH)2能和某些盐发生化学反应。(3)稀盐酸与Ba(OH)2溶液反应生成氯化钡和水。(4)取一定量溶液A,加入少量Ba(OH)2溶液,振荡后只得到无色溶液,说明A溶液中含氯化氢,不含氯化镁、硫酸钠和氢氧化钡,也不含硫酸钠与氢
氧化钡产生的氢氧化钠,而应含有盐酸与氢氧化钡产生的氯化钡和过量的盐酸与氢氧化钠反应生成的氯化钠,故一定含有的溶质还有氯化氢、氯化钡和氢化钠。【答案】 (1)溶液变红色 (2)盐 (3)Ba(OH)2+2HCl=== BaCl2+2H2O (4)氯化氢、氯化钡和氯化钠
命题角度2 氢氧化钠溶液与二氧化碳的反应例4 (2017·唐山滦南县模拟)如图所示装置回答下列问题。
(1)把滴管中的氢氧化钠溶液注入锥形瓶中后会观察到试管中的水会重新沸腾,所发生反应的化学方程式为 ,水重新沸腾的原因是 。(2)如果把气球中的氢氧化钠固体投入试管中,水也会沸腾起来,原因是 。
【答案】 (1)2NaOH + CO2=== Na2CO3 + H2O 氢氧化钠吸收二氧化碳,使瓶内压强减小,水的沸点降低 (2)氢氧化钠溶于水放热,水重新沸腾
考点四 中和反应及其应用 [重点]命题角度1 中和反应及其应用例5 下列应用与中和反应原理无关的是( ) A.配制农药波尔多液B.用熟石灰改良酸性土壤C.服用含氢氧化铝的药物治疗胃酸过多D.用氢氧化钠溶液洗涤石油产品中的残留硫酸
【解析】 配制农药波尔多液用的是熟石灰和硫酸铜溶液,熟石灰属于碱,硫酸铜属于盐,两者反应不属于中和反应,A错误。【答案】 A
命题角度2 pH坐标图像分析例6 图1中甲、乙、丙、丁表示相邻两物质相互混合过程中溶液酸碱度的变化,其中可能得图2所示变化关系的是( ) A.甲 B.乙 C.丙 D.丁
【解析】 在图2中根据pH的变化情况可知,pH由大于7到等于7最后小于7,符合向碱溶液中加酸后pH的变化情况,在图1中只有氢氧化钙与硫酸的反应与之相符。【答案】 D
命题角度3 有关中和反应的实验例7 在学习“酸碱中和反应”时,老师给大家变了一个魔术——使“水”变色的杯子。操作过程及现象如图所示。
老师揭秘:“空”杯子底部事先涂抹了某种无色液体,无色的“水”是事先用两种无色溶液混合而成。请回答下列问题:(1)“空”杯内涂抹的物质可能是 溶液。(2)此过程中发生反应的化学方程式可能是 。 (3)最终溶液为无色,能否说明该溶液一定呈中性? (选填“能”或“不能”),理由是____________ 。
【答案】 (1)碱(如NaOH) (2)NaOH+HCl=== NaCl+H2O(合理即可) (3)不能 酚酞在酸性溶液中也呈无色
实验一 氢氧化钠变质的探究❶变质原因:_________________________(用化学方程式表示)。
2NaOH+CO2=== Na2CO3+H2O
❷检验氢氧化钠是否变质(1)思路分析:检验样品中是否含有碳酸根离子,若含有碳酸根离子,则已变质。(2)试剂选择原则:选择能与碳酸根发生反应产生明显现象但不与氢氧根发生反应产生相同现象的试剂。
2HCl+Na2CO3===2NaCl+CO2↑+H2O(或H2SO4+Na2CO3===Na2SO4+H2O+CO2↑)
Ca(OH)2+Na2CO3===CaCO3↓+2NaOH
CaCl2+Na2CO3===CaCO3↓+2NaCl(或BaCl2+Na2CO3===BaCO3↓+2NaCl)
❸探究NaOH变质程度(1)思路分析:只需要检验样品中是否含有氢氧化钠,实质是检验OH-,如果有OH-,则部分变质,如果不含OH-,则全部变质。
(2)选择试剂原则①实验室常用酚酞溶液检验溶液中是否含有OH-。②先选择合适的试剂除去Na2CO3以排除干扰,原因是Na2CO3溶液呈碱性,也能使酚酞溶液变色。
③选择除去碳酸根离子试剂的依据a.不能选择酸,因为酸中的H+与OH-会发生中和反应;b.不能选择碱,虽然有些碱能与碳酸根离子反应,但是会引入OH-;c.选择可以与碳酸根离子反应但不与OH-反应的盐。
例1 某化学兴趣小组的同学在实验室发现以前用的一瓶氢氧化钠溶液忘记了盖瓶塞,他们取这种氢氧化钠溶液少量于试管中,再逐滴加入稀盐酸,观察到有气泡产生。小组中有同学断定,这瓶氢氧化钠溶液已经变质。辅导老师肯定了该同学的看法,又有同学提出:所用氢氧化钠溶液是否完全变质?兴趣小组的同学在辅导老师的鼓励下又进行了如下的实验探究:
【提出问题】 氢氧化钠溶液是否完全变质?【进行猜想】 (1)该氢氧化钠溶液部分变质;(2)该氢氧化钠溶液全部变质。【查阅资料】 氯化钡溶液呈中性
【结论】 该小组同学所用的氢氧化钠溶液是_______(填“部分”或“全部”)变质。【反思】 氢氧化钠溶液露置于空气中容易变质,反应的化学方程式为___________________________。
2NaOH+CO2=== Na2CO3+H2O
实验二 中和反应的探究❶中和反应的实质:H++OH-=== H2O。
❷判断中和反应是否发生的方法及注意事项
(1)碱入酸:如图1,开始时溶液呈_____性,pH____7,随着_____的加入,pH逐渐_______,当酸碱刚好完全反应时,pH=7,溶液呈中性;随着_____的继续加入,溶液的pH____7,溶液呈_____性。以稀盐酸和氢氧化钠反应为例分析反应过程中所得溶液的溶质:a点: __________;b点_______;c点_____________。
NaCl、NaOH
(2)酸入碱:如图2,开始时溶液呈_____性,pH____7,随着_____的加入,pH逐渐_______,当酸碱刚好完全反应时,pH=7,溶液呈中性;随着_____的继续加入,溶液的pH____7,溶液呈_____性。以稀盐酸和氢氧化钠反应为例分析反应过程中所得溶液的溶质:a点:_____________;b点_______;c点____________。
❹判断是否恰好完全反应的方法
例2 探究酸与碱的反应。(1)稀盐酸与氢氧化钠溶液反应时无明显现象,可借助酸碱指示剂帮助我们确认化学反应是否发生。如图,通过观察___________________现象,证明氢氧化钠溶液与盐酸发生了反应。本实验选用无色酚酞溶液比紫色石蕊溶液更合适的原因是_______________________,其反应的化学方程式为_____________________。
颜色变化明显,便于观察
NaOH+HCl===NaCl+H2O
酸和碱-中考化学一轮复习课件PPT: 这是一份酸和碱-中考化学一轮复习课件PPT,共46页。PPT课件主要包含了思维导图,酸和碱,H+或氢离子,刺激性,盐+氢气,盐+水,AgCl↓+HNO3,新酸+新盐,酸溶液中都含有H+,熟石灰等内容,欢迎下载使用。
酸和碱-中考化学一轮复习课件PPT: 这是一份酸和碱-中考化学一轮复习课件PPT,共29页。PPT课件主要包含了知识网络·思维导图,知识清单·主干回顾,酸碱指示剂的分类,紫色石蕊无色酚酞,H2SO4,HCl,有刺激性气味,吸水性,挥发性,酸及其性质等内容,欢迎下载使用。
酸和碱-中考化学一轮复习课件PPT: 这是一份酸和碱-中考化学一轮复习课件PPT,共60页。












