




山东省滨州市中考化学一轮复习第九单元金属第2课时金属的化学性质课件
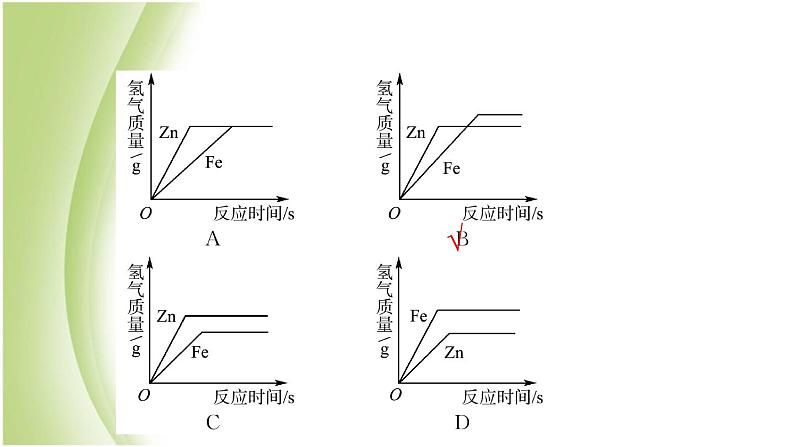
展开考点一 金属的化学性质 [重难点]命题角度❶ 金属与酸反应例1 (2015·枣庄中考)向等质量的锌粉和铁粉中分别加入足量稀硫酸,下列图像描述正确的是( )
【思路分析】 位于氢前的金属均可与酸反应放出氢气。金属活动性越强,与酸反应越剧烈,反应速率越快。等质量的金属与足量的酸反应,若生成金属化合物的化合价相同,金属的相对原子质量越小,生成的氢气质量越大。
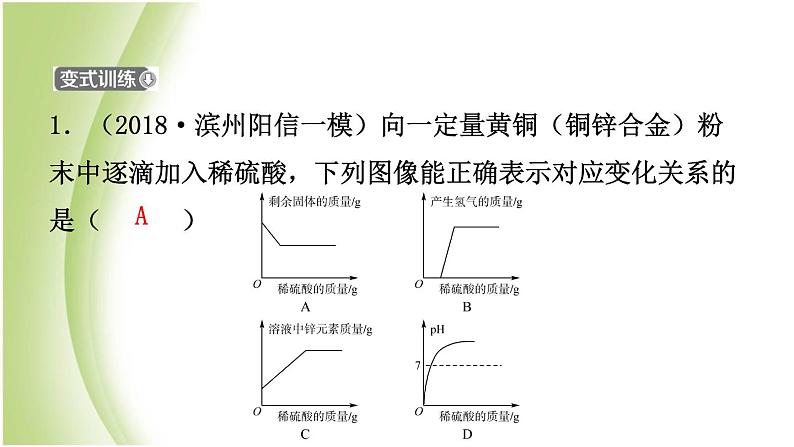
1.(2018·滨州阳信一模)向一定量黄铜(铜锌合金)粉末中逐滴加入稀硫酸,下列图像能正确表示对应变化关系的是( )
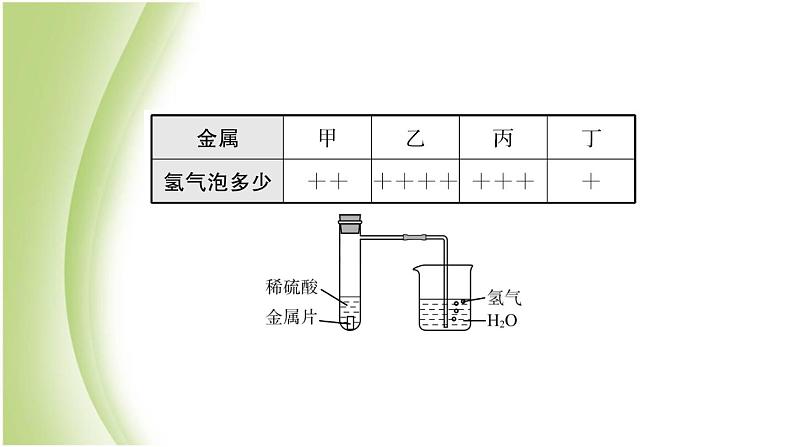
2.(2018·滨州滨城二模)某兴趣小组设计实验,用来研究不同金属与稀硫酸反应的快慢。他们选择了四种大小相同的金属片,分别与相同体积、相同质量分数的稀硫酸反应,观察30 s里产生氢气泡的多少,记录在下表中。(“+”越多表示产生的气泡越多)
如果四种金属是镁、铝、铁、锌中的一种,则丁最有可能是( )A.镁 B.铝C.铁 D.锌
3.(2017·泰安中考)现有等质量甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中化合价均为+2价)。则下列说法中不正确的是( )
A.生成氢气的质量:甲>乙>丙B.相对原子质量:乙>丙>甲C.金属活动性:乙>甲>丙D.消耗硫酸的质量:甲>乙>丙
4.(2017·济宁中考)在相同质量、相同质量分数的稀硫酸中,分别加入足量的Mg、Fe、Zn三种金属,其发生反应的质量关系如图所示。读识该图并判断,下面推论合理的是( )
①反应速率:Mg>Fe>Zn②反应生成氢气质量:Mg=Fe=Zn③反应后溶液质量:Mg=Fe=Zn④反应后溶液溶质质量分数:Mg
【思路分析】 一种金属能与硝酸银溶液反应置换出银,说明该金属的活动性强于银,发生的是置换反应。
5.(2018·德州中考)金属锰与氯化亚铁溶液可发生如下反应:Mn+FeCl2===MnCl2+Fe,下列说法错误的是( )A.该反应属于置换反应B.锰的金属活动性比铁强C.锰能置换出盐酸中的氢D.反应前后元素化合价都不变
6.(2018·温州中考)根据金属活动性顺序判断,下列容器与所盛溶液不会发生化学反应的是( )A.用铁制容器盛盐酸B.用铜制容器盛盐酸C.用铁制容器盛硝酸银溶液D.用铜制容器盛硝酸银溶液
7.(2016·德州中考)从化学原理和产物纯度两个角度考虑,下列制取FeCl2溶液的方案中可行的是( )A.过量的Fe粉与稀盐酸混合后,过滤B.过量的Fe2O3与稀盐酸混合后,过滤C.过量的Fe粉与ZnCl2溶液混合后,过滤D.过量的CuCl2溶液与Fe粉混合后,过滤
考点二 金属的活动性顺序及其应用 [重难点]命题角度❶ 金属活动性顺序的判断金属活动性顺序判断的方法(1)明确金属与酸溶液的反应条件。在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢。
(2)明确金属与盐溶液反应的条件。在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们的盐溶液里置换出来。(3)用“>”进行组合判断。如果:X>氢;氢>Z;Z>Y;则:X>Z>Y
例3(2018·滨州中考)把等质量的X、Y、Z、M四种金属分别加入到等质量、等质量分数的足量稀盐酸中(反应关系如图甲),把金属M加入到足量的Y(NO3)2溶液中(反应关系如图乙)。据此判断四种金属的活动性顺序为( )A.X>Z>M>Y B.Y>M>Z>XC.X>Z>Y>M D.Z>X>M>Y
【思路分析】 图甲:金属活动性顺序表中位于氢前面的金属能把酸中的氢置换出来,图像越陡金属活动性越强;图乙:位于前面的金属把另一种金属从其盐溶液中置换出来。
8.(2017·滨州中考)有X、Y、Z三种金属,其中Y能与稀硫酸反应产生氢气,而X、Z不能与稀硫酸反应,将Z浸入X的盐溶液中,Z的表面有X析出,则X、Y、Z的金属活动性由强到弱的顺序是( )A.X、Y、Z B.Y、Z、XC.Y、X、Z D.Z、X、Y
9.(2015·滨州中考)有X、Y、Z三种金属,把Y投入X(NO3)2溶液中,Y表面有X析出,若分别将X、Z投入稀硫酸中,X表面有气泡冒出,Z无变化,则X、Y、Z三种金属的活动性由强到弱的顺序是( )A.Z>Y>X B.Y>X>ZC.X>Y>Z D.X>Z>Y
命题角度❷ 金属活动性顺序的实验设计及探究例4 (2014·泰安中考)某化学兴趣小组,为验证Ag、Fe、Cu三种金属的活动性顺序,设计了如图所示的实验操作,其中可以达到实验目的的组合是( )
A.①②或②③或②④⑤ B.②④或①③或②④⑤C.①③或②③或①④⑤ D.①②或②③或③④⑤
【思路分析】 金属活动性实验的设计原理为根据金属与酸、金属与盐能否发生反应或反应速率的快慢来判断。对于三种金属活动性顺序的探究方案可以采用“两金夹一盐”或“两盐夹一金”的方案。
10.(2018·聊城中考)下列各组物质不能验证Mg、Fe、Cu三种金属活动性强弱的是( )A.稀盐酸B.MgSO4溶液 Fe CuC.Mg FeSO4溶液 CuD.MgSO4溶液 Fe Cu(NO3)2溶液
11.(2013·济宁中考)某同学为探究镁、锌、铜、银的活动性顺序,设计如图实验流程。依据流程设计,下面对物质①②的选择合理的是( )
A.①稀硫酸 ②硝酸银B.①稀盐酸 ②硫酸锌C.①稀盐酸 ②硫酸亚铁D.①稀硫酸 ②氯化镁
12.(2016·滨州中考)在探究金属的活动性顺序时,某同学将一定质量的Zn粉放入AgNO3与Cu(NO3)2的混合溶液中,实验流程如图所示,请分析回答:
(1)步骤Ⅱ中生成的无色气体X是 ____________ ,该反应的基本类型是 _________ ,滤液N中的溶质是______________________ 。(2)请写出步骤Ⅰ中所发生的任一反应的化学方程式__________________________________________________________________。
硝酸锌[或Zn(NO3)2]
Zn+2AgNO3===Zn(NO3)2+2Ag[或Zn+Cu(NO3)2===
Zn(NO3)2+Cu]
命题角度❸ 滤液、滤渣成分的探究滤渣、滤液成分的判断方法(1)优先反应原则:①多种金属和一种盐溶液反应,最活泼的金属先和盐溶液反应。
②一种金属和多溶质的盐溶液反应,金属先和最不活泼金属的盐溶液发生反应。(2)反应后滤液和滤渣的成分分析(将Zn加入CuCl2和FeCl2的混合溶液中):
百变例题7 把若干锌粉放入AgNO3、Cu(NO3)2的混合溶液中,充分反应后过滤。下列关于过滤后滤渣和滤液的成分的说法中,正确的是( )A.滤渣中一定含有Ag,可能含有CuB.滤渣中一定含有Ag、Cu,可能含有ZnC.滤液中一定含有Zn(NO3)2,一定没有AgNO3和Cu(NO3)2D.滤液中一定含有Cu(NO3)2,可能含有AgNO3和Zn(NO3)2
百变解读:对于一种金属与两种盐溶液的题目,应该先明确金属的活动性顺序,先置换出哪种金属,然后根据金属与盐溶液的量对滤渣、滤液的成分进行逐一分析。
变式一:增加条件13.(2017·日照中考)在硝酸银、硝酸铜的混合溶液中加入一定量锌粉,充分反应后过滤,滤液仍为蓝色,滤渣中所含物质不可能的情况是( )A.可能有银和铜,没有锌B.可能只有银,没有铜和锌C.一定有银,可能有铜和锌D.一定有银,没有锌,可能有铜
14.(2018·枣庄中考)某兴趣小组进行实验探究,向盛有硝酸亚铁和硝酸银混合液的烧杯中加入一定量的锌粉,反应停止后过滤,向滤渣中加入稀盐酸,有气泡产生。下列说法正确的是( )A.滤液中一定含有Zn2+和Fe2+,一定没有Ag+B.滤液中一定含有Zn2+,一定没有Fe2+和Ag+C.滤渣中一定含有银,可能含有锌和铁D.滤渣中一定含有银和铁,可能含有锌
变式二:溶液中含有酸15.(2015·济南中考)将一定质量的铁粉加至H2SO4、MgSO4和CuSO4的混合溶液中,充分反应后过滤,得到滤液M和滤渣N。下列有关说法中,不合理的是( )A.滤液M中一定存在Fe2+B.滤渣N的质量一定小于加入铁粉的质量C.滤渣N中一定没有单质镁D.滤液M中至少含有两种金属阳离子
变式三:图像分析16.(2015·泰安中考)向一定质量AgNO3和Cu(NO3)2的混合溶液中加入过量的Zn粉,溶液质量随反应时间变化的情况如图所示。下列说法正确的是( )
A.取a点溶液,滴加稀盐酸,无白色沉淀B.图标上b~c段质量增加的原因是Zn与Cu(NO3)2溶液反应C.b点时溶液中金属离子有Zn2+、Cu2+,金属单质有Zn、Cu、AgD.c点和d点溶质种类不同,金属单质种类也不同
百变例题8 将一定质量的铁粉与铜粉的混合物加入到硝酸银溶液中,充分反应后过滤得到滤渣和滤液,向滤渣中滴加稀盐酸,无明显现象,则关于滤渣和滤液的说法正确的是( )A.滤渣中一定含有银和铜B.滤液中一定含有硝酸亚铁和硝酸铜C.滤渣中一定含有银,可能含有铜D.滤液中一定含有硝酸亚铁和硝酸铜,可能含有硝酸银
百变解读:对于两种金属与一种盐溶液的题目,应该先明确金属的活动性顺序,哪种金属先与盐溶液反应,然后根据金属与盐溶液的量对滤渣、滤液的特点进行逐一分析。
变式一:增加条件17.(2018·青岛中考)同学们到实验室去进行“探究金属的性质”实验。将锌粉和铁粉的混合物加入到盛有一定量硝酸银溶液的烧杯中,充分反应后过滤,得到滤渣和滤液。请你填空。
(1)若将所得滤渣放入稀盐酸中,有气泡产生,则:①滤液里一定含有 __________ (填写化学式,下同),可能含有 __________ ;②滤渣中一定含有 _______ ,可能含有 ___ 。(2)若反应后所得滤液呈无色,则滤渣中一定含有 _______ (填写化学式)。
(3)反应后所得滤液的溶质质量分数 _____ (填“大于”“等于”或“小于”) 原硝酸银溶液的溶质质量分数。
变式二:多种金属与含有多种盐的混合液18.(2017·青岛中考)某化工厂的废液中主要含有硝酸银、硝酸铜。取一定量的该废液样品,加入镁粉和铜粉,充分反应后过滤,得到滤液和滤渣。请填写下列空格:
(1)若滤渣中有镁粉,则滤渣中除镁粉外还含有 _______ (填化学式,下同)。(2)若滤渣中有铜粉,则滤液中的溶质一定含有 __________ ,可能含有 __________ 。(3)若滤渣中没有铜粉,则滤液中的溶质一定含有 _____________________ ,可能含有 _____ 。
Mg(NO3)2、Cu(NO3)2
(4)反应后得到滤液的质量 _____ (填“小于”“大于”或“等于”)反应前所取废液样品的质量。
实验 金属活动性顺序的探究❶实验原理借助金属与酸溶液、金属盐溶液能否发生反应或反应的速率来判断金属的活动性强弱。
❷实验猜想根据金属活动性顺序确定已知金属的活动性顺序。对未知金属的位置做出猜想:如在已知两种金属的位置之前、之间或之后。
❹注意事项(1)实验前必须打磨除去金属表面的氧化物或污物。(2)做金属与酸反应实验时,一般用稀盐酸或稀硫酸,而不用硝酸或浓硫酸,且所用的酸的种类、浓度和体积要相同。(3)金属与盐溶液的反应,盐必须可溶于水。
(4)并不是所有排在前面的金属都能把排在后面的金属从其盐溶液中置换出来,如K、Ca、Na。(5)在比较金属活动性时要注意控制变量法的应用,如酸溶液或盐溶液的温度、浓度、体积等,金属的形状、表面积等须保持一致。
例 (2018·青海中考)学习合金知识后,知道了不锈钢中含有金属铬。某同学想:铬与常见铁、铜相比,其金属活动性强弱如何呢?于是,和同学们一起进行了以下探究。
【查阅资料】 ①铬是银白色有光泽的金属,在空气中,像铝一样,其表面能产生致密的氧化膜;②能与稀硫酸反应,生成硫酸亚铬(CrSO4)。【知识回顾】 金属活动性顺序:K Ca Na Mg Al Zn ___ Sn Pb (H) ___ Hg Ag PtAu(在横线上填写对应金属的元素符号)。
【做出猜想】 猜想①Cr>Fe>Cu;猜想②Fe>Cu>Cr;猜想③_____________ 。【设计与实验】 ①张明同学取大小相等的铁、铜、铬三种金属片,未经打磨就分别放入等量等浓度的稀硫酸中,记录如下:
②李红同学也取大小相等的铁、铜、铬三种金属片,先用砂纸打磨后再分别放入等量等浓度的稀硫酸中,记录如下:
【讨论交流】 为什么张明和李红两个同学记录的铬与稀硫酸反应开始的现象截然不同?原因是 ________________________________ 。
【实验验证】 为了进一步确认铁、铜、铬三种金属的活动性强弱,刘斌同学将打磨过的两块铁片分别放人硫酸亚铬(CrSO4)溶液和硫酸铜溶液中,观察到在硫酸亚铬溶液中无明显现象,而在硫酸铜溶液中有明显的现象,现象是 _____________________________________________ ,其反应的化学方程式是 _____________________ 。
铁片表面有红色物质析出,溶液从蓝色变为浅绿色
Fe+CuSO4===FeSO4+Cu
【拓展迁移】 写出铬与稀硫酸反应,生成CrSO4的化学反应方程式 ______________________ 。【思路分析】 对金属活动性进行探究,首先对金属的活动性进行合理的猜测,然后进行实验探究。该实验探究中,采用一种酸与三种金属反应,金属活动性越强,与酸反应越剧烈。另外还可以采用“两金夹一盐”或“两盐夹一金”的方案。
Cr+H2SO4===CrSO4+H2↑
鲁教版中考化学复习第九单元金属第二节金属的化学性质课件: 这是一份鲁教版中考化学复习第九单元金属第二节金属的化学性质课件,共28页。PPT课件主要包含了导电性,除去铝丝表面的氧化铝,气不足,无明显变化,使木炭充分燃烧,置换反应,隔绝氧气和水等内容,欢迎下载使用。
鲁教版中考化学复习第九单元金属第二节金属的化学性质课件: 这是一份鲁教版中考化学复习第九单元金属第二节金属的化学性质课件,共21页。PPT课件主要包含了ACD,H2或氢气等内容,欢迎下载使用。
中考化学复习第八单元金属和金属材料第2课时金属的化学性质教学课件: 这是一份中考化学复习第八单元金属和金属材料第2课时金属的化学性质教学课件,共30页。PPT课件主要包含了ABCD,氢气或H2,溶液由蓝色变成无色,成蓝色,Al>Cu>Ag等内容,欢迎下载使用。












