

化学选择性必修2第二节 原子结构与元素的性质第1课时导学案
展开一、元素周期律、元素周期系和元素周期表
1.元素周期律:元素性质随着原子序数递增发生周期性的重复。
2.元素周期系:按其原子核电荷数递增排列的序列称为元素周期系。
3.元素周期表:呈现元素周期系的表格。
微点拨:元素周期系只有一个,元素周期表多种多样。
二、构造原理与元素周期表
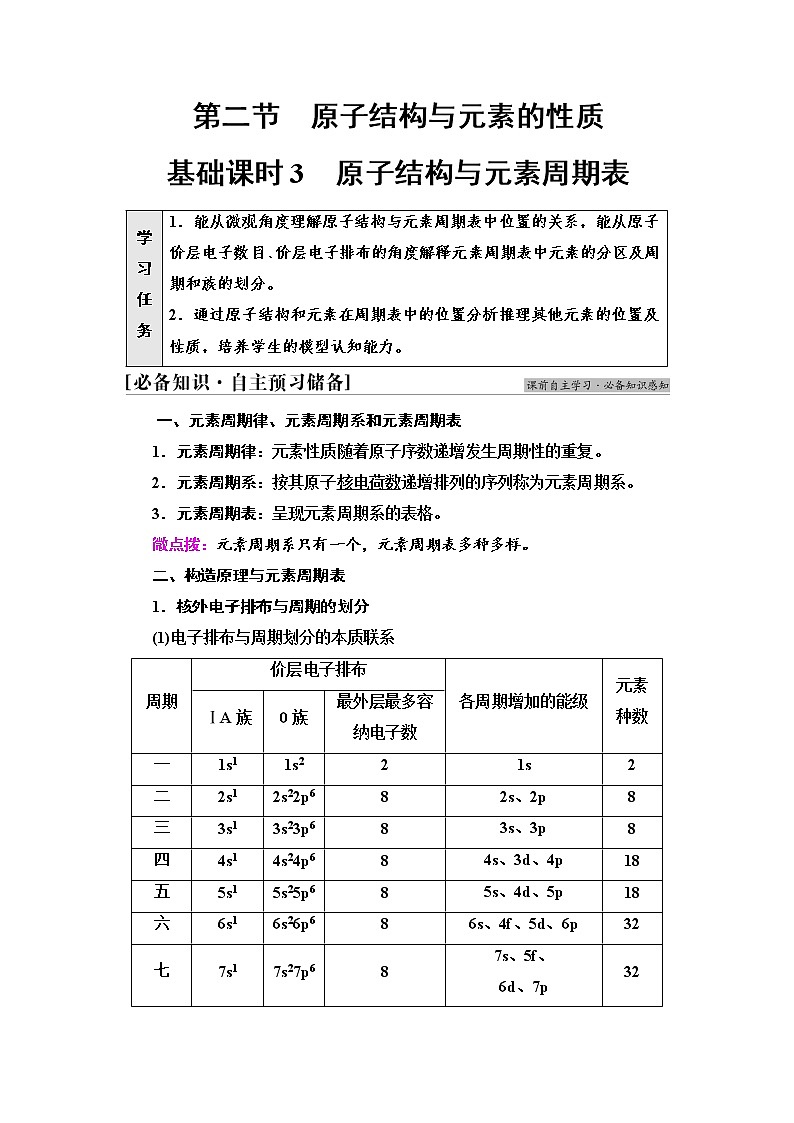
1.核外电子排布与周期的划分
(1)电子排布与周期划分的本质联系
(2)规律:①周期序数=电子层数。②本周期包含的元素种数=对应能级组所含原子轨道数的2倍=对应能级组最多容纳的电子数。
2.核外电子排布与族的划分
(1)划分依据:取决于原子的价层电子数目和价层电子排布。
(2)特点:同族元素的价层电子数目和价层电子排布相同。
(3)规律
①对主族元素,同主族元素原子的价层电子排布完全相同,价层电子全部排布在ns或ns、np轨道上(见下表)。价层电子数与族序数相同。
③稀有气体元素:价层电子排布为ns2np6(He除外)。
某元素位于周期表中第四周期第ⅤA族,你能否据此书写出该元素的价层电子排布式、电子排布式?
提示:元素的价层电子排布式为4s24p3,电子排布式为1s22s22p63s23p63d104s24p3。
写出具有下列电子排布的微粒的核电荷数、元素符号,以及在周期表中的位置。
(1)A原子:1s22s22p5________、________;第________族、第________周期。
(2)B-:1s22s22p63s23p6________、________;第________族、第________周期。
(3)C原子:[He]2s22p3________、________;第________族、第________周期。
(4)价层电子排布为3d54s2的原子:________、________;第________族、第________周期。
[解析] (1)对于原子,核电荷数=核外电子数,确定A元素为F,位于元素周期表中第二周期第ⅦA族。
(2)对于阴离子,核电荷数=核外电子数-所带电荷数=18-1=17,故B-为Cl-;位于元素周期表中第三周期第ⅦA族。
(3)将简化电子排布式还原为电子排布式,即1s22s22p3,判断C原子为N;位于元素周期表中第二周期第ⅤA族。
(4)由构造原理知该元素原子电子排布式为1s22s22p63s23p63d54s2,确定为Mn元素,位于元素周期表中第四周期第ⅦB族。
[答案] (1)9 F ⅦA 二 (2)17 Cl ⅦA 三
(3)7 N ⅤA 二 (4)25 Mn ⅦB 四
三、再探元素周期表
1.元素周期表的结构
2.元素周期表的分区
(1)根据核外电子排布
根据核外电子排布,可把周期表里的元素划分成5个区:s区、p区、d区、ds区和f区。除ds区外,各区的名称来自按构造原理最后填入电子的能级的符号。
(2)根据元素金属性与非金属性
①金属元素和非金属元素的分界线为沿B、Si、As、Te、At与Al、Ge、Sb、P之间所画的一条连线,非金属性较强的元素处于元素周期表的右上角位置,金属性较强的元素处于元素周期表的左下角位置。
②处于d区、ds区和f区的元素全部是金属元素。s区的元素除氢外,也全部是金属元素。
根据周期表分区的依据,各区的名称来自按构造原理最后填入电子的能级的符号。则p区元素价层电子都是ns2np1~6吗?价层电子为ns1~2的元素一定都在s区吗?
提示:都不是。p区He元素的价层电子为2s2,可作为这两个问题的特例。
元素周期表中,非金属元素存在的区域为( )
A.只有s区B.只有p区
C.s区、d区和ds区D.s区和p区
D [s区存在非金属元素H,大部分非金属元素存在于p区,而d区、ds区及f区的元素全部为金属元素。]
元素周期系周期性发展就像螺壳上的螺旋
[问题1] 价层电子排布为5s25p1的元素,在元素周期表中处于什么位置?据此分析元素的价层电子排布与元素在周期表中的位置有何关系?
提示:该元素位于第五周期第ⅢA族。元素能级中最高能层序数=周期序数,主族元素原子的价层电子数=该元素在元素周期表中的主族序数。
[问题2] 某元素位于元素周期表中第四周期第ⅤA族,你能否据此写出该元素的价层电子排布式和电子排布式?
提示:该元素的价层电子排布式为4s24p3;电子排布式为1s22s22p63s23p63d104s24p3。
[问题3] 原子序数1~36的某元素基态原子的最外层电子排布式为ns2,该元素可能属于哪一族?
提示:0族(He)、ⅡA族、ⅡB族、ⅢB族、ⅣB族、ⅤB族、ⅦB族、Ⅷ族。
1.核外电子排布与族的关系
(1)价层电子
主族元素的价层电子为该元素原子的最外层电子。如碱金属元素原子的价层电子排布为ns1。副族元素的价层电子与其最外层电子和次外层电子有关(镧系、锕系元素还与次次外层的f电子有关)。如铁元素的价层电子排布式为3d64s2。
(2)主族元素
主族元素的族序数=原子的最外层电子数。同主族元素原子的价层电子排布相同,价层电子全部排布在ns或nsnp能级上(如表所示)。
当主族元素原子的价层电子全部失去或偏离时,表现出该元素的最高正价(O、F除外)。
(3)稀有气体元素的价层电子排布为ns2np6(He为1s2)。
(4)过渡元素(副族和第Ⅷ族)同一纵列原子的价层电子排布基本相同(如表所示)。
第ⅢB族~ⅦB族可失去ns和(n-1)d能级上的全部电子,所以,最高正价数=族序数。
第Ⅷ族可失去最外层的s电子和次外层的部分(n-1)d电子,其最高正价一般低于族序数(8),只有Ru和Os可表现出+8价。
第ⅠB族可失去ns电子和部分(n-1)d电子,所以第ⅠB族的族数<最高正价,第ⅡB族只失去ns2电子,第ⅡB族的族序数=其最高正价。
2.各区元素的特点
题组1 核外电子排布与元素周期表的关系
1.价层电子构型为3d104s1的元素在周期表中位于( )
A.第五周期第ⅠB族B.第五周期第ⅡB族
C.第四周期第ⅦB族D.第四周期第ⅠB族
D [该元素的基态原子核外电子排布式为1s22s22p63s23p63d104s1,根据电子排布式可知,该原子有4个能层,所以位于第四周期;其价层电子排布式为3d104s1,属于第ⅠB族元素,所以该元素位于第四周期第ⅠB族,故选D。]
2.下列关于原子核外电子排布与元素在周期表中位置关系的表述正确的是( )
A.原子的价层电子排布式为ns2np1~6的元素一定是主族元素
B.基态原子的p能级上有5个电子的元素一定是第ⅦA族元素
C.原子的价层电子排布式为(n-1)d6~8ns2的元素一定位于第ⅢB~第ⅧB族
D.基态原子的N层上只有1个电子的元素一定是主族元素
B [0族元素原子的价层电子排布式为1s2(氦)或ns2np6,故A项错误;原子的价层电子排布式为(n-1)d6~8ns2的元素位于第Ⅷ族,故C项错误;基态原子的N层上只有1个电子的元素除了主族元素外,还有部分副族元素,如Cu、Cr,故D项错误。]
已知某元素原子的价层电子排布,可推断该元素在元素周期表中的具体位置。依据最大能层数确定所在周期序数;依据价层电子数确定所在族序数。1对于主族元素,原子的最大能层数等于周期序数,价层电子数等于主族序数;2第ⅢB~ⅦB族,原子的价层电子数等于族序数;3第ⅠB、ⅡB族要根据ns能级上的电子数来划分。
题组2 元素周期表的分区
3.下列说法中正确的是 ( )
A.所有金属元素都分布在d区和ds区
B.最外层电子数为2的元素都分布在s区
C.元素周期表中ⅢB族到ⅡB族10个纵列的元素都是金属元素
D.s区均为金属元素
C [s区除H外均为金属元素,A、D错;He、Zn等虽最外层电子数为2却不分布在s区,B错;周期表中ⅢB族~ⅡB族为过渡元素,全部为金属元素,C正确。]
4.元素X、Y、Z在周期表中的相对位置如图所示。已知Y元素原子的价层电子排布式为ns(n-1)np(n+1),则下列说法不正确的是( )
A.Y元素原子的价层电子排布式为4s24p4
B.Y元素在周期表的第三周期第ⅥA族
C.X元素位于元素周期表的p区
D.Z元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3
A [Y元素原子的价层电子排布式为ns(n-1)np(n+1),由n-1=2可得n=3,Y元素原子的价层电子排布式为3s23p4,则Y元素位于第三周期第ⅥA族,Z位于第四周期第ⅤA族,价层电子排布式为4s24p3,电子排布式为1s22s22p63s23p63d104s24p3。X、Y、Z最外层电子填充在p轨道上,故X、Y、Z均位于p区。]
解答与元素周期表分区相关的问题时,要特别注意:1主族元素的最外层电子即为价层电子,过渡元素的价层电子一般包括最外层的s电子和次外层的d电子,有的还包括倒数第三层的f电子;2s区元素原子的价层电子特征排布为ns1~2,价层电子数等于主族序数;3p区元素原子的价层电子特征排布为ns2np1~6He除外,价层电子总数等于主族序数0族除外;4s区H除外、d区、ds区和f区都是金属元素。
1.下列叙述不正确的是( )
A.门捷列夫元素周期表是按相对原子质量从小到大的顺序将元素排列起来
B.元素周期律是元素性质随着原子序数递增发生周期性重复的规律
C.元素周期表是呈现元素周期系的表格
D.元素周期表和元素周期系均只有一个
D [元素周期表多种多样,元素周期系只有一个,D项错误。]
2.元素周期表中共有18纵列,从左到右排为18列,第1列为碱金属元素(氢元素除外),第18列为稀有气体元素,则下列说法正确的是( )
A.第9列元素中没有非金属元素
B.第15列元素原子的最外层电子排布式是ns2np5
C.最外层电子排布式为ns2的元素一定在第2列
D.第14列元素原子的未成对电子数是同周期元素中最多的
A [元素周期表中,第9列为第Ⅷ族,全部为金属元素,A项正确;第15列为第ⅤA族,其元素原子的最外层电子排布式为ns2np3,B项错误;He的最外层电子排布式为1s2,却在第18列,C项错误;第14列(碳族)元素原子的价层电子排布式为ns2np2,未成对电子数为2,第15列(氮族)元素原子的价层电子排布式为ns2np3,未成对电子数为3,D项错误。]
3.某元素简化电子排布式为[Xe]4f46s2,其应在( )
A.s区 B.p区 C.d区 D.f区
D [元素在周期表中的分区,取决于元素原子的最后一个电子所进入的能级,因最后一个电子进入4f能级,所以该元素为f区元素。]
4.关于元素周期表中元素的分区,下列说法正确的是( )
A.元素周期表中的s区全部是金属元素
B.元素周期表中的d区包含所有的过渡元素
C.过渡元素包括d区、f区和ds区的元素
D.p区元素都是非金属元素
C [s区中的H元素属于非金属元素,故A项错误;d区包括ⅢB~ⅦB族(镧系和锕系除外)元素和Ⅷ族元素,ds区包括ⅠB族和ⅡB族元素,过渡元素包括d区、f区和ds区的元素,故B项错误,C项正确;p区包括ⅢA~ⅦA族元素和0族元素,其中的铝、铅等都是金属元素,故D项错误。]
5.在研究原子核外电子排布与元素周期表的关系时,人们发现价层电子排布相似的元素集中在一起。据此,人们将元素周期表分为五个区,并以最后填入电子的能级符号作为该区的符号,如图所示。
(1)在s区中,族序数最大、原子序数最小的元素,原子的价层电子的电子云形状为________。
(2)在d区中,族序数最大、原子序数最小的元素,常见离子的电子排布式为________________________________________,其中较稳定的是________。
(3)在ds区中,族序数最大、原子序数最小的元素,原子的价电子排布式为________。
(4)在p区中,第二周期第ⅤA族元素原子价层电子轨道表示式为________________________________________________________________。
(5)当今常用于核能开发的元素是铀和钚,它们在________区中。
[解析] (1)s区为第ⅠA族、第ⅡA族,符合条件的元素为Be,其电子排布式为1s22s2,价层电子的电子云形状为球形。(2)d区为第ⅢB族~第ⅦB族、第Ⅷ族,族序数最大且原子序数最小的元素为Fe,常见离子为Fe2+、Fe3+,电子排布式为1s22s22p63s23p63d6、1s22s22p63s23p63d5,由离子的电子排布式可知Fe3+的3d轨道“半充满”,其稳定性强于Fe2+。(3)ds区符合条件的元素为Zn,其电子排布式为1s22s22p63s23p63d104s2,价层电子排布式为3d104s2。(4)该题中符合题意的元素为N,其价层电子轨道表示式为。(5)铀和钚均为锕系元素,位于f区。
[答案] (1)球形
(2)Fe2+:1s22s22p63s23p63d6,Fe3+:1s22s22p63s23p63d5
Fe3+ (3)3d104s2 (4) (5)f
学 习 任 务
1.能从微观角度理解原子结构与元素周期表中位置的关系,能从原子价层电子数目、价层电子排布的角度解释元素周期表中元素的分区及周期和族的划分。
2.通过原子结构和元素在周期表中的位置分析推理其他元素的位置及性质,培养学生的模型认知能力。
周期
价层电子排布
各周期增加的能级
元素种数
ⅠA族
0族
最外层最多容纳电子数
一
1s1
1s2
2
1s
2
二
2s1
2s22p6
8
2s、2p
8
三
3s1
3s23p6
8
3s、3p
8
四
4s1
4s24p6
8
4s、3d、4p
18
五
5s1
5s25p6
8
5s、4d、5p
18
六
6s1
6s26p6
8
6s、4f、5d、6p
32
七
7s1
7s27p6
8
7s、5f、
6d、7p
32
族序数
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
价层电
子排布
ns1
ns2
ns2np1
ns2np2
ns2np3
ns2np4
ns2np5
探究原子核外电子排布与元素周期表的关系
主族序数
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
价层电
子构型
ns1
ns2
ns2np1
ns2np2
ns2np3
ns2np4
ns2np5
族序数
ⅢB
ⅣB
……
ⅦB
价层电子构型
(n-1)d1ns2
(n-1)d2ns2
……
(n-1)d5ns2
族序数
Ⅷ
ⅠB
ⅡB
价层电子构型
(n-1)d6~8ns2
(n-1)d10ns1
(n-1)d10ns2
包括的元素
价层电子排布
化学性质
s区
第ⅠA、
ⅡA族
ns1~2(最后的电子填在ns上)
除氢外,都是活泼金属元素(碱金属和碱土金属元素)
p区
第ⅢA~
ⅦA族、0族
ns2np1~6(最后的电子填在np上)
随着最外层电子数目的增加,非金属性增强,金属性减弱
d区
第ⅢB~
ⅦB、Ⅷ族
(n-1)d1~9ns1~2[最后的电子填在(n-1)d上]
均为过渡金属,由于d轨道都未充满电子,因此d轨道可以不同程度地参与化学键的形成
ds区
第ⅠB、
ⅡB族
(n-1)d10ns1~2[(n-1)d全充满]
均为过渡金属,d轨道已充满电子,因此d轨道一般不再参与化学键的形成
f区
镧系、锕系
(n-2)f0~14
(n-1)d0~2ns2
镧系元素的化学性质非常相近,锕系元素的化学性质也非常相近
X
Y
Z
高中化学人教版 (2019)选择性必修2第二节 原子结构与元素的性质第1课时学案及答案: 这是一份高中化学人教版 (2019)选择性必修2第二节 原子结构与元素的性质第1课时学案及答案,共11页。学案主要包含了元素周期律,构造原理与元素周期表,再探元素周期表等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修2第二节 原子结构与元素的性质第1课时学案及答案: 这是一份高中化学人教版 (2019)选择性必修2第二节 原子结构与元素的性质第1课时学案及答案,共19页。学案主要包含了元素周期系,元素周期表的分区等内容,欢迎下载使用。
人教版 (2019)选择性必修2第二节 原子结构与元素的性质第1课时学案设计: 这是一份人教版 (2019)选择性必修2第二节 原子结构与元素的性质第1课时学案设计,共11页。学案主要包含了元素周期律,构造原理与元素周期表,再探元素周期表等内容,欢迎下载使用。













