




所属成套资源:2022届高考化学一轮复习课件(共54份)
2022版高考化学一轮复习课件:第3章 第2节 镁、铝及其重要化合物
展开
这是一份2022版高考化学一轮复习课件:第3章 第2节 镁、铝及其重要化合物,共60页。PPT课件主要包含了栏目导航,必备知识关键能力,研解素养悟法猎技,真题体验领悟高考等内容,欢迎下载使用。
☞知识点1 镁、铝的性质及应用
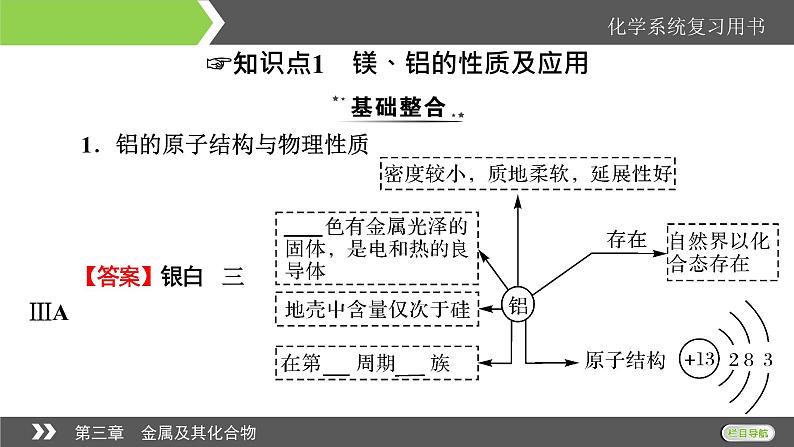
1.铝的原子结构与物理性质
【答案】银白 三 ⅢA
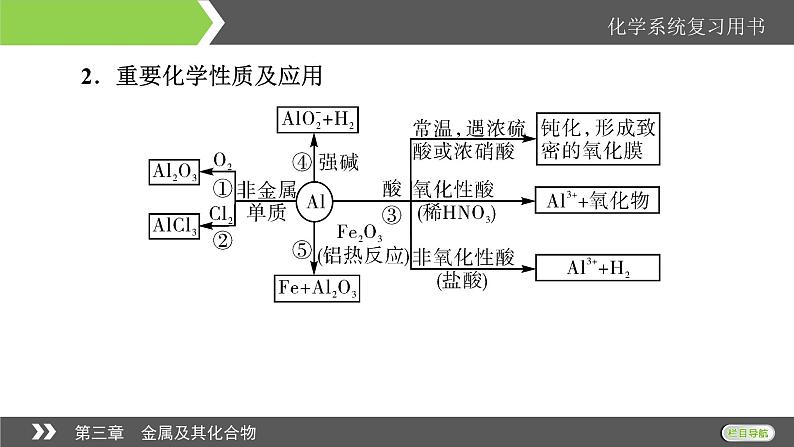
2.重要化学性质及应用
3.铝的用途纯铝用作导线,铝合金用于制造汽车、飞机、生活用品等。4.制备反应____________________________。
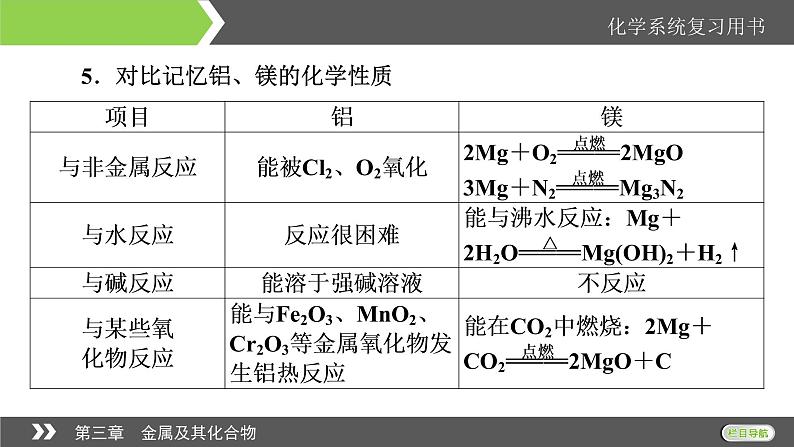
5.对比记忆铝、镁的化学性质
Mg在CO2中能够燃烧,所以活泼金属着火时不能用二氧化碳灭火器和泡沫灭火器灭火。
判断正误(正确的画“√”,错误的画“×”)。(1)铝在自然界中有游离态和化合态两种形式( )(2)常温下,铝遇浓硝酸,产生红棕色气体( )(3)Mg、Al在空气中性质稳定,因而都具有很强的抗腐蚀性( )(4)工业制造镁粉时,可将镁蒸气在N2中冷却( )(5)MgO与Al粉的混合物也可称为铝热剂( )
(6)冶炼铝时常用焦炭作还原剂( )(7)1 ml Al与足量的硫酸或足量的氢氧化钠溶液反应转移电子数相同( )【答案】(1)× (2)× (3)× (4)× (5)×(6)× (7)√
突破一 镁、铝的性质与用途1.下列关于金属镁的说法中正确的是( )A.镁燃烧发出耀眼的白光,常用于制造信号弹和烟火B.实验室钠着火,不能用泡沫灭火器;但是镁着火可以用C.镁能与NaOH溶液反应生成Mg(OH)2沉淀D.金属镁在空气中完全燃烧后,最后剩余两种固体【答案】A
【解析】镁能在CO2中燃烧,不能用泡沫灭火器灭火,B错误;镁不是两性金属,不能与NaOH溶液反应,C错误;金属镁在空气中完全燃烧,大部分的镁与氧气反应生成氧化镁,少量的镁与N2反应生成Mg3N2,还有少量的镁与二氧化碳反应生成氧化镁和碳,最后生成三种固体,D错误。
2.氧化还原反应在生产、生活中具有广泛的用途。下列做法涉及铝元素的还原性的是( )A.明矾净化水B.用氢氧化铝治疗胃酸过多C.用铝制容器存放冷的浓硫酸D.电解熔融氧化铝制单质铝【答案】C
【解析】A、B所涉及的反应均为非氧化还原反应;浓硫酸将铝制容器内壁氧化成一层致密的氧化物薄膜,阻止了酸进一步与铝反应,该反应中铝元素被氧化,表现还原性;电解熔融氧化铝制单质铝,铝元素被还原,表现氧化性。
3.下列除去杂质的方法不正确的是( )A.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥B.用过量氨水除去Fe3+溶液中的少量Al3+C.Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤D.MgO中混有少量Al2O3:加入足量烧碱溶液,充分反应,过滤、洗涤、干燥得到MgO
【答案】B【解析】氨水与Fe3+和Al3+均能反应并生成氢氧化物沉淀,不符合除杂的要求。
突破二 有关铝与酸、碱溶液的计算4.(2019·湖南长沙调研)a g镁铝合金投入x mL 2 ml·L-1的盐酸中,金属完全溶解,再加入y mL 1 ml·L-1 NaOH溶液,沉淀达到最大值,质量为(a+1.7)g,则下列说法不正确的是( )A.镁铝合金与盐酸反应转移电子数为0.1NAB.沉淀为Mg(OH)2和Al(OH)3的混合物C.x=2yD.a的取值范围为0.9W1>W2 (3)520 g
(3)Al(OH)3的三种制备方法:
☞知识点3 用数形结合的思想理解“铝三角”
写出实现上述各步转化的离子方程式。(1)①____________________________________。②____________________________________。③____________________________________。(2)____________________________________。(3)____________________________________。(4)____________________________________。(5)①_______________________________________;②____________________________________。(6)____________________________________。
2.与Al(OH)3沉淀生成有关的图像分析(1)可溶性铝盐溶液与NaOH溶液反应的图像(从上述转化关系中选择符合图像变化的离子方程式,下同)。
先有白色沉淀产生,然后沉淀逐渐溶解
先无明显现象,然后逐渐产生大量的白色沉淀
(2)偏铝酸盐溶液与盐酸反应的图像。
先生成白色沉淀,随后沉淀逐渐溶解
先无明显现象,反应一段时间后逐渐产生白色沉淀
1.下列各组物质的无色溶液,不用其他试剂即可鉴别的是________(填序号)。①NaOH、AlCl3 ②NaHCO3、H2SO4③NaAlO2、NaHSO4 ④Na2CO3、HCl⑤Na2CO3、NaHCO3、Ca(OH)2【答案】①③④
2.向HCl、MgCl2、AlCl3、NH4Cl溶液中(假设各1 ml),逐滴加入NaOH溶液,沉淀的物质的量随NaOH溶液体积变化的图像如图。(假设Mg2+、Al3+结合OH-能力相同)。
(2)依次写出各阶段的离子方程式:①OA:_______________________________。②AB:_____________________________________________________________________。③BC:______________________________________。④CD:______________________________________。
突破 涉及Al(OH)3图像的计算1.(2020·甘肃武威第六中学阶段考试)向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图像中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量)( )
2.室温下,在0.2 ml·L-1 Al2(SO4)3溶液中,逐滴加入1.0 ml·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如下图,下列有关说法正确的是( )
(2)求反应物碱的量。①若碱不足(Al3+未完全沉淀):n(OH-)=3n[Al(OH)3];②若碱使生成的Al(OH)3部分溶解:n(OH-)=4n(Al3+)-n[Al(OH)3]。
☞核心素养7 有关镁、铝及其化合物的化工流程题
有关镁、铝化工流程题要求学生能认识化学现象与模型之间的联系,能运用多种模型来描述和解释化学现象,预测物质及其变化的可能结果,能依据物质及其变化的信息建构模型,建立解决复杂化学问题的思维框架。体现“变化观念与平衡思想”的核心素养。
1.从海水中提取镁的流程(1)流程。
2.工业炼铝的流程铝是地壳中含量最多的金属元素,在自然界主要以化合态的形式存在于氧化铝中。铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,冶炼金属铝很重要的一个过程是Al2O3的提纯。由于Al2O3是两性氧化物,而杂质SiO2是酸性氧化物,Fe2O3是碱性氧化物,因而可设计出两种提纯氧化铝的方案。
碱溶法
讨论回答下列问题:(1)写出①③两步骤中可能发生反应的离子方程式:①__________________________________,__________________________________。③__________________________________,________________________________________。(2)步骤③中不用盐酸(或H2SO4)酸化的理由是____________ ________。
(3)步骤④中得到较纯的Al2O3,可能含有________杂质,在电解时它不会影响铝的纯度的原因:____________________。
酸溶法讨论回答下列问题:(1)写出①②中可能发生反应的离子方程式:①__________________________________,__________________________________。
②__________________________________,__________________________________。(2)步骤②中不用氨水沉淀Fe3+的原因:_____________________。
1.被称为“国防金属”的镁,60%来自海洋,从海水中提取镁的正确方法是( )
2.(2019·全国卷Ⅰ)硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工业。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:
(4)在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为__________,母液经加热后可返回________工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是__________。
1.(高考组合题)下列说法错误的是( )A.(2019·全国卷Ⅲ)铝合金大量用于高铁建设B.(2019·江苏卷)Al2O3具有两性,故可用于电解冶炼铝C.(2019·全国卷Ⅱ)实验操作:将镁条点燃后迅速伸入集满CO2的集气瓶,实验现象:集气瓶中产生浓烟并有黑色颗粒产生D.(2019·全国卷Ⅱ)向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀:3Mg(OH)2+2FeCl3===2Fe(OH)3+3MgCl2【答案】B
4.(山东经典)足量下列物质与相同质量的铝反应,放出氢气且消耗溶质物质的量最少的是( )A.氢氧化钠溶液 B.稀硫酸C.盐酸D.稀硝酸【答案】A【解析】根据关系式:2Al~2NaOH,2Al~3H2SO4,2Al~6HCl,A正确,B、C均错误;Al与稀硝酸反应不产生氢气,D错误。
(1)“碱溶”时生成偏铝酸钠的离子方程式为________________ ____。(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH________(填“增大”“不变”或“减小”)。(3)“电解Ⅰ”是电解熔融 Al2O3,电解过程中作阳极的石墨易消耗,原因是__________。(4)铝粉在1 000 ℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是__________。
相关课件
这是一份2024届高三化学一轮复习镁、铝及其重要化合物课件,共25页。PPT课件主要包含了答案C,海水提镁的工艺流程,答案D,氧化膜,坩埚钳,氧化铝为离子化合物,硼酸的酸性比碳酸弱,七水硫酸镁等内容,欢迎下载使用。
这是一份【备战2023高考】化学总复习——第08讲《铝、镁及其重要化合物》练习,文件包含备战2023高考化学总复习第08讲《铝镁及其重要化合物》练习解析版docx、备战2023高考化学总复习第08讲《铝镁及其重要化合物》练习原卷版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
这是一份新人教版高考化学一轮复习第3章金属及其重要化合物第11讲镁铝铜及其重要化合物金属冶炼课件,共60页。PPT课件主要包含了MgO+C,砖红色,碱式碳酸铜,CuSO4·5H2O,金属与非金属,金属特性,低碳钢,中碳钢,高碳钢,Hg+O2↑等内容,欢迎下载使用。









