





2022届高三统考化学人教版一轮课件:第7单元 第2节 化学平衡状态 化学平衡常数
展开考纲要求:1.能正确计算化学反应的转化率(α)。 2.了解化学反应的可逆性及化学平衡的建立。 3.掌握化学平衡的特征。了解化学平衡常数(K)的含义,能利用化学平衡常数进行相关计算。
1.可逆反应(1)定义:在相同条件下既可以向正反应方向进行,同时又可以向逆反应方向进行的化学反应。(2)特点——“三同一小”:①三同:a.相同条件下;b.正、逆反应同时进行;c.反应物与生成物同时存在。②一小:任一组分的转化率都小于(填“大于”或“小于”)100%。(3)表示方法:在化学方程式中用“ ”表示。
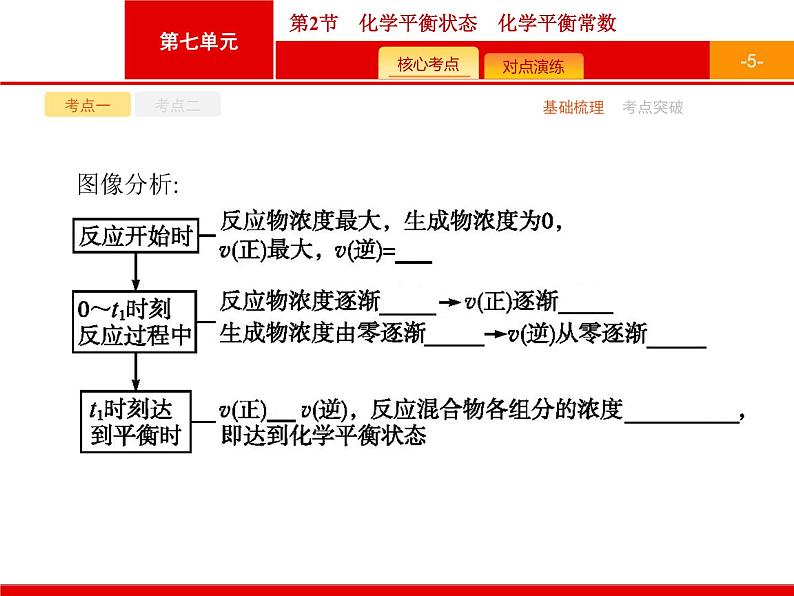
2.化学平衡状态(1)定义:在一定条件下的可逆反应中,反应物和生成物的浓度不再随时间的延长而发生变化,正反应速率和逆反应速率相等的状态。(2)建立过程:在一定条件下,把某一可逆反应的反应物加入固定容积的密闭容器中。化学平衡的建立过程可用如下v-t图像表示:
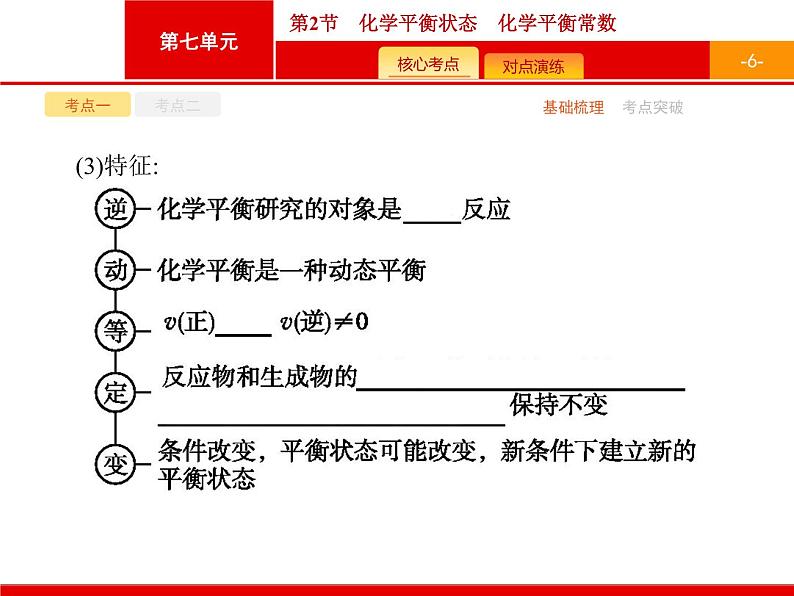
特别提醒(1)可逆反应不等同于可逆过程,可逆过程包括物理变化和化学变化,而可逆反应属于化学变化。(2)化学反应的平衡状态可以从正反应方向建立,可以从逆反应方向建立,还可以从正、逆反应方向同时建立。(3)化学反应达到化学平衡状态的正、逆反应速率相等,是指同一物质的消耗速率和生成速率相等,若用不同物质表示时,反应速率不一定相等。(4)化学反应达到平衡状态时,各组分的浓度、百分含量保持不变,但不一定相等。
自主巩固(1)向含有2 ml SO2的容器中通入过量氧气发生反应2SO2(g)+O2(g) 2SO3(g) ΔH=-Q kJ·ml-1(Q>0),充分反应后生成SO3的物质的量<2 ml(填“<”“>”或“=”,下同),SO2的物质的量>0, SO2的转化率<100%,反应放出的热量判断化学平衡状态的两方法和两标志1.两方法——逆向相等、变量不变(1)“逆向相等”:反应速率必须一个是正反应的速率,一个是逆反应的速率,且经过换算后同一种物质的消耗速率和生成速率相等。(2)“变量不变”:如果一个量是随反应进行而改变的,当该量不变时为平衡状态;一个随反应的进行保持不变的量,不能作为是否达到平衡状态的判断依据。
2.两标志——本质标志、等价标志(1)本质标志:v(正)=v(逆)≠0。对于某一可逆反应来说,正反应消耗掉某反应物的速率等于逆反应生成该反应物的速率。(2)等价标志:①全部是气体参加的非等体积反应,体系的压强、平均相对分子质量不再随时间而变化。例如,N2(g)+3H2(g) 2NH3(g)。②体系中各组分的物质的量浓度、体积分数、物质的量(或质量)分数保持不变。③对同一物质而言,断裂的化学键的物质的量与形成的化学键的物质的量相等。④对于有色物质参加或生成的可逆反应,体系的颜色不再随时间而变化。例如,2NO2(g) N2O4(g)。⑤体系中某反应物的转化率或某生成物的产率达到最大值且不再随时间而变化。⑥绝热体系的温度不变,说明反应处于平衡状态。
例1在两个恒容的密闭容器中进行下列两个可逆反应(甲)2NO2(g) 2NO(g)+O2(g)(乙)H2(g)+I2(g) 2HI(g)现有下列状态:①反应物的消耗速率与生成物的生成速率之比等于化学计量数之比②反应物的消耗速率与生成物的消耗速率之比等于化学计量数之比③浓度之比等于化学计量数之比④混合气体的颜色不再改变⑤混合气体的密度不再改变⑥混合气体的平均相对分子质量不再改变
⑦绝热条件下体系温度不再改变⑧恒温条件下压强不再改变⑨反应物的浓度不再改变⑩反应物或生成物的百分含量不再改变其中能表明(甲)达到化学平衡状态的是②④⑥⑦⑧⑨⑩;能表明(乙)达到化学平衡状态的是②④⑦⑨⑩。
解析:反应(甲)是气体体积增大的反应,且NO2为红棕色气体。而反应(乙)是气体体积不变的反应,I2蒸气是紫色气体。①都表示正反应方向,不能说明(甲)、(乙)达到平衡状态。②正、逆反应速率之比等于化学计量数之比,(甲)、(乙)均达到平衡状态。③化学平衡时浓度之比与化学计量数之比无必然联系,不能说明是否达到化学平衡状态。④混合气体的颜色不改变,说明NO2、I2的浓度不变,(甲)、(乙)均达到平衡状态。⑤容器体积恒定,反应混合物均为气体,故密度不是变量,不能说明反应达到平衡状态。⑥反应(甲)是气体体积增大的反应,故反应未达到平衡时该反应中混合气体的平均相对分子质量是变量,混合气体的平均相对分子质量不变即说明达到化学平衡状态。反应(乙)是气体体积不变的反应,其混合气体的平均相对分子质量不变,不能说明反应达到化学平衡状态。
⑦化学反应中伴随着能量的变化,绝热容器中温度是变量,温度不变说明达到平衡状态。⑧恒温下,反应(甲)是压强增大的反应,反应(乙)是压强不变的反应。压强不变可说明(甲)达到化学平衡状态,不能说明(乙)达到化学平衡状态。⑨和⑩均能说明反应(甲)、(乙)达到化学平衡状态。
方法技巧正确判断化学反应是否达到平衡状态1.如果题目中出现:单位时间、同时、反应速率等词语时,一般用“动”即v(正)=v(逆)进行判断。其他情况一般用“变”进行判断。2.如果出现密度、相对分子质量等物理量时,首先要写出其计算公式,即 ,然后再用上述方法分析公式中物理量的变化情况。
跟踪训练1.在一定温度下的恒容密闭容器中,投入一定量CuO(s)和CO(g)发生可逆反应2CuO(s)+CO(g) Cu2O(s)+CO2(g),下列情况能说明反应达到平衡状态的是( )A.容器内混合气体颜色保持不变B.容器内混合气体密度保持不变C.容器内混合气体总压强保持不变D.容器内的CuO浓度保持不变
2.可以证明可逆反应N2+3H2 2NH3已达到平衡状态的是( )①1个N≡N键断裂的同时,有3个H—H键断裂;②1个N≡N键断裂的同时,有6个N—H键断裂;③其他条件不变时,混合气体的平均相对分子质量不再改变;④恒温恒容时,体系压强不再改变;⑤NH3、N2、H2的体积分数不再改变;⑥恒温恒容时,混合气体的密度保持不变;⑦正反应速率v(H2)=0.6 ml·L-1·min-1,逆反应速率v(NH3)=0.4 ml·L-1·min-1A.①②③④⑤⑥⑦B.①③④⑤C.②③④⑤⑦D.③⑤⑥⑦
化学平衡常数及其应用1.化学平衡常数(1)定义。在一定温度下,一个可逆反应达到化学平衡状态时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,用符号K表示。(2)表达式。
(3)意义及应用。①K值越大,正反应进行的程度越大,反应物的转化率越大。当K>105时,可以认为反应进行得较完全。②K值越小,正反应进行的程度越小,反应物的转化率越小。当K<10-5时,认为反应很难进行。(4)影响因素。①内因:反应物本身的性质。②外因:只受温度影响,与浓度、压强、催化剂等外界因素无关。
自主巩固已知:在600 ℃时,以下三个反应的平衡常数:
(2)反应②的K2值随着温度升高而增大,则反应②的反应热ΔH>0。(3)反应③的K3值与K1、K2的关系是_________。(4)若其他条件不变,向反应③所在的密闭容器中充入H2O(g),则平衡将向正反应方向移动,该反应的平衡常数不变(填“变大”“变小”或“不变”)。
有关化学平衡常数的计算及应用1.判断或比较可逆反应进行的程度一般来说,一定温度下的一个具体的可逆反应:
(3)注意事项:①注意反应物和生成物的浓度关系。反应物:c(平)=c(始)-c(变);生成物:c(平)=c(始)+c(变)。②利用 计算时要注意m总应为气体的质量,V应为反应容器的容积,n总应为气体的物质的量。③起始浓度之比、平衡浓度之比不一定与化学计量数成正比,但物质之间是按化学计量数之比反应和生成的,故各物质的浓度变化之比等于化学计量数之比,这是计算的关键。
例2(2018全国Ⅲ,节选)三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
对于反应2SiHCl3(g) SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
(1)343 K时反应的平衡转化率α= %。平衡常数K343 K = (保留2位小数)。 (2)在343 K下:要提高SiHCl3转化率,可采取的措施是 ;要缩短反应达到平衡的时间,可采取的措施有 、 。
答案 (1)22 0.02 (2)及时移去产物 改进催化剂 提高反应物压强(浓度) (3)大于 1.3
跟踪训练3.在一个容积为2 L的密闭容器中,加入0.8 ml A2气体和0.6 ml B2气体,一定条件下发生反应:A2(g)+B2(g) 2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是( )A.图中A点的值为0.15B.该反应的平衡常数K=0.03C.温度升高,平衡常数K值减小D.平衡时A2的转化率为62.5%
(1)若该反应体系的能量随反应过程的变化关系如图所示,则该反应的ΔH= kJ·ml-1。(用含a、b的式子表示) (2)几种化学键的键能如表所示,实验测得上述反应的ΔH=-152 kJ·ml-1,则表中的x= 。
(3)向1 L恒容密闭容器中通入1 ml CO2和n ml H2,在一定条件下发生上述反应,测得CO2的转化率α(CO2)与反应温度、投料比 的关系如图所示。
①X1 (填“>”“<”或“=”,下同)X2;平衡常数KA KB, KB KC。 ②若B点时X=3,则平衡常数KB= (代入相关数据列出算式即可)。 ③下列措施能同时满足增大反应速率和提高CO2转化率的是 。 a.升高温度b.加入催化剂c.增大投料比Xd.将产物从反应体系中分离出来
答案:(1)-2(b-a)(2)612(3)①< = > ② (或其他合理答案) ③c
解析:(1)由能量随反应过程的变化关系图可知, 该反应放热,ΔH=-2(b-a) kJ·ml-1。(2)ΔH=∑(反应物键能)-∑(生成物键能)=4E(C=O)+6E(H—H)-4E(C—H)-E(C=C)-8E(H—O)=803 kJ·ml-1×4+436 kJ·ml-1×6-414 kJ·ml-1×4-E(C=C)-464 kJ·ml-1×8=-152 kJ·ml-1,E(C=C)=612 kJ·ml-1。(3)①相同温度时,B点CO2的转化率比A点CO2的转化率高,说明B点H2量多,则X值大,X1
③升高温度,平衡向逆反应方向移动,CO2转化率降低,a错误;加入催化剂,平衡不移动,b错误;增大投料比,增大H2浓度,反应速率增大,CO2转化率提高,c正确;将产物分离,提高CO2转化率,但反应速率减小,d错误。
1.化学平衡状态的5个特征逆—动—等—定—变。2.2个化学平衡状态的标志(1)实质:v(正)=v(逆);(2)现象:各物质浓度、质量不变。3.化学平衡常数的3个应用(1)判断反应进行的程度。(2)由Q与K的大小判断某时刻反应进行的方向。(3)计算平衡浓度和转化率。
1.在一恒温、恒容的密闭容器中发生反应A(s)+2B(g) C(g)+D(g),当下列物理量不再变化时,能够表明该反应已达平衡状态的是( )A.混合气体的压强B.混合气体的平均相对分子质量C.A的物质的量浓度D.气体的总物质的量
解析:因反应前后气体分子总数不变,故无论反应是否达到平衡状态,混合气体的压强和气体的总物质的量都不改变;物质A为固体,不能用来判断反应是否达到平衡状态;因反应物A为固体,故混合气体的平均相对分子质量不变说明反应达到平衡状态。
2.在一定条件下,对于已达到平衡的可逆反应:2X(g)+Y(g) 2Z(g),下列说法中正确的是( )A.平衡时,此反应的平衡常数K与各物质的浓度有如下关系:B.改变条件后,该反应的平衡常数K一定不变C.改变压强并加入催化剂,平衡常数会随之变化D.平衡时增加X和Y的浓度,则平衡常数会减小
解析:化学平衡常数K只随温度的改变而改变,改变其他条件都不会引起平衡常数的改变,B、C、D错误。
3.一定温度下某容积固定的密闭容器中,发生可逆反应A(g)+B(g) 2C(g),下列叙述能说明反应已达到平衡状态的是( )A.容器内的压强不再变化B.混合气体的密度不再变化C.消耗B的速率是生成C的速率的D.单位时间内生成a ml B,同时生成2a ml C
解析:该反应前后气体物质的量不发生变化,故恒温、恒容条件下,容器内压强、气体密度均不发生变化,A、B项错误;B的消耗和C的生成均为正反应方向,C项错误;生成B、C分别表示逆反应、正反应,物质的量变化之比等于化学计量数之比,证明反应达到平衡状态,D项正确。
4.300 ℃时,将气体X和气体Y各0.16 ml充入10 L恒容密闭容器中,发生反应X(g)+Y(g) 2Z(g) ΔH<0,一段时间后反应达到平衡。反应过程中测定的数据如下表所示:
下列说法正确的是( )A.前2 min的平均反应速率v(X)=2.0×10-2 ml·L-1·min-1B.其他条件不变,再充入0.1 ml X和0.1 ml Y,再次平衡时Y的转化率不变C.当v逆(Y)=2v正(Z)时,说明反应达到平衡D.该反应在250 ℃时的平衡常数小于1.44
5.煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:在不同温度下,NaClO2溶液脱硫、脱硝的反应中SO2和NO的平衡分压p如图所示。(注:p的单位为Pa)
(1)由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均 (填“增大”“不变”或“减小”)。
6.近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是 。A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以B.氢硫酸的导电能力低于相同浓度的亚硫酸 ml·L-1的氢硫酸和亚硫酸的pH分别为4.5和2.1D.氢硫酸的还原性强于亚硫酸
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。
通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为 、 ,制得等量H2所需能量较少的是 。
(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g) COS(g)+H2O(g)。在610 K时,将0.10 ml CO2与0.40 ml H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。①H2S的平衡转化率α1= %,反应平衡常数K= 。②在620 K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率α2 α1,该反应的ΔH (填“>”“<”或“=”)0。 ③向反应器中再分别充入下列气体,能使H2S转化率增大的是 (填字母)。 A.H2SB.CO2C.COSD.N2
解析:(1)酸性强弱与酸的电离程度有关。A项利用强酸制弱酸反应原理,可知H2SO3的酸性强于H2CO3,而H2CO3的酸性强于H2S,A项可以比较氢硫酸和亚硫酸的酸性强弱;由B项可知同浓度的H2SO3的电离程度大于H2S的,B项可以比较氢硫酸和亚硫酸的酸性强弱;由C项可知同浓度的亚硫酸和氢硫酸中,前者的c(H+)大于后者的c(H+),C项可以比较氢硫酸和亚硫酸的酸性强弱;而酸性强弱与酸的还原性无关,故D项不可以比较氢硫酸和亚硫酸的酸性强弱。(2)热化学方程式的书写应注意标明各物质的聚集状态和ΔH的单位。将题中热化学方程式依次编号为①②③④,依据盖斯定律,①+②+③可得:H2O(l)═H2(g)+ O2(g) ΔH=+286 kJ·ml-1②+③+④可得:H2S(g)═H2(g)+S(s) ΔH=20 kJ·ml-1由两个热化学方程式比较可知,制得等量H2系统(Ⅱ)所需热量较少。
新高考化学一轮复习课件 第7章 第41讲 化学平衡状态 化学平衡常数: 这是一份新高考化学一轮复习课件 第7章 第41讲 化学平衡状态 化学平衡常数,共60页。PPT课件主要包含了高考化学一轮复习策略,复习目标,化学反应的方向,归纳整合,专项突破,规避“2”个易失分点,化学平衡常数,真题演练明确考向,课时精练等内容,欢迎下载使用。
人教版 (2019)选择性必修1第二节 化学平衡优秀课件ppt: 这是一份人教版 (2019)选择性必修1第二节 化学平衡优秀课件ppt,共38页。PPT课件主要包含了学习目标,化学平衡状态,化学平衡状态特征,可逆反应,不变且不为0,v正v逆≠0,若m+n≠p+q,若m+np+q,不一定,气体密度等内容,欢迎下载使用。
人教版 (2019)选择性必修1第二节 化学平衡精品课件ppt: 这是一份人教版 (2019)选择性必修1第二节 化学平衡精品课件ppt












