

2022版高考化学选考山东专用一轮总复习集训:专题六金属及其化合物 —应用集训
展开应用篇
【应用集训】
1.(2020荣成高三期中,16)50.7gMnSO4·H2O样品受热分解过程的热重曲线(样品质量随温度变化的曲线)如图所示。下列有关说法不正确的是( )
A.第一个失重台阶减少的是结晶水
B.加热到500℃得到45.30gMnSO4
C.850℃发生反应的化学方程式为 MnSO4MnO2+SO2↑
D.1150℃得到的固体为MnO
答案 D
2.(2020淄博高三质检,17)七水硫酸锌别名皓矾,常用作媒染剂、收敛剂、木材防腐剂。工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO4·7H2O的流程如下:
在该流程中,相关离子生成氢氧化物的pH如下表:
(1)粉碎氧化锌矿石的目的是 ;滤渣X的成分是 。
(2)步骤Ⅱ中加入H2O2的目的是 ,发生反应的离子方程式为 。
(3)“除铁”步骤中加入试剂M调节溶液的pH,试剂M可以是 (填化学式,一种即可),控制溶液的pH范围为 。同时还需要将溶液加热,其目的是 。
(4)滤渣Z的成分是 (填化学名称)。
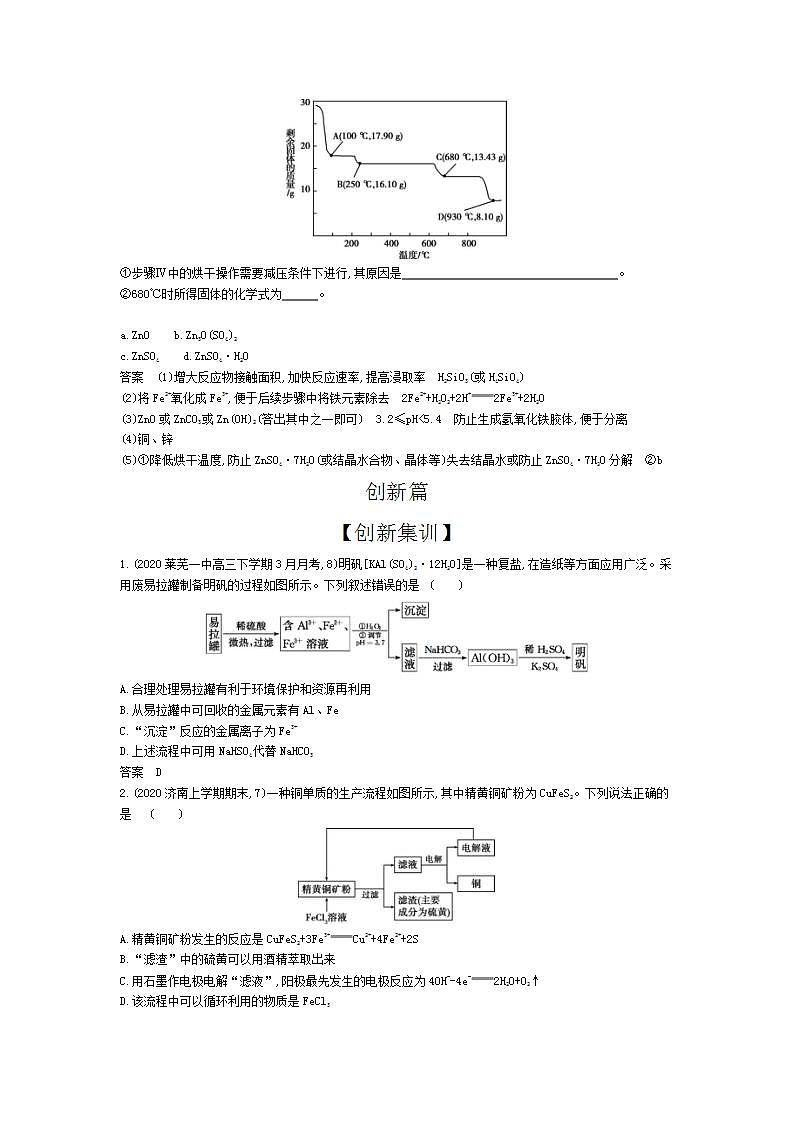
(5)取28.70gZnSO4·7H2O(相对分子质量:287)加热至不同温度,剩余固体的质量变化如下图所示:
①步骤Ⅳ中的烘干操作需要减压条件下进行,其原因是 。
②680℃时所得固体的化学式为 。
a.ZnO b.Zn3O(SO4)2
c.ZnSO4 d.ZnSO4·H2O
答案 (1)增大反应物接触面积,加快反应速率,提高浸取率 H2SiO3(或H4SiO4)
(2)将Fe2+氧化成Fe3+,便于后续步骤中将铁元素除去 2Fe2++H2O2+2H+2Fe3++2H2O
(3)ZnO或ZnCO3或Zn(OH)2(答出其中之一即可) 3.2≤pH<5.4 防止生成氢氧化铁胶体,便于分离
(4)铜、锌
(5)①降低烘干温度,防止ZnSO4·7H2O(或结晶水合物、晶体等)失去结晶水或防止ZnSO4·7H2O分解 ②b
创新篇
【创新集训】
1.(2020莱芜一中高三下学期3月月考,8)明矾[KAl(SO4)2·12H2O]是一种复盐,在造纸等方面应用广泛。采用废易拉罐制备明矾的过程如图所示。下列叙述错误的是( )
A.合理处理易拉罐有利于环境保护和资源再利用
B.从易拉罐中可回收的金属元素有Al、Fe
C.“沉淀”反应的金属离子为Fe3+
D.上述流程中可用NaHSO4代替NaHCO3
答案 D
2.(2020济南上学期期末,7)一种铜单质的生产流程如图所示,其中精黄铜矿粉为CuFeS2。下列说法正确的是( )
A.精黄铜矿粉发生的反应是CuFeS2+3Fe3+Cu2++4Fe2++2S
B.“滤渣”中的硫黄可以用酒精萃取出来
C.用石墨作电极电解“滤液”,阳极最先发生的电极反应为4OH--4e-2H2O+O2↑
D.该流程中可以循环利用的物质是FeCl3
答案 D
3.(2021莱芜一中质量检测,17)近年来,FePO4作为制备锂离子电池正极材料LiFePO4的重要原料而成为研究热点。一种以FeCl3、H3PO4、氨水为主要原料制备FePO4的流程如下图:
悬浊液FePO4·2H2O固体无水FePO4
已知:H3PO4是弱电解质。
(1)将FeCl3溶液与H3PO4溶液混合,没有明显现象,逐渐滴加氨水调pH为1.5左右,生成FePO4·2H2O沉淀。
①操作a为 。
②生成FePO4·2H2O的离子方程式是 。
③控制氨水用量,避免因pH偏高而产生 杂质。
(2)测定产物样品中铁元素的质量分数,主要步骤如下:
ⅰ.取ag样品,加入过量盐酸充分溶解,再滴加SnCl2(还原剂)至溶液呈浅黄色;
ⅱ.加入TiCl3,恰好将ⅰ中残余的少量Fe3+还原为Fe2+;
ⅲ.用cml·L-1K2Cr2O7标准溶液滴定Fe2+,消耗VmLK2Cr2O7标准溶液。
①步骤ⅲ的离子方程式是: ;
②产物中铁元素的质量分数为 。
答案 (1)①过滤 ②Fe3++H3PO4+3NH3·H2OFePO4·2H2O↓+3NH4++H2O ③Fe(OH)3 (2)①Cr2O72-+6Fe2++14H+2Cr3++6Fe3++7H2O ②0.336cVa×100%
4.(2020日照高三期末,19)辉铜矿的主要成分是Cu2S,含较多的Fe2O3、SiO2杂质;软锰矿的主要成分是MnO2,含有较多的SiO2杂质。自氧化还原氨分离法是一种较为理想的湿法冶炼方法,工艺流程如下图:
回答下列问题:
(1)“浸出”时,为提高矿石的浸出率,下列措施可采取的是 。(填字母)
A.适当提高浸出温度
B.适当延长浸出时间
C.增大矿石的粒度
(2)将100g辉铜矿和40g98%的浓硫酸混合,在80~90℃条件下浸出2.5h,铜的浸出率随软锰矿用量的变化如下表:
则浸出100g辉铜矿,软锰矿的最适宜用量为 g。
(3)“浸出”后的浸出液中含有CuSO4、MnSO4、Fe2(SO4)3等溶质,“滤渣Ⅰ”中含有淡黄色固体单质,则“浸出”时产生淡黄色固体的化学方程式为 。
(4)研究表明矿物中Fe2O3在“浸出”反应中起着重要的媒介作用,促进Cu2S与MnO2的溶解,其反应过程如下:
①Fe2O3+3H2SO4Fe2(SO4)3+3H2O;
②Cu2S+2Fe2(SO4)32CuSO4+4FeSO4+S;
③ 。(写出反应的化学方程式)
(5)“滤渣Ⅱ”的主要成分是 ;“沉锰”后,得到的深蓝色溶液中除NH4+、H+外,还含有的阳离子为 。(写化学式)
(6)“滤液Ⅲ”经结晶可得到(NH4)2SO4晶体。结晶时,当 时,即可停止加热。
答案 (1)AB (2)25
(3)Cu2S+2MnO2+4H2SO42CuSO4+S+2MnSO4+4H2O
(4)MnO2+2H2SO4+2FeSO4Fe2(SO4)3+MnSO4+2H2O
(5)Fe(OH)3 [Cu(NH3)4]2+ (6)溶液表面出现晶膜
5.(2020烟台高三期末,19)2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位科学家。利用处理后的废旧锂离子电池材料(主要成分为C3O4,还含有少量铝箔、LiCO2等杂质)制备CO,工艺流程如下图:
预处理后废旧锂离子电池材料钴渣含少量Li+二价钴盐CCO3CO
回答下列问题:
(1)C元素在元素周期表中的位置是 。
(2)废旧锂离子电池拆解前进行“放电处理”有利于锂在正极回收的原因是 ;提高“碱浸”效率的措施有 (至少写两种)。
(3)不同浸出剂“酸溶”结果如下表:
①浸出剂(a)的钴浸出率最高,而实际工艺中一般不选用浸出剂(a)的原因是 。
②温度越高浸出反应速率越快,所以“酸溶”一般选用较高的温度。据此你选择的浸出剂是 (填序号),理由是 。
③从氧化还原角度分析,还原等物质的量的C3O4,需要 (填“H2O2”或“Na2S2O3”)物质的量更少。
④综上分析,写出最合适的浸出剂与C3O4反应的化学方程式: 。
(4)已知:Ksp[C(OH)2]=1.0×10-15,Ksp(Li2CO3)=1.7×10-3,Ksp(CCO3)=1.5×10-13。若滤液2中C2+含量为5.9×10-2g·L-1,计算判断“沉碳酸钴”应控制溶液pH不高于 。
答案 (1)第四周期第Ⅷ族
(2)放电有利于Li+向正极移动并进入正极材料 适当升高温度、粉碎、适当增大NaOH溶液的浓度等
(3)①有Cl2生成,污染空气 ②(c) C3O4能氧化Cl-,生成有污染性的氯气,而Na2S2O3在溶液中受热影响小,因此选择(c)效果优于前者 ③Na2S2O3 ④4C3O4+Na2S2O3+11H2SO412CSO4+Na2SO4+11H2O
(4)8.0
[教师专用题组]
创新篇
【创新集训】
1.活性炭吸附法是工业上提碘的方法之一,其流程如图:
下列说法正确的是( )
A.反应①中氧化剂与还原剂物质的量之比为1∶1
B.分离操作X的名称是分液
C.反应②是氧化还原反应
D.加淀粉可检验分液后的水溶液中是否含有I-
答案 C 反应①为Cl2+2I-2Cl-+I2,氧化剂为Cl2,还原剂为I-,则氧化剂与还原剂物质的量之比为1∶2,故A错误;碘易升华,方案甲中,分离操作X为升华或加热、冷凝结晶,故B错误;反应②涉及的方程式为3I2+3CO32-5I-+IO3-+3CO2↑或3I2+6CO32-+3H2O5I-+IO3-+6HCO3-,I元素化合价发生变化,为氧化还原反应,故C正确;淀粉与碘离子不反应,故D错误。
2.ClO2和NaClO2均具有漂白性,工业上用ClO2气体制NaClO2的工艺流程如图所示。
真空蒸发,冷却结晶NaClO2
下列说法不正确的是( )
A.步骤a的操作包括过滤、洗涤和干燥
B.吸收器中生成NaClO2的离子方程式:2ClO2+H2O22ClO2-+O2↑+2H+
C.工业上可将ClO2制成NaClO2固体,便于贮存和运输
D.通入空气的目的是驱赶ClO2,使其被吸收器充分吸收
答案 B 冷却结晶得到的固体需过滤,洗涤固体表面吸附的离子,干燥,A项正确;反应在碱性条件下发生,正确的离子方程式为2ClO2+H2O2+2OH-2ClO2-+O2↑+2H2O,B项错误;C项正确;通入空气可以使ClO2与溶液充分接触,D项正确。
3.钪及其化合物具有许多优良的性能,在宇航、电子、超导等方面有着广泛的应用,从钛白水解工业废酸(含Sc3+、TiO2+、Mn2+、H+、SO42-等)中提取氧化钪(Sc2O3)的一种流程如下:
请回答下列问题:
(1)在钛白水解工业废酸中,加入H2O2是为了使TiO2+转化为难萃取的[Ti(O2)(OH)(H2O)4]+,[Ti(O2)(OH)(H2O)4]+中Ti的化合价为 。
(2)钪的萃取率(E%)与O/A值[萃取剂体积(O)和废酸液体积(A)之比]的关系如下图,应选择的合适O/A值为 ;
温度对钪、钛的萃取率影响情况见下表,合适的萃取温度为10~15℃,其理由是 。
(3)已知钪与铝类似,其氢氧化物具有两性。反萃取步骤中,加入NaOH使溶液呈碱性,碱性条件下双氧水可以氧化锰离子生成滤渣Ⅰ,写出该反应的离子方程式: 。
(4)用草酸“沉钪”。25℃时pH=2的草酸溶液中c(H2C2O4)c(C2O42-)= (保留两位有效数字,已知25℃时,草酸电离平衡常数为Ka1=5.0×10-2,Ka2=5.4×10-5)。
(5)草酸钪“灼烧”的化学方程式为 。
(6)若该钛白水解工业废酸中含Sc3+的浓度为16mg/L,从1m3该废酸中提取得到21.6gSc2O3,则钪的提取率为 (保留两位有效数字)。
答案 (1)+4
(2)1∶4 温度为10~15℃时,钪的萃取率较高,且钛的萃取率较低(合理即得分)
(3)Mn2++H2O2+2OH-MnO2↓+2H2O (4)37
(5)2Sc2(C2O4)3+3O22Sc2O3+12CO2 (6)88%
解析 (1)[Ti(O2)(OH)(H2O)4]+中存在过氧根离子(O22-)和OH-,故化合物中Ti为+4价。
(2)在10~15℃钪萃取率较大,而钛的萃取率较低,钪的相对纯度较高。
(4)根据电离平衡常数表达式可知,Ka1·Ka2=c(H+)·c(HC2O4-)c(H2C2O4)·c(H+)·c(C2O42-)c(HC2O4-)=c2(H+)·c(C2O42-)c(H2C2O4),则c(H2C2O4)c(C2O42-)=c2(H+)Ka1·Ka2=1×10-45.0×10-2×5.4×10-5≈37。
(5)草酸根中碳的化合价是+3价,在灼烧草酸钪时会被氧化为CO2,则化学方程式为2Sc2(C2O4)3+3O22Sc2O3+12CO2。
(6)1m3废酸中Sc3+的质量为16g,21.6gSc2O3中钪的质量为21.6g×90138≈14g,故钪的提取率为14g16g×100%≈88%。
4.工业上利用软锰矿浆进行烟气脱硫并制备MnSO4和Mg(OH)2的工艺流程如图所示(已知软锰矿的主要成分是MnO2,还含有Fe、Al、Mg、Zn、Ni、Si等元素)。
已知:Ksp[Mg(OH)2]=4.9×10-12,Kb(NH3·H2O)=1.8×10-5。
(1)“脱硫浸锰”中软锰矿浆吸收SO2的化学方程式为 。
(2)向浸出液中添加适量MnO2的作用是 ;
滤渣2的主要成分是 。
(3)“沉锰”的离子方程式为 。
(4)“沉锰”过程中温度和pH对Mn2+和Mg2+沉淀率的影响如图所示。
①由图可知,“沉锰”的合适条件是 。
②当温度高于45℃时,Mn2+和Mg2+沉淀率变化的原因是 。
(5)将NH3通入0.015ml·L-1MgSO4溶液中,使Mg2+恰好完全沉淀即溶液中c(Mg2+)=1.0×10-5ml·L-1,此时溶液中NH3·H2O的物质的量浓度为 (忽略反应前后溶液体积的变化,计算结果保留2位小数)。
答案 (1)MnO2+SO2MnSO4
(2)将Fe2+氧化为Fe3+ NiS和ZnS
(3)Mn2++HCO3-+NH3·H2OMnCO3↓+NH4++H2O
(4)①45℃、pH=7.5 ②当温度高于45℃时,随着温度升高,NH4HCO3分解,c(CO32-)下降,所以Mn2+沉淀率下降;同时随着温度升高,Mg2+水解生成Mg(OH)2程度增大,所以Mg2+沉淀率增大
(5)1.17ml·L-1
解析 (1)“脱硫浸锰”中软锰矿浆吸收SO2时,MnO2与SO2反应生成硫酸锰,化学方程式为MnO2+SO2MnSO4。
(3)除杂后向滤液中通入氨气并加入碳酸氢铵,得到碳酸锰和含有Mg2+的溶液,“沉锰”的离子方程式为Mn2++HCO3-+NH3·H2OMnCO3↓+NH4++H2O。
(4)①由图可知,温度控制在45℃左右,pH在7.5左右时锰离子的沉淀率较高而镁离子沉淀率较低。
(5)Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)=4.9×10-12,c(OH-)=Ksp[Mg(OH)2]c(Mg2+)=7×10-4ml·L-1,NH3通入0.015ml·L-1MgSO4溶液中,Mg2+恰好完全沉淀时生成硫酸铵,c(NH4+)=2c(SO42-)=2×0.015ml·L-1=0.03ml·L-1,一水合氨是弱电解质,电离方程式为NH3·H2ONH4++OH-,Kb(NH3·H2O)=c(OH-)·c(NH4+)c(NH3·H2O)=7×10-4×0.03c(NH3·H2O)=1.8×10-5,则NH3·H2O的物质的量浓度为7×10-4×0.031.8×10-5≈1.17ml·L-1。
5.CCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿[主要成分为C2O3、C(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CCl2·6H2O的工艺流程如下:
已知:①浸出液中含有的阳离子主要有H+、C2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
③CCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中C2O3发生反应的离子方程式: 。
(2)写出NaClO3发生反应的主要离子方程式: 。
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为 。
(4)“操作Ⅰ”中包含3个基本实验操作,它们依次是 、 和过滤。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是 ;萃取剂使用的最佳pH范围是 (填代号)。
A.2.0~2.5 B.3.0~3.5C.4.0~4.5 D.5.0~5.51
(6)为测定粗产品中CCl2·6H2O的含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CCl2·6H2O的质量分数大于100%,其原因可能是 。(答一条即可)
答案 (1)C2O3+SO32-+4H+2C2++SO42-+2H2O
(2)ClO3-+6Fe2++6H+Cl-+6Fe3++3H2O
(3)Fe(OH)3、Al(OH)3
(4)蒸发浓缩 冷却结晶
(5)除去Mn2+ B
(6)粗产品中含有可溶性氯化物或晶体失去了部分结晶水
解析 (1)浸出液中含有C2+,而C2O3中C化合价为+3,Na2SO3、HCl与C2O3发生氧化还原反应,离子方程式为C2O3+SO32-+4H+2C2++SO42-+2H2O;(2)从表中数据可看出,亚铁离子沉淀完全时,C2+已经沉淀完全,无法得到产品,因此需要将亚铁离子氧化为铁离子,NaClO3的作用就是将Fe2+氧化成Fe3+,该反应的离子方程式为ClO3-+6Fe2++6H+Cl-+6Fe3++3H2O;(3)从表中数据可知,加Na2CO3调pH至5.2所得沉淀为Fe(OH)3、Al(OH)3;(4)萃取后余液中溶质主要是CCl2,欲获得CCl2·6H2O,操作步骤是蒸发浓缩、冷却结晶和过滤;(5)萃取剂的作用是除去溶液中的Mn2+。
6.普通立德粉(BaSO4·ZnS)广泛用于工业生产中,可利用ZnSO4和BaS共沉淀法制备。以粗氧化锌(含Zn、CuO、FeO等杂质)和BaSO4为原料制备立德粉的流程如下:
(1)生产ZnSO4的过程中,反应器Ⅰ要保持强制通风,原因是 。
(2)加入锌粉的主要目的是 (用离子方程式表示)。
(3)已知KMnO4在酸性溶液中被还原为Mn2+,在弱酸性、弱碱性溶液中被还原为MnO2,在碱性溶液中被还原为MnO42-。据流程判断,加入KMnO4时溶液的pH应调至 ;
a.2.2~2.4 b.5.2~5.4 c.12.2~12.4
滤渣Ⅲ的成分为 。
(4)制备BaS时,按物质的量之比计算,BaSO4和碳粉的投料比要大于1∶2,目的是 ;生产过程中会有少量氧气进入反应器Ⅳ,反应器Ⅳ中产生的尾气需用碱液吸收,原因是 。
(5)普通立德粉(BaSO4·ZnS)中ZnS含量为29.4%,高品质银印级立德粉中ZnS含量为62.5%。在ZnSO4、BaS、Na2SO4、Na2S中选取三种试剂制备银印级立德粉,所选试剂为 ,反应的化学方程式为 (已知BaSO4相对分子质量为233,ZnS相对分子质量为97)。
答案 (1)防止反应产生的氢气浓度过大而发生爆炸
(2)Zn+Cu2+Zn2++Cu,Zn+2H+Zn2++H2↑
(3)b Fe(OH)3、MnO2
(4)保证碳粉全部反应,不引入杂质 部分BaS被氧化为SO2,污染环境
(5)ZnSO4、BaS、Na2S 4ZnSO4+BaS+3Na2SBaSO4·4ZnS+3Na2SO4
解析 (1)反应器Ⅰ中有氢气生成,且反应放热,为防止反应过程中氢气浓度过大而发生爆炸,必须保持反应器Ⅰ强制通风。
(2)经过反应器Ⅰ中反应,除去滤渣后进入反应器Ⅱ的溶液中主要含有Cu2+、Zn2+、Fe2+、H+,而根据流程图可知,Fe2+在反应器Ⅲ中除去,故反应器Ⅱ的主要目的是除去Cu2+和H+。
(3)反应器Ⅲ加KMnO4的目的是除去Fe2+且不引入新的杂质离子,则MnO4-不能被还原为Mn2+和MnO42-,需将溶液的pH调节至弱酸性或弱碱性。依据分析可确定,滤渣Ⅲ的成分是Fe(OH)3、MnO2。
(4)制备BaS的反应方程式为BaSO4+2CBaS+2CO2↑,BaSO4和碳粉的投料比要大于1∶2,目的是保证碳粉全部反应,不引入杂质;由于生产过程中有少量氧气进入反应器Ⅳ,会将BaS氧化产生SO2气体,故尾气需要用碱液吸收处理。
(5)依据普通立德粉(BaSO4·ZnS)的组成及ZnS含量值,要制备银印级立德粉,需要增大原料中的ZnSO4比例,故所选试剂为ZnSO4、BaS、Na2S。书写方程式时,首先确定n(ZnSO4)∶n(BaS)比值。设产物中n(ZnS)=xml,n(BaSO4)=yml,97x97x+233y×100%=62.5%,得x∶y=4∶1,然后根据原子守恒配平化学方程式:4ZnSO4+BaS+3Na2SBaSO4·4ZnS+3Na2SO4。
思路分析 反应器Ⅰ中粗氧化锌与硫酸反应后,溶液含有的离子:Zn2+、Fe2+、H+、Cu2+、SO42-。在反应器Ⅱ中加入过量Zn除去H+、Cu2+,在反应器Ⅲ中加入高锰酸钾除去Fe2+[将Fe2+氧化为Fe3+,同时调节pH,使Fe3+转化为Fe(OH)3沉淀除去]。反应器Ⅳ中用硫酸钡和碳粉制备BaS,最后在反应器Ⅴ制得立德粉。
7.氧化钡广泛用于玻璃、陶瓷工业,是制取过氧化钡和钡盐的原料。一种利用钡泥[含BaCO3、BaSO3、Ba(FeO2)2等]制取氧化钡的绿色工艺流程如下:
回答下列问题:
(1)酸溶时,Ba(FeO2)2与稀硝酸反应的化学方程式为 。
(2)产生滤渣1的反应的离子方程式是 。
(3)操作Ⅰ调pH=4~5的目的是 。
(4)过滤3所得母液应返回 工序循环使用。
(5)Ba(NO3)2可用于汽车尾气中还原性气体的催化转化。科技工作者用H2模拟尾气中的还原性气体,研究Ba(NO3)2的催化还原过程。该过程分两步进行,如图表示该过程相关物质浓度随时间的变化关系。第二步反应消耗的NH3与NO3-的物质的量之比是 。
(6)“气体2”为混合气体。标准状况下aL“气体2”溶于水得到bL溶液,则所得溶液的物质的量浓度为 。
答案 (1)Ba(FeO2)2+8HNO3Ba(NO3)2+2Fe(NO3)3+4H2O
(2)3BaSO3+2H++2NO3-3BaSO4+2NO↑+H2O
(3)将Fe3+转化为Fe(OH)3沉淀而除去
(4)操作Ⅱ (5)5∶3 (6)a28bml/L
解析 (1)酸溶时,硝酸可使FeO2-生成铁离子和水,反应的化学方程式为Ba(FeO2)2+8HNO3Ba(NO3)2+2Fe(NO3)3+4H2O。
(2)硝酸具有强氧化性,能够使亚硫酸钡变为硫酸钡,同时生成NO气体,离子方程式为3BaSO3+2H++2NO3-3BaSO4+2NO↑+H2O。
(3)操作Ⅰ调pH=4~5,将溶液中的铁离子转化成氢氧化铁沉淀。
(4)过滤3所得母液为饱和的硝酸钡溶液,可加入到操作Ⅱ中,继续使用,提高硝酸钡的产率。
(5)根据题图可知,第二步反应为NH3与NO3-反应生成氮气,反应的离子方程式为5NH3+3NO3-+3H+4N2+9H2O,则消耗的NH3与NO3-的物质的量之比为5∶3。
(6)硝酸钡受热分解生成氧化钡、二氧化氮和氧气,方程式为2Ba(NO3)22BaO+4NO2↑+O2↑,标准状况下aL此混合气体溶于水可生成硝酸,其中45为NO2,则生成硝酸的物质的量为4a5×22.4ml,c=nV=a28bml/L。
思路分析 钡泥中加入稀硝酸时,碳酸钡生成硝酸钡、二氧化碳和水,亚硫酸钡生成硫酸钡、NO和水,Ba(FeO2)2生成硝酸钡、硝酸铁和水,则气体1为二氧化碳,滤渣1为硫酸钡;加入碳酸钡调节pH,可使铁离子生成氢氧化铁沉淀,则滤渣2为氢氧化铁;加入氢氧化钡中和溶液中过量的硝酸,生成硝酸钡溶液,则母液为硝酸钡饱和溶液;高温焙烧硝酸钡晶体可生成氧化钡、二氧化氮和氧气。
名师点睛 混合气体溶于水恰好完全吸收生成硝酸,硝酸的物质的量与二氧化氮的物质的量相等。
8.金属钒熔点高、硬度大,具有良好的可塑性和低温抗腐蚀性。工业常用钒炉渣(主要含FeO·V2O3,还有少量Al2O3、CuO等杂质)提取金属钒,流程如图:
已知:
Ⅰ.钒有多种价态,其中+5价最稳定。钒在溶液中主要以VO2+和VO3-的形式存在,存在平衡:VO2++H2OVO3-+2H+。
Ⅱ.部分离子的沉淀pH:
回答下列问题:
(1)碱浸步骤中最好选用 (填字母)。
a.NaOH溶液 b.氨水 c.纯碱溶液
(2)焙烧的目的是将FeO·V2O3转化为可溶性NaVO3,其中铁元素全部转化为+3价的氧化物,写出该反应的化学方程式: 。
(3)溶液1到溶液2的过程中,调节pH至8有两个目的,一是除去 ,二是促使 。
(4)沉钒过程中得到NH4VO3沉淀需要洗涤,写出实验室洗涤的操作方法: 。
(5)常用铝热反应由V2O5冶炼金属钒,请写出反应的化学方程式: 。
(6)钒的化合物也有广泛的用途,如一种新型铝离子可充电电池的结构如图所示。
已知放电时电池反应为xAl+VO2AlxVO2↓,则放电时正极的电极反应式为 。
答案 (1)a
(2)4FeO·V2O3+4Na2CO3+5O28NaVO3+2Fe2O3+4CO2
(3)Fe3+、Cu2+ VO2+转化为VO3-
(4)洗涤时应往漏斗中加水至浸没沉淀,让水自然流下,重复2~3次
(5)10Al+3V2O55Al2O3+6V
(6)VO2+xAl3++3xe-AlxVO2
解析 钒炉渣含有FeO·V2O3、Al2O3、CuO,进行碱浸,氧化铝溶解形成偏铝酸盐,过滤后滤液1含有偏铝酸盐,通入二氧化碳得到氢氧化铝沉淀,经过加热分解可得到氧化铝;滤渣1中加入Na2CO3在空气中焙烧,再用足量的硫酸溶解,溶液1中含有铜离子、铁离子,调节pH至8,铜离子、铁离子沉淀完全,过滤得到的滤渣2应为氢氧化铜和氢氧化铁;由于溶液1中存在平衡VO2++H2OVO3-+2H+,酸过量会抑制生成VO3-,所以要调节溶液的pH,过滤得溶液2中钒元素主要以VO2+和VO3-的形式存在,再加入硫酸铵转化为NH4VO3,NH4VO3焙烧得到V2O5,V2O5发生铝热反应得到V。
(1)根据上面的分析可知,碱浸要使氧化铝溶解,所以只能用强碱,a项正确。
(2)焙烧的目的是将FeO·V2O3转化为可溶性NaVO3,其中铁元素全部转化为+3价的氧化物,根据此信息可知方程式为4FeO·V2O3+4Na2CO3+5O28NaVO3+2Fe2O3+4CO2。
(5)利用铝热反应由V2O5冶炼金属钒的化学方程式为10Al+3V2O55Al2O3+6V。
(6)该电池的负极为铝,铝失电子发生氧化反应,电极反应式为Al-3e-Al3+。电池的总反应为xAl+VO2AlxVO2↓,则正极的电极反应式为VO2+xAl3++3xe-AlxVO2。开始沉淀时pH
完全沉淀时pH
Zn2+
5.4
6.4
Fe3+
1.1
3.2
Fe2+
5.8
8.8
Cu2+
5.6
6.4
软锰矿用量(g)
15
20
25
30
35
铜的浸出率(%)
84.0
86.5
89.8
89.9
89.9
浸出剂
浸出液化学成分/(g·L-1)
钴浸出率/%
C
Al
(a)HCl
80.84
5.68
98.4
(b)H2SO4
65.0
6.22
72.3
(c)H2SO4+Na2S2O3
84.91
5.96
98.0
T/℃
5
10
15
25
30
钪的萃取率/%
91.3
96
97.1
97.3
98.0
钛的萃取率/%
0.94
0.95
2.10
3.01
4.20
沉淀物
Fe(OH)3
Fe(OH)2
C(OH)2
Al(OH)3
Mn(OH)2
开始沉淀
2.7
7.6
7.6
4.0
7.7
完全沉淀
3.7
9.6
9.2
5.2
9.8
Cu2+
Fe2+
Fe3+
开始沉淀PH
5.2
7.6
2.7
完全沉淀pH
6.4
9.6
3.7
2022版高考化学选考山东专用一轮总复习集训:专题十化学能与热能 —应用集训: 这是一份2022版高考化学选考山东专用一轮总复习集训:专题十化学能与热能 —应用集训,共12页。
2022版高考化学选考山东专用一轮总复习集训:专题六金属及其化合物 —基础集训: 这是一份2022版高考化学选考山东专用一轮总复习集训:专题六金属及其化合物 —基础集训,共10页。
2022版高考化学选考山东专用一轮总复习集训:专题六金属及其化合物 模块卷: 这是一份2022版高考化学选考山东专用一轮总复习集训:专题六金属及其化合物 模块卷,共16页。













