





高考化学专题复习 专题八 水溶液中的离子平衡_微专题8 “滴定”曲线类图像探究学案
展开微专题8 “滴定”曲线类图像探究
◆典型案例
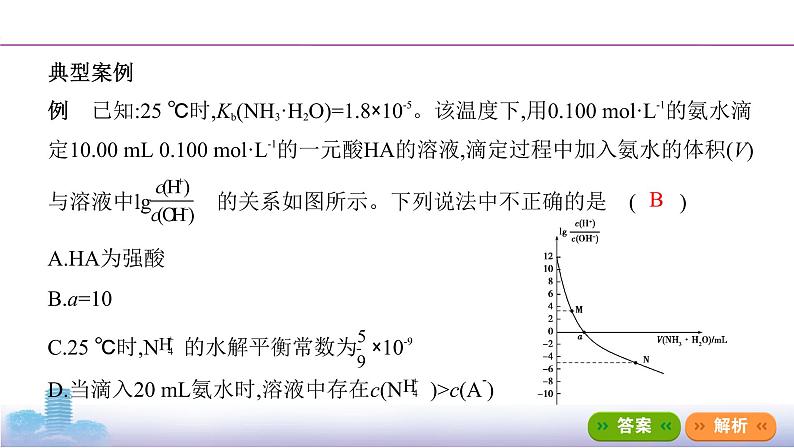
例 已知:25 ℃时,Kb(NH3·H2O)=1.8×10-5。该温度下,用0.100 mol·L-1的氨水滴定10.00 mL 0.100 mol·L-1的一元酸HA的溶液,滴定过程中加入氨水的体积(V)与溶液中lg的关系如图所示。下列说法中不正确的是 ( )
A.HA为强酸
B.a=10
C.25 ℃时,N的水解平衡常数为×10-9
D.当滴入20 mL氨水时,溶液中存在c(N)>c(A-)
答案 B 25 ℃时,0.100 mol·L-1的一元酸HA的溶液中lg=12,结合水的离子积常数可知溶液中H+浓度为0.100 mol·L-1,A项正确;lg=0时溶液显中性,二者恰好反应时溶质为NH4A,此时溶液呈酸性,氨水应略过量,即a>10,B项错误;25 ℃时,N的水解平衡常数为KW/Kb=×10-9,C项正确;当滴入20 mL氨水时,氨水过量,溶液显碱性,根据电荷守恒可知,溶液中c(N)>c(A-),D项正确。
名师点拨
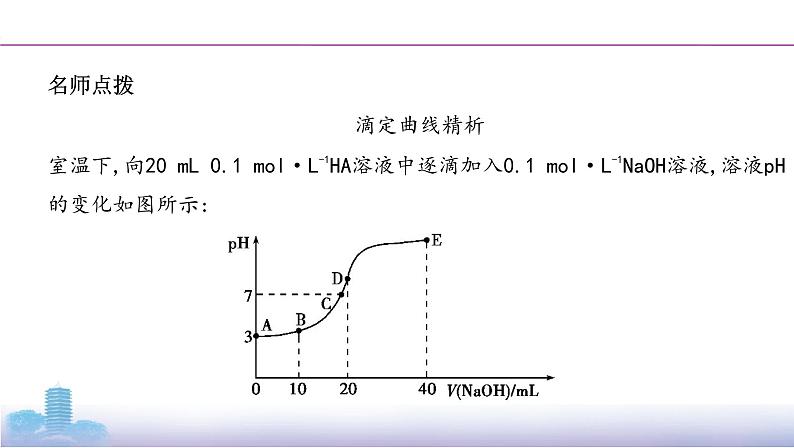
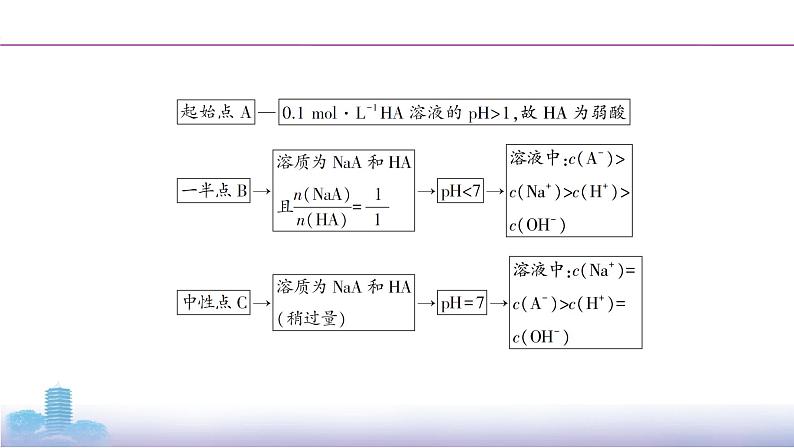
滴定曲线精析
室温下,向20 mL 0.1 mol·L-1HA溶液中逐滴加入0.1 mol·L-1NaOH溶液,溶液pH的变化如图所示:
1.(2020北京西城模拟)室温下将0.1 mol·L-1的烧碱溶液不断滴加到10.00 mL相同浓度的HA溶液中,溶液中-lg c水(H+)[注:c水(H+)为溶液中水电离的H+浓度]与NaOH溶液的体积关系如图所示。下列说法不正确的是 ( )
A.0.1 mol·L-1 HA溶液pH=3
B.b点溶液中存在:c(H+)+c(HA)=c(OH-)
C.a、b、c三点溶液中,a点溶液导电性最强
D.a、c两点溶液中均存在:c(H+)+c(Na+)=c(OH-)+c(A-)
答案 C 由题图可知,在未加入烧碱时,酸溶液中-lg c水(H+)=11,则c水(H+)=c水(OH-)=10-11 mol·L-1,根据水的离子积常数,酸性溶液中的KW=c酸(H+)×c水(OH-),得出:c酸(H+)==
10-3 mol·L-1,则pH=3,故A正确。b点时NaOH和HA恰好完全反应生成NaA,在NaA溶液中存在质子守恒:c(H+)+c(HA)=c(OH-),故B正确。a点HA过量,溶液中的溶质主要以HA分子和少量的NaA形式存在;b点酸碱恰好完全反应生成强电解质NaA,导电性增强;c点NaOH过量,因溶液体积增大而使离子浓度减小,导电性减弱;导电性最强的为b点,故C错误。a、c点的溶液中均存在电荷守恒:c(H+)+c(Na+)=c(OH-)+c(A-),故D正确。
2.(2020江西南昌模拟)室温时,用0.100 0 mol/L NaOH溶液分别滴定20.00 mL 0.100 0 mol/L HCl溶液和20 mL 0.100 0 mol/L CH3COOH溶液,得到如图所示两条滴定曲线,下列说法不正确的是 ( )
A.图1表示NaOH溶液滴定盐酸的曲线
B.a=20
C.图2中,pH=7,c(CH3COO-)=c(Na+)
D.图1中,由水电离的c(H+)一直增大
答案 D 题图1中,NaOH溶液的加入量从0至a mL过程中,盐酸浓度逐渐降低,对水的电离抑制作用减弱,到a mL时所得溶液为氯化钠溶液,对水的电离无影响,a mL以后溶液为氯化钠和氢氧化钠的混合溶液,且氢氧化钠的浓度逐渐增大,对水的电离又起到抑制作用,所以由水电离的c(H+)先增大后减小,故D错误。
3.(2020湖南长沙模拟)在某温度时,将n mol·L-1氨水滴入10 mL 1.0 mol·L-1 盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是 ( )
A.a点KW=1.0×10-14
B.b点:c(N)>c(Cl-)>c(H+)>c(OH-)
C.25 ℃时,NH4Cl水解常数为(n-1)×10-7(用n表示)
D.d点水的电离程度最大
答案 C A项,KW与温度有关,温度越低KW越小,由题图可知,a点时溶液温度低于25 ℃,则KW<1.0×10-14,错误;B项,b点时溶液的pH<7,则c(H+)>c(OH-),根据电荷守恒可知:c(Cl-)>c(N),溶液中离子浓度大小关系为c(Cl-)>c(N)>c(H+)>c(OH-),错误;C项,25 ℃时溶液的pH=7,则c(H+)=c(OH-)=10-7 mol·L-1,c(N)=c(Cl-)=0.5 mol·L-1,根据物料守恒可知:c(NH3·H2O)=(0.5n-0.5)mol·L-1,则25 ℃时NH4Cl水解常数Kh==(n-1)×10-7,正确;D项,b点溶液温度最高,说明此时恰好反应生成氯化铵,铵根离子水解促进了水的电离,a、d两点都抑制了水的电离,因此b点水的电离程度最大,错误。
4.(2020福建模拟)常温时,用0.100 0 mol/L NaOH溶液滴定25.0 mL 0.100 0 mol/L某一元酸HX溶液,滴定过程中pH变化曲线如图所示。下列说法正确的是 ( )
A.B点是滴定终点
B.在A点:c(HX)>c(Na+)>c(X-)
C.C点溶液中c(Na+)>c(X-)>c(OH-)>c(HX)
D.0.1 mol/L NaX溶液的pH=8.5
答案 C 当NaOH溶液的体积为25.0 mL时恰好完全反应,B点所加NaOH溶液体积<25.0 mL,故B点不是滴定终点,故A错误;A点NaOH溶液体积为10.0 mL,此时溶液中的溶质为NaX与HX,由题图可知溶液呈酸性,即HX的电离程度>NaX的水解程度,故c(X-)>c(HX),故B错误;C点所加NaOH溶液体积为25.0 mL,此时两溶液恰好完全反应,溶质为NaX,NaX属于钠盐会完全电离,电离出的X-部分水解形成HX与OH-,结合水电离出的OH-,则有c(Na+)>c(X-)>c(OH-)>c(HX),故C正确;C点所加NaOH溶液体积为25.0 mL,即等溶度等体积反应,则c(NaX)==0.050 0 mol/L,此时pH=8.5,故D错误。
2024届高考化学一轮复习专题8第39讲滴定曲线和中和滴定的拓展应用能力学案: 这是一份2024届高考化学一轮复习专题8第39讲滴定曲线和中和滴定的拓展应用能力学案,共21页。
2022届高考化学二轮专题复习学案练习专题八 题型专训(三) 中和滴定的拓展应用: 这是一份2022届高考化学二轮专题复习学案练习专题八 题型专训(三) 中和滴定的拓展应用,共5页。
高考化学专题复习 专题八 水溶液中的离子平衡_微专题9 四大平衡常数及其应用学案: 这是一份高考化学专题复习 专题八 水溶液中的离子平衡_微专题9 四大平衡常数及其应用学案,文件包含微专题9四大平衡常数及其应用pptx、微专题9四大平衡常数及其应用docx等2份学案配套教学资源,其中学案共5页, 欢迎下载使用。












