









高考化学专题复习 专题七 化学反应速率和化学平衡 微专题7 数形结合突破化学平衡图像学案
展开微专题7 数形结合突破化学平衡图像
化学平衡图像是高考常考题型,一般考查速率—压强(或温度)图像、物质的量(或浓度)—时间图像、含量(或转化率)—时间—温度(或压强)图像、恒温线(或恒压线)图像等。图像作为一种思维方法在解题过程中也有着重要作用,可以将一些较为抽象的知识转化为图像,进行解决。图像中蕴含的信息具有简明、直观、形象的特点,化学平衡图像题的命题形式灵活,解题的关键是根据反应特点,明确反应条件,认真分析图像,充分挖掘蕴含的信息,紧扣化学原理,找准切入点解决问题。解答此类题目的一般思路和技巧如下:
1.化学平衡图像题的解题思路
2.化学平衡图像题解题技巧
(1)先拐先平数值大:在含量(或转化率)—时间曲线中,先出现拐点的先达到平衡,表示温度较高、有催化剂或压强较大等。
(2)定一议二:当图像中有三个量时,先确定一个量不变,再讨论另外两个量的关系,有时还需要作辅助线。
(3)三步分析法:一看反应速率是增大还是减小;二看v正、v逆的相对大小;三看化学平衡移动的方向。
类型一 速率—压强(或温度)图像
◆典型案例
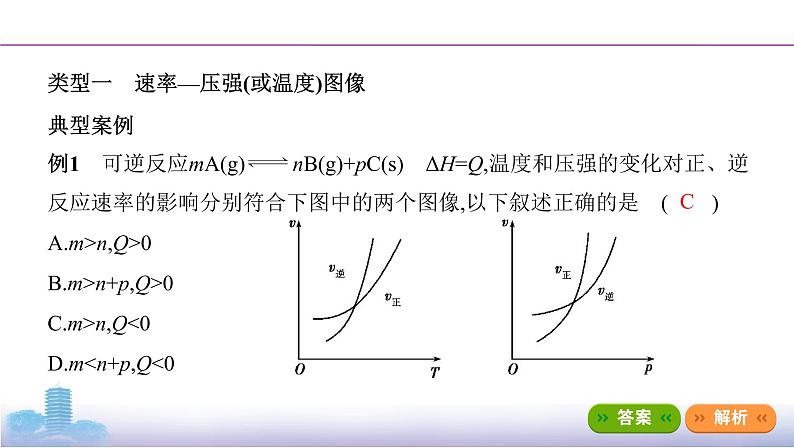
例1 可逆反应mA(g)nB(g)+pC(s) ΔH=Q,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图像,以下叙述正确的是 ( )
A.m>n,Q>0 B.m>n+p,Q>0
C.m>n,Q<0 D.m<n+p,Q<0
答案 C 由题图可知,正反应速率与逆反应速率的交点为平衡状态;达到平衡时,升高温度,v正、v逆都增大,且v逆>v正,平衡向逆反应方向移动,逆反应为吸热反应,故ΔH<0,即Q<0;达到平衡时,增大压强,v正、v逆都增大,且v正>v逆,平衡向正反应方向移动,正反应为气体体积减小的反应,故m>n,C正确。
规律方法
对于速率—温度(或压强)图像,随着温度逐渐升高或压强逐渐增大,反应速率会逐渐增大,因此图像上呈现的是平滑的递增曲线。
根据温度或压强对化学反应速率的影响,可以判断反应速率曲线的变化趋势。需要注意的是:
①温度或压强的改变对正、逆反应速率的影响是一致的,反映到图像上,就是v(正)、v(逆)两条曲线的走势大致相同;
②分析外界条件对反应速率的影响时,只能分析达到平衡之后化学反应速率的变化情况。
类型二 物质的量(或浓度)—时间图像
◆典例探究
例2 某温度下,A、B、C三种物质的浓度c随着时间t变化的关系如图所示,则该反应的化学方程式为 ,A的转化率为 。
答案 A+2B3C 33.3%
规律方法
浓度—时间图像注意图中转折点(达到平衡)的时刻相同,各物质浓度变化的内在联系,各物质浓度变化的比与化学方程式中的化学计量数的关系。解答此类问题要先弄清楚两个问题:何为反应物、生成物;反应物、生成物的化学计量数关系。
类型三 含量(或转化率)—时间—温度(或压强)图像
◆典型案例
例3 (2020江苏扬州期末)在恒容密闭容器中发生反应2SiHCl3(g)SiH2Cl2(g)+SiCl4(g)。在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。下列说法正确的是( )
A.323K时,缩小容器体积可提高SiHCl3的转化率
B.a、b点对应的反应速率大小关系:v(a)<v(b)
C.343K时,上述反应的化学平衡常数约为0.02
D.2SiHCl3(g)SiH2Cl2(g)+SiCl4(g)的正反应为放热反应
答案 C 2SiHCl3(g)SiH2Cl2(g)+SiCl4(g)反应中,气体的体积保持不变,则缩小容器体积,压强增大,平衡不移动,SiHCl3的转化率不变,故A项错误;由题图可知,a、b点对应的SiHCl3的转化率相等,根据先拐先平数值大原则可知,a点对应的温度高,则反应速率:v(a)>v(b),故B项错误;343K时,SiHCl3的平衡转化率为22%,设SiHCl3的起始浓度为1mol/L,则转化的SiHCl3物质的量浓度为1mol/L×22%=0.22mol/L,列出“三段式”如下:
2SiHCl3(g)SiH2Cl2(g)+SiCl4(g)
起始浓度(mol/L) 1 0 0
转化浓度(mol/L) 0.22 0.11 0.11
平衡浓度(mol/L) 0.78 0.11 0.11
因此343K时,上述反应的化学平衡常数=≈0.02,故C项正确;从题图可看出,升高温度,有利于SiHCl3的转化,则平衡向正反应方向移动,说明2SiHCl3(g)SiH2Cl2(g)+SiCl4(g)的正反应为吸热反应,故D项错误。
规律方法
1.先看拐点:先出现拐点的先达到平衡,表示T(或p)的数值较大;
2.再看平台:联系勒夏特列原理;
3.曲线的斜率反映了反应速率的大小。
类型四 恒温线(或恒压线)图像
◆典型案例
例4 (2020山东日照期中)已知向体积可变的密闭容器中充入一定量的CH4(g)和O2(g)发生反应生成CO(g)和H2(g),CH4(g)的平衡转化率与温度(T)和压强(p)的关系如图所示(已知T1>T2)。下列说法正确的是 ( )
A.该反应的ΔH>0
B.M、N两点的H2的物质的量浓度:c(M)>c(N)
C.温度不变时,增大压强可由N点到P点
D.N、P两点的平衡常数:K(N)<K(P)
答案 B 已知T1>T2,升高温度,CH4的平衡转化率降低,平衡向逆反应方向移动,逆反应为吸热反应,正反应为放热反应,ΔH<0,故A错误;由题意可知发生反应CH4+O22CO+2H2,压强增大,平衡逆向移动,同时体积缩小,故H2的物质的量浓度:c(M)>c(N),故B正确;两条曲线的温度不同,增大压强不能从N点到P点,故C错误;平衡常数只和温度有关,T1>T2,升高温度,平衡向逆反应方向移动,所以平衡常数变小,K(N)>K(P),故D错误。
规律方法
该图像中有两个变量,采用“定一议二”的方法,此题的关键点是做一条垂直的辅助线,以及恒温条件下分析压强的变化。该类题的解题方法:结合横坐标先看趋势,再做辅助线,最后比较纵坐标大小。
1.(2020云南昆明测评)某化学研究小组探究外界条件对化学反应mA(g)+nB(g)pC(g)的速率和平衡的影响图像如下,下列判断正确的是 ( )
A.由图1可知,T1<T2,该反应的正反应为吸热反应
B.由图2可知,该反应m+n<p
C.图3中,点3的反应速率:v正>v逆
D.图4中,若m+n=p,则曲线a一定使用了催化剂
答案 C 根据“先拐先平数值大”,由题图1可知温度:T1<T2,升高温度,C的体积分数减小,说明该反应的正反应为放热反应,故A错误;由题图2可知,温度相同增大压强,C的体积分数增大,说明正反应为体积减小的反应,即m+n>p,故B错误;温度一定时,题图3中曲线上任意一点都表示达到平衡状态,所以点2、4处于平衡状态,v正=v逆,点3在曲线下方,平衡向右移动,v正>v逆,故C正确;曲线a速率加快、平衡没移动,若m+n=p,曲线a可能使用了催化剂或加压,故D错误。
2.(2021江西南昌月考)对于反应:4CO(g)+2NO2(g)4CO2(g)+N2(g) ΔH=-1200kJ·mol-1,温度不同(T2>T1),其他条件相同时,下列图像正确的是 ( )
答案 B 升高温度,正、逆反应速率都发生突变,故A错误;升高温度,反应速率加快,平衡逆向移动,NO2的转化率减小,故B正确;增大压强,平衡正向移动,CO的体积分数减小,故C错误;升高温度,平衡逆向移动,化学平衡常数减小,故D错误。
3.(2020四川成都月考)T℃时,在一固定容积的密闭容器中发生反应:A(g)+B(g)C(s) ΔH<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是 ( )
A.T℃时,该反应的平衡常数值为4
B.c点没有达到平衡,此时反应逆向进行
C.若c点为平衡点,则此时容器内的温度高于T℃
D.T℃时,直线cd上的点均为平衡状态
答案 C 根据化学平衡常数的表达式并结合题图中曲线可知,K=1/[c(A)×c(B)]=1/4,故A错误;c点没有达到平衡,如果要达到平衡,应向d点移动,A、B的浓度降低,说明平衡向正反应方向移动,故B错误;如果c点达到平衡,此时的化学平衡常数小于T℃时的化学平衡常数,说明平衡向逆反应方向移动,即升高温度,故C正确;T℃时,只有曲线(实线)上的点处于平衡状态,c点不是平衡状态,故D错误。
4.(2020江西南昌模拟)硫酸是基础化工的重要产品,生产硫酸的主要反应为SO2(g)+O2(g)SO3(g)。
(1)恒温恒容下,平衡体系中SO3的体积分数φ(SO3)和y与SO2、O2的物质的量之比[n(SO2)/n(O2)]的关系如图1所示,则b点n(SO2)/n(O2)= ;y为 (填字母)。
A.平衡常数 B.SO3的平衡产率
C.O2的平衡转化率 D.SO2的平衡转化率
(2)①该反应的催化剂为V2O5,其催化反应过程为
SO2+V2O5SO3+V2O4 K1
O2+V2O4V2O5 K2
则在相同温度下2SO2(g)+O2(g)2SO3(g)的平衡常数K= (用含K1、K2的代数式表示)。
②其催化活性与温度的关系如图2所示。V2O5加快反应速率的原因是 。
(3)在7%SO2、11%O2、82%N2(数值均为气体体积分数)时,SO2平衡转化率与温度、压强的关系如图3所示,则计算460℃、1atm下,SO2(g)+O2(g)SO3(g)的Kp= (已知:各气体的分压=总压×各气体的体积分数)。
答案 (1)2 D (2)①(K1×K2)2 ②降低反应的活化能,活化分子百分数增大,有效碰撞概率提高 (3)117
解析 (1)根据题图1可知,随着n(SO2)/n(O2)的逐渐增大,φ(SO3)逐渐增大,当两者恰好完全反应时,φ(SO3)达到最大值;随着n(SO2)/n(O2)的继续增大,φ(SO3)又逐渐减小,故b点n(SO2)/n(O2)=2。温度不变,平衡常数不变,A不符合题意;随着n(SO2)/n(O2)的逐渐增大,φ(SO3)先逐渐增大后又逐渐减小,SO3的平衡产率也是先增大后逐渐减小,B不符合题意;随着n(SO2)/n(O2)的逐渐增大,反应不断向正反应方向移动,O2的平衡转化率逐渐增大,但是SO2的平衡转化率逐渐减小,故C不符合题意、D符合题意。
(2)①根据盖斯定律,将两个方程式相加后再乘以2得2SO2(g)+O2(g)2SO3(g),则K=(K1×K2)2。
②催化剂能够降低反应的活化能,活化分子百分数增大,有效碰撞概率提高,反应速率加快。
(3)各气体的分压=总压×各气体的体积分数,起始时SO2的分压为0.07atm,O2的分压为0.11atm,SO3的分压为0atm,平衡时,SO2的分压为0.07×(1-0.97)atm=0.0021atm,O2的分压为0.11-0.07×0.97×atm=0.07605atm,SO3的分压为0.07×0.97atm=0.0679atm,
Kp=≈117。
人教版高考化学一轮复习第8章化学反应速率和化学平衡专题讲座3化学平衡图像的分类突破学案含答案: 这是一份人教版高考化学一轮复习第8章化学反应速率和化学平衡专题讲座3化学平衡图像的分类突破学案含答案
人教版高考化学一轮总复习高考专题讲座3化学平衡图像的分类突破课时学案: 这是一份人教版高考化学一轮总复习高考专题讲座3化学平衡图像的分类突破课时学案,共8页。
高考化学一轮复习高考专题讲座4化学平衡图像的分类突破学案: 这是一份高考化学一轮复习高考专题讲座4化学平衡图像的分类突破学案,共12页。












